胞外和胞内菌胞外囊泡的功能及应用
王永玉, 徐兆坤, 马春骥, 郝秀静, 李 敏, 罗海霞
(宁夏大学 生命科学学院/西部特色生物资源保护与利用教育部重点实验室,宁夏 银川 750021)
细胞外囊泡(Extracellular Vesicles, EVs) 是从细胞膜上脱落或者分泌的双层膜结构的囊泡状小体[1-2],真核生物、细菌及古细菌等绝大多数具有细胞结构的生物,均可以分泌EVs。根据囊泡的大小,EVs可分为多种亚群[3],如微囊泡、微粒、外泌体、凋亡小体、包膜病毒、外泌颗粒等(表1)。国际上对这些细胞外囊泡的命名比较繁杂,包括exosomes、extracellular vehicles (EVs)、outer membrane vesicles (OMVs)、membrane vesicles (MVs)、Micro-vesicles、microparticles和cytoplasmic membrane vesicles (CMVs)等[4-5]。本文使用“细胞外囊泡(EVs)”表述这些细胞外囊泡结构。细菌细胞释放的具有膜结构的囊泡,即细菌胞外囊泡(EVs),其中包含蛋白质、脂质、核酸和代谢物等多种成分,这使EVs在细菌核酸水平转移、免疫逃逸、抗噬菌体和耐药性以及在调节宿主免疫,感染和入侵宿主细胞等方面起着重要作用[6]。胞外菌是一类寄居在宿主细胞外的细菌,侵入机体后在组织间隙和体液中繁殖与扩散,通过分泌毒素对机体造成损伤。常见的胞外菌有葡萄球菌、链球菌、脑膜炎球菌、淋球菌、厌氧芽胞梭菌和多种革兰阴性杆菌等。胞内菌是一类能够侵入宿主细胞内,并能在细胞内生长和增殖的细菌,常潜伏于机体内或引起机体长期慢性感染。布鲁氏菌、志贺氏菌、结核分枝杆菌、单核李斯特菌、马红球菌等均为胞内菌。现有研究显示胞外菌和胞内菌的EVs在释放机制、功能及临床应用等方面具有区别与联系[7-9],本文就此对近年来胞外菌和胞内菌EVs的相关研究进展进行综述。

表1 细胞外囊泡的亚群和大小
1 细菌分泌EVs机制
细菌EVs的分泌机制是近年来的研究热点,但目前大部分细菌EVs的分泌机制是基于研究提出的猜想。细菌EVs分泌机制包括以下四种说法:①EVs通过细菌外膜起泡形成[10]。革兰阴性菌细胞膜的稳定性依赖于外膜与细胞质膜间的脂蛋白与肽聚糖的共价连接,以及PG和肽聚糖相关脂蛋白(Peptidoglycan-associated lipoprotein, Pal)复合物之间的非共价相互作用。由于外膜与细胞质膜间的周质空间中肽聚糖片段或错误折叠蛋白质的积累在外膜上施加膨胀的压力,或者胞内肽酶减弱了Braun脂蛋白与肽聚糖之间的共价连接,这些因素使得外膜与肽聚糖之间共价键连接和非共价相互作用的减弱或丧失,导致外膜与肽聚糖层之间出现空隙,外膜起泡并最终夹断,由此导致OMVs的释放[10-11],以上途径产生的EVs包含外膜及周质空间的成分而不含细胞质,被称为外膜囊泡(Outer membrane vesicles, OMVs)[12-13]。②内溶素降解细胞壁。研究显示枯草芽胞杆菌产生的细胞质膜囊泡(Cytoplasmic membrane vesicles, CMV)的冷冻电子断层扫描图像显示,囊泡携带内溶素,其能降解细菌含肽聚糖的细胞壁,一旦肽聚糖被降解,细菌很容易破碎裂解,并且破碎的膜片段向上聚集并自组装成外-内膜囊泡(outer-inner membrane vesicles, OIMVs)和爆炸性外膜囊泡(Explosive outer- membrane vesicles, EOMVs),或者细胞质膜通过细胞壁孔突出,形成CMV[8,14]。③EVs从细胞质膜上释放后,通过压力挤压发生形变,穿过细胞壁,细胞壁的孔径或厚度可调节EVs的分泌[15],Brown等[9]研究发现,细菌细胞壁含有通道蛋白,EVs通过形变可通过直径比较窄的通道蛋白孔道。④EVs含有细胞壁降解酶。例如在金黄色葡萄球菌EVs中发现的肽聚糖水解酶N-乙酰胞壁酰-L-丙氨酸酰氨酶能够通过增加细胞壁的通透性释放EVs[16-17]。此外,细菌EVs的分泌还受到环境的影响,例如温度、营养物质、群体感应和作用于细菌细胞膜的抗生素等因素[18],其相关机制仍未被彻底阐明,需进一步的研究。
2 感染细胞后胞内菌EVs的释放机制
胞内致病菌感染宿主细胞后,不仅能够在宿主细胞内存活并增殖,还能分泌EVs到宿主细胞内,并通过胞吐的方式释放到胞外。Guidi等[19]研究发现感染了鼠伤寒沙门氏菌的上皮细胞上清中的外泌体含有细胞致死性扩张毒素(Cytolethal distending toxin, CDT)和鼠伤寒沙门氏菌脂多糖(lipopolysaccharide, LPS),这间接说明了细胞上清中可能含有致病菌分泌的EVs,并包含致病菌的毒力因子。随后Athman等[20]通过结核分枝杆菌感染巨噬细胞的实验发现,细胞上清中EVs包含两个成分截然不同的类群:一类包含宿主细胞标记(CD9、CD63),另一类包含结核分枝杆菌相关成分(脂多糖、脂蛋白)。Jung等[21]的研究证明,当致病菌感染宿主细胞后,细胞上清中的EVs含有宿主细胞成分和细菌成分,此时EVs来自两个亚群:细胞来源和细菌来源。如图1所示,胞内菌感染宿主细胞后,在宿主细胞内仍能够分泌细菌本身的EVs并通过膜泡运输的方式释放到宿主细胞外,宿主细胞自身也能够通过形成多泡体(multivesicular body,MVB)进而释放细胞来源的EVs。因此,从病原菌感染宿主细胞后的上清液中能够收集到宿主细胞来源和病原菌来源的EVs,鉴别两种来源的EVs并对其进行功能研究具有重要的意义。

图1 感染细胞后胞内菌EVs的释放Fig.1 Release of intracellular bacteria EVs after infected cells
3 细菌EVs的功能
细菌分泌的EVs具有多种功能及应用。如图2所示,其不仅能调控宿主细胞基因表达,抑制宿主免疫反应以及杀伤宿主细胞,还能够促进细菌自身基因的水平转移、营养获取、信息传递、介导病原菌免疫逃逸。且EVs在临床应用中也扮演着重要角色,如作为药物递送的载体以及作为良好的潜在疫苗等。功能的多样性和应用的广泛性使得细菌EVs的研究具有重要意义。
3.1 细菌EVs组分对宿主细胞的作用
胞外菌和胞内菌EVs含有蛋白质、脂质及核酸等多种成分,对宿主细胞具有调节作用。细菌EVs能与宿主细胞膜融合[22],并直接与宿主细胞表面上的受体相互作用以启动细胞内信号传递,并使细胞发生强烈炎症反应甚至死亡[23-25]。细菌EVs中含有细菌来源的DNA与RNA,能够在细菌间传递遗传信息,还能够与宿主细胞中特异性的小分子结合,发挥调节或沉默基因表达等功能[26]。此外,EVs含有白细胞毒素、腺苷酸环化酶溶血素、脂多糖(LPS)等大量毒力因子,能够对宿主细胞起杀伤作用。EVs中发现了能够促进细菌侵袭及毒力因子扩散作用的物质,包括破坏宿主细胞外基质(Extra-cellular matrix, ECM)的胶原酶和透明质酸酶,有助于破坏物理屏障的丝氨酸蛋白酶例如脱落性毒素[27-28]。综上所述,细菌分泌的EVs对宿主细胞起调节作用,包括调节或沉默基因表达、促进炎症信号传导、对宿主细胞杀伤作用等。
3.2 胞外菌EVs介导的免疫逃逸机制
胞外菌能够黏附在上皮表面并释放毒性物质引起局部化脓性炎症,宿主主要靠体液免疫产生抗体并协同吞噬细胞识别将其清除。胞外菌EVs能够抑制宿主的体液免疫。①抑制补体途径。Olaya等研究发现肺炎链球菌分泌的EVs包含的溶血素[29]不仅引起宿主细胞炎性反应,还可以进入到上皮细胞和树突状细胞中并与补体蛋白结合,导致补体介导的吞噬作用被抑制,从而促进肺炎链球菌的免疫逃逸[30]。②诱导T淋巴细胞凋亡并降解抗生素。蛋白质组学分析揭示了金黄色葡萄球菌EVs中含有α-溶血素和β-内酰胺酶,含有α-溶血素的金黄色葡萄球菌MVs能够导致宿主红细胞溶解的同时又能够诱导T淋巴细胞凋亡,并且当外源加入青霉素时,其EVs中的β-内酰胺酶可以降解青霉素以保护自身免受抗生素的破坏[31-32]。③抑制中性粒细胞的杀伤作用。中性粒细胞在感染早期清除胞外菌的过程中发挥着至关重要的作用,其通常通过吞噬微生物和分泌抗微生物剂两种策略杀死入侵的病原菌。Brinkmann等确定了中性粒细胞的第三个功能:NETs(Neutrophil extracellular traps)的形成[33]。NETs主要由中性粒细胞的DNA组成,其能够结合病原菌并允许中性粒细胞杀死胞外菌,同时最小化其对宿主细胞的损害[33-34]。从肺炎链球菌中分离的EVs通过免疫印迹发现EVs中存在一种高度保守的脱氧核糖核酸酶TatD,TatD具有核苷酸序列非依赖性内切脱氧核糖核酸酶活性能够有效降解NETs,从而逃避中性粒细胞杀死胞外菌[35]。④激活B细胞避免体液反应。有研究发现流感嗜血杆菌OMVs能刺激B细胞并使B细胞表面分子CD69和CD86的上调,以及IgM和IgG分泌的增加,但免疫球蛋白并不能识别病原菌,于是OMVs以独立于T细胞的方式促进B细胞活化以转移体液免疫反应,从而促进宿主内细菌的存活[36]。这一系列实验证明了胞外菌EVs能够通过各种方式达到免疫逃逸的目的。
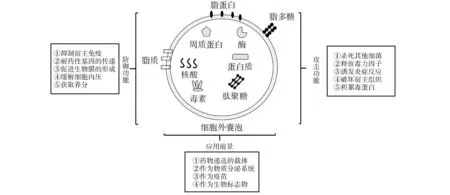
图2 细菌细胞外囊泡的病理生理功能Fig.2 Pathophysiological functions of bacterial extracellular vesicles
3.3 胞内菌EVs介导的免疫逃逸机制
胞内菌能够在宿主细胞内存活而不受体液免疫的影响,宿主细胞只能通过细胞免疫应答对其进行清除。病原菌也具有一系列免疫逃逸机制避免被宿主细胞识别和清除,EVs在病原菌免疫逃逸方面也发挥重要作用。胞内菌的固有免疫主要依赖于吞噬细胞和NK细胞的杀伤作用[37]。胞内菌侵入机体后,能够被巨噬细胞吞噬,胞内菌也能通过各种机制抵抗巨噬细胞对其的杀伤作用并隐匿其中,胞内菌EVs在这一过程发挥着巨大作用,主要包括:①EVs促进胞内菌复制。白介素1受体相关激酶1(Interleukin-1 receptor associated kinases 1,IRAK-1)介导NF-κB的下游激活,在Toll样受体(Toll-like receptor, TLR)和IL-1R信号传导中至关重要。有报道发现嗜肺军团菌EVs能刺激巨噬细胞,并导致巨噬细胞TLR2和NF-κB依赖的微小RNA-146a(miRNA-146a)的转录上调,导致白介素1受体相关激酶1(IRAK1)有效降解,从而导致嗜肺军团菌在巨噬细胞内的复制[38-39]。②EVs抑制T细胞活化。研究证明,结核分枝杆菌细菌囊泡中的脂多糖被转移至T细胞,抑制T细胞反应,从而促进了免疫逃逸[40]。③EVs抑制细胞自噬。一项研究显示单核细胞性李斯特菌EVs中的某一蛋白会阻断自噬机制的早期信号传导,并抑制李斯特菌溶血素O(listeriolysin O, LLO)诱导的细胞自噬,从而促进细胞内致病菌存活,但EVs并不会影响正常的细胞自噬,尚不清楚是哪一种蛋白抑制了细胞自噬。
EVs在介导细菌免疫逃逸方面发挥重要作用,但胞内菌与胞外菌EVs在介导免疫逃逸机制上存在共有和特有的方式。二者共有方面包括:二者都能够抑制T细胞活化。胞内菌金黄色葡萄球菌EVs中含有α-溶血素,能够诱导T淋巴细胞凋亡。胞外菌脑膜炎球菌OMVs中的opacity-associated (Opa)蛋白通过与CD4+T细胞上的人类癌胚抗原相关细胞黏附分子1(carcinoembryonic antigen-related cell adhesion molecule 1, CEACAM1)结合,在感染部位建立免疫抑制区以抑制T细胞活化和增殖[41]。胞外菌特有方面包括:①抑制补体途径;②抑制中性粒细胞的杀伤作用。胞内菌特有方面包括:①EVs促进胞内菌复制;②EVs抑制细胞自噬;③激活B细胞避免体液反应。研究证明胞内菌与胞外菌EVs在介导免疫逃逸机制上既相似又存在着区别,前者主要参与体液免疫过程,后者主要参与细胞免疫过程。由此可见, 只有更全面地表征不同类型的EVs膜表面和囊泡内部的成分,才能进一步揭示病原菌的致病机制。
3.4 细菌EVs介导的其他功能
除了介导病原菌宿主的免疫杀伤,细菌EVs还具有如下功能:①清除细菌细胞内的错误折叠蛋白或细胞内不需要的成分[42];②将毒力因子掺入EVs中递送到宿主细胞,引起宿主细胞免疫反应,但细菌一般不会把黏附因子掺入EVs,可能为了避免与细菌竞争黏附细胞[43];③从环境中获取营养物质,例如脑膜炎球菌的EVs富含铁转运蛋白FetA和FetB,能够富集环境中的铁以供致病菌的铁元素获取[44];④通过EVs杀死竞争细菌以促进自身生存[45];⑤介导细菌DNA的水平转移[46-47];⑥通过运输对细菌自身有益的蛋白质(如血红素载体蛋白HmuY)促进生物膜的形成[48-49];⑦细菌EVs还介导对特定抗生素的群体抗性。有研究[50]表明,在大肠埃希菌和铜绿假单胞菌的EVs释放后,EVs具有通过吸附抗生素和噬菌体促进细菌防御的作用,使细菌能够存活于致死浓度的抗生素中,EVs的蛋白质组学分析揭示了蛋白酶和肽酶的存在,这些蛋白酶和肽酶似乎参与了该过程,并且还发现了细菌的EVs形成了针对特定抗生素的共同防御[51]。
随着对细菌EVs的深入研究,越来越多的功能被发现和证明,这些细菌的EVs就像是一个个“快递包裹”一样维持着细菌与细菌、细菌与宿主之间的联系。同时,细菌EVs成分的多样性使其参与了细菌存活、侵袭、死亡等多个过程并发挥重要作用。然而,不同细菌所分泌的EVs之间功能的差异,不同方式分泌的EVs成分的差异,不同的EVs分离手段带来的差异等方面仍需进一步研究,从而为医学的进步与发展提供参考。
4 细菌EVs的临床应用
4.1 作为药物递送的载体
细菌EVs作为细菌与宿主细胞物质交换的媒介,能够长距离运输蛋白质和RNA等成分[13,52-53],这使得细菌EVs具有递送有治疗功能的核酸、多肽、脂类或小分子药物的潜能[54]。研究通常利用弱毒或无毒细菌(如大肠埃希菌)EVs,并通过基因突变的方式抑制细菌LPS表达或者使LPS中的类质A酰化不足,然后通过遗传和表面修饰来靶向目标细胞以及通过电穿孔的方法加载治疗性药物,从而治疗疾病。EVs可递送的药物类型包括:①小干扰RNA(siRNA)。由于在乳腺癌、卵巢癌、胃癌等细胞中观察到人表皮生长因子受体2(Human epidermal growth factor receptor, HER2)的过表达,Gujrati等[55]在具有低免疫原性的大肠埃希菌突变株的EVs膜上插入HER2作为配体,通过电穿孔的方法使其携带治疗性siRNA,在将重组EVs注射到小鼠体内发现其能杀死小鼠癌细胞并使肿瘤消退,且修饰后的EVs具有良好的稳定性和安全性。②小分子化合物。还有研究使用生物工程改造的大肠埃希菌MVs作为药物递送载体,通过MVs表面表皮生长因子受体(growth factor receptor, GFR)作为靶向配体,且内装载有抗肿瘤药物阿霉素(Adriamycin)或伊达比星(Idarubicin),由于上皮肿瘤细胞会过度表达GFR,所以在小鼠体内EVs能够靶向并杀死肿瘤细胞,展现了良好的治疗效果,且小鼠并无体重、体温及白细胞水平的异常[56]。
生物工程改造的EVs具有作为药物递送载体的潜力及以下优点:①具有生物相容性和低免疫原性;②具有高物理化学稳定性;③长距离及靶向运输能力;④穿越生物屏障(如血-脑屏障)等。但是,基于EVs的药物递送载体的开发仍然面临挑战,包括缺乏标准化的分离和纯化方法、EVs产量较低、药物加载效率低、成本太高以及一定潜在风险等。所以,如何更好地保证安全性、精准性并降低成本是目前需要解决的难题。
4.2 作为良好的潜在疫苗
后抗生素时代面临的细菌耐药使得人类急需开发更多类型的疫苗。EVs大小适当(20~200 nm),且包含病原体相关分子模式(pathogen-associated molecular patterns, PAMP)肽聚糖和外膜蛋白(如OmpA蛋白),它们可以被模式识别受体(pattern recognition receptor, PRR)识别结合,从而引起免疫反应,因此被认为是优良的候选疫苗[57-58]。目前最成功的例子是关于脑膜炎球菌OMVs疫苗的研究,研究显示脑膜炎球菌 OMVs可以刺激人类嗜中性粒细胞,导致TNF-α和IL-1β的产生以及CXCL8,CCL3和CCL4的上调[59],于是科学家利用脱氧胆酸盐去污剂提取野生型脑膜炎球菌OMVs,此方法提取的OMVs中LPS含量很低,在保证安全的同时具有良好的免疫原性,已成功用作预防性疫苗,以预防脑膜炎球菌疾病的爆发,古巴、挪威、智利、巴西和新西兰进行多期的临床实验表明,在24个月内,对于5岁以下的儿童,疫苗的有效性为80%[60]。另一个例子是抗百日咳博德特氏菌(Bordetellapertussis)的 OMVs疫苗,由灭活的百日咳博德特氏菌菌株165获得的OMVs中含有几种免疫原性抗原,包括百日咳毒素,菌毛和百日咳杆菌黏附素,疫苗在小鼠实验中显示出良好的保护作用[61]。还有报道发现肺炎链球菌、炭疽芽胞杆菌和金黄色葡萄球菌的EVs作为疫苗接种的效果明显,在小鼠模型中,接种上述细菌的EVs,再进行毒力因子的感染,结果发现小鼠存活时间延长且存活率显著提升[29,62-63]。鸭源鸡杆菌(Gallibacteriumanatis)中的tolR基因敲除突变体能够过量产生EVs,接种EVs后能诱导机体产生特异性抗体,并提供抗野生型G.anatis菌株感染的保护作用[64]。
充足的证据显示EVs具有成为疫苗的良好潜力,然而细菌EVs疫苗开发仍需解决很多难题,包括:①革兰阴性细菌细胞壁的LPS作为内毒素具有高致癌性,需要通过各种方法对其去除;②菌株变异形成许多特异性抗原的亚型,从而降低疫苗效果;③细菌EVs通常分泌量很少且较难分离,成本较高;④细菌EVs成分丰富,部分成分的功能未知,需要大量的研究进行探索。科学家正尝试通过基因改造细菌克服以上的难题。已经有研究通过基因工程改造无毒的金黄色葡萄球菌突变体可以过量产生无毒的细胞溶素,含有无毒细胞溶素的EVs具有免疫原性且无毒,并能够保护小鼠免受金黄色葡萄球菌的侵害[65]。当然,如何提高细菌EVs分泌量及降低其潜在危害仍是需要解决的问题。
5 展 望
早在20世纪60年代就有了关于细菌EVs的报道[66],研究者在大肠埃希菌培养基发现了一种囊泡状小体,被命名为out membrane vesicle(OMVs)。近十年来的深入研究表明,细菌EVs主要包括基础研究、功能研究和应用研究。细菌EVs基础研究包括分泌机制、分离与纯化、表征与检测和组分分析等;功能研究包括促进宿主炎症反应、免疫调节、诱导宿主细胞死亡、细菌耐药性、免疫逃逸等;临床应用包括疾病诊断、小分子药物的递送及疫苗研发等。其功能的多样性为我们提供了一个广阔的应用前景,但基础研究和机制研究的不完善已成为制约EVs应用发展的屏障,例如:①细菌EVs形成的机制对于其医学应用至关重要,但目前仍不清楚,细菌如何以及为何产生EVs?EVs的形成是自发的还是受调控的?如果受到调控,涉及哪些信号通路?这些研究可以帮助我们解决其产量低和组成复杂的问题;②细菌EVs的纯度是其应用的必要前提,这要求分离纯化技术的改进以确保其安全性和稳定性;③提取被细菌感染的宿主细胞EVs时,如何证明是细胞来源还是细菌来源;④尽管实验发现OMVs会导致宿主细胞引发炎症,但所涉及到的机制研究较少,以及机体的免疫识别受体是否能识别细菌EVs也缺乏充足的证据;⑤胞内菌和胞外菌具有不同的感染、致病和免疫逃逸机制,当它们感染宿主后,其EVs是否具有不同的作用机制。尤其目前对于致病菌感染的治疗依赖于抗生素,抗生素耐药性致病菌在临床接连出现使得EVs的研究更有必要性,相信经过不懈的努力细菌EVs将会为基础研究和医学发展提供一个全新的方向。

