渤海湾仿刺参养殖圈内贝莱斯芽胞杆菌B-VE的分离鉴定及其产抗菌脂肽的研究
冀倩倩, 孙建东, 王健伟, 杨艳宇, 齐洪庆, 刘 影, 简凡杰, 李 成
(大连工业大学 生物工程学院,辽宁 大连 116034)
近年来,由于抗生素的大量使用,环境微生物的抗药性逐渐增强,出现了多种新的致病菌[1-2]。因此,亟需研发新的抗生素类物质或新的抗菌物质[3-4]。海洋是地球生命的摇篮,蕴含了极其丰富的微生物资源[5]。相对于陆地微生物,高压、高盐、低营养等极端环境导致海洋微生物具有异于陆地微生物独特的代谢途径和代谢产物。这些特性导致海洋微生物具有很多结构新颖、活性特异的产物。研究发现,来源于海洋的微生物具有多种新型的抗菌活性物质[6-7]。国内外的研究者已从海洋、无脊椎动物、鱼类体内等各种样品中分离到了具有抗菌能力的细菌,其中对气单胞菌、弧菌等多种致病菌具有显著抑制效果[8-9]。罗曼等[5]从南极沉积物中筛选出1株对植物枯萎病致病菌木贼镰刀菌具有较好拮抗作用的枯草芽胞杆菌,并初步鉴定其抗菌物质为蛋白类物质。张少博等[10]从海洋微生物中筛选到1株具有稳定拮抗水稻黄单胞菌的深海独岛枝芽胞杆菌(Virgibacillusdokdonensis)A493,结果显示其活性物质很可能属于新的氨基糖苷类物质。田黎等[11]从东海大陆架、渤海等地筛选得到几株海洋芽胞杆菌,其代谢产生的抗菌蛋白对病原真菌具有强烈的抑制作用。本研究从渤海湾大连仿刺参养殖圈中筛选得到1株对多种指示菌具有明显抗菌效果的活性菌株,并对其抗菌物质进行了初步的分析和功能鉴定。
1 材料与方法
1.1 材料
1.1.1 样品 取自渤海湾海参养殖圈的海水和海泥。
1.1.2 指示菌 金黄色葡萄球菌(Staphylococcusaureus)、溶壁微球菌(Micrococcuslysodeikticus)、铜绿假单胞杆菌(Pseudomonasaeruginosa)、大肠埃希菌(Escherichiacoli),均为本实验室保藏。
1.1.3 培养基(g/L) ①LB培养基:酵母提取物(YE)5.0,胰蛋白胨(TRY)10.0,氯化钠10.0,琼脂粉20.0,去离子水配制,pH 7.4,121 ℃灭菌20 min;②通用分离液体培养基:牛肉膏4.0,蛋白胨4.0,酵母膏1.0,葡萄糖10.0,氯化钠0.25,琼脂粉20.0,去离子水配制,pH 7.0,121 ℃灭菌20 min。
1.1.4 主要仪器与试剂 电子天平(BSA2235,赛多利斯科学仪器(北京)有限公司);可见分光光度计(V-1000型,翔艺仪器(上海)有限公司);医用离心机(H2050R-1,湖南湘仪实验室仪器开发有限公司);旋转蒸发器(上海亚荣生化仪器厂);扫描电子显微镜(JSM-7800F,日本电子(JEOL));Multiskan Go酶标仪(赛默飞世尔科技(中国)有限公司);飞行时间质谱仪(MALDI-TOF)(ABSCIEX中国公司);立式自动压力蒸汽灭菌锅(GR85DP,致微(厦门)仪器有限公司)。结晶紫染色液、碘液、番红染色液等分析纯化学试剂,均购自大连美仑生物技术有限公司。
1.2 方法
1.2.1 菌株的初步分离 将辽宁省大连市渤海湾海参养殖圈采集的海泥和海水样本进行处理及富集培养。10 g海泥加入15 mL海水混匀,在其未完全沉淀时,吸取3 mL上部浑浊液放入250 mL通用分离液体培养基中,30 ℃,180 r/min富集培养24 h。将富集培养液进行10-1~10-9浓度梯度稀释,涂布于通用分离固体培养基,30 ℃倒置培养24 h后,灭菌牙签挑取单菌落,编号点样至通用分离固体培养基上继续培养。
1.2.2 从海水及海泥中筛选具有高产广谱抗菌活性物质的细菌 ①初筛:分别将革兰阳性菌溶壁微球菌、金黄色葡萄球菌和革兰阴性菌铜绿假单胞杆菌、大肠埃希菌,以1%(体积分数)接种量,接种于LB液体培养基中,37 ℃,180 r/min活化培养12 h。再吸取上述活化的四种指示菌,按1%(体积分数)接种量,分别接种于LB液体培养基中,37 ℃,180 r/min培养12 h,取30~50 μL菌液在LB固体培养基上涂布均匀,作为复筛高产抗菌活性物质的指示菌。将初步分离菌株的菌落用灭菌牙签按照编号一对一地分别挑到涂有4种指示菌的LB固体指示平板中,30 ℃培养12 h后,观察各个菌株的抑菌效果,并做好记录。通过比较,对4株指示菌均具有抑菌作用的菌株,即为对革兰阴性菌和阳性菌具有广谱抗菌能力的菌株,编号记录。②复筛:将上述筛选出的具有广谱抑菌作用的菌株,在LB固体培养基上划线分离纯化出单菌落,并进行传代培养。牛津杯法检测菌株的抑菌活性及其稳定性。将4种指示菌(溶壁微球菌、金黄色葡萄球菌、铜绿假单胞杆菌、大肠埃希菌)分别涂布LB固体培养基,并用镊子小心放上牛津杯。分别将传代10次的分离菌株进行发酵培养,将不同菌株的发酵液加入上述的牛津杯中,每1个菌株3~5个重复,最终筛选出具有稳定抑菌效果和广谱抑菌活性的菌株。测量这些菌株的抑菌圈大小,统计后进行分析,确定各个菌株的抑菌能力,筛选出具有高抑菌活性的菌株。
1.2.3 菌株的鉴定 ①形态观察及生理生化鉴定:目标菌株在通用固体培养基上30 ℃培养48 h 后, 观察菌株的菌落大小、颜色、透明度、表面光滑度、以及菌落的边缘形状,并拍照记录。革兰染色后,显微镜观察菌体形态。生理生化鉴定参考《常见细菌系统鉴定手册》和《伯杰细菌鉴定手册》。②16S rDNA鉴定:对应菌株经500 μL裂解液裂解后,通过菌落PCR,以16S rDNA序列扩增的通用引物8F(5′-CAAGTCGAGCGGACAGATGGGAGCT-3′)和1492R(5′-AGCTCCCATCTGTCCGCTCGACTTG-3′)扩增目标菌株的16S rDNA 序列。PCR 反应体系(50 μL):2×TaqPCR Mater Mix 25 μL,27F (10 μmol/L) 2 μL,1492R (10 μmol/L) 2 μL,Template DNA 2 μL, ddH2O 19 μL;PCR反应条件:94 ℃,5 min;94 ℃,30 s;53 ℃,30 s;72 ℃,90 s;35次循环;72 ℃,5 min。将扩增出的PCR产物送至上海生工生物技术有限公司测序。根据测序结果在NCBI核酸数据库上采用BLAST软件进行同源性搜索,初步判断菌株的分类地位。选择相关的参考菌株序列,再经Clustal X比对后,使用软件MEGA 7.0,采用Maximum Likelihood法构建菌株的系统发育树。
1.2.4 菌株的生长曲线及抑菌曲线 将菌种过夜活化后,1%(体积分数)接种到250 mL通用分离液体培养基中,30 ℃,180 r/min培养0、2、4、6、8、12、16、20、24、28、32、36、40、44、48、52、56、62和68 h,OD600测定发酵液浊度值,绘制生长曲线。将上述不同发酵时间的发酵液,以溶壁微球菌为指示菌,牛津杯法检测其抑菌圈大小,同时绘制其抑菌曲线,确定菌株发酵液的最佳抑菌效果的时间范围。
1.2.5 抑菌物质的粗分离 利用盐酸沉淀法和甲醇抽提法提取菌株发酵上清中的抑菌物质[12-13]。菌株发酵56 h后,离心收集发酵上清液。上清液中加入6 mol/L盐酸,使用酸碱度检测仪调节pH至2.0,4 ℃冰箱过夜沉淀。初步分离上清和下层悬浊液,4 ℃,12 000 r/min离心10 min,收集沉淀(淡黄色)。甲醇溶解沉淀物,经0.22 μm的有机滤膜过滤沉淀,40 ℃条件下,旋转蒸发仪旋转蒸干甲醇粗提液,得到此菌株代谢的抗菌物质的酸提粗提物。
1.2.6 抑菌物质的初步鉴定 分别称取3 mg粗提物溶于1 mL色谱级甲醇中混匀,经0.22 μm有机滤膜除杂质。取200 μL溶于甲醇的粗提物加入牛津杯中,以铜绿假单胞杆菌为指示菌,鉴定其抑菌活性[14]。取溶于色谱级甲醇的粗提物,利用飞行时间质谱技术(MALDI-TOF MS/MS)及Data Explorer软件分析其分子量,比对脂肽类化合物的标准分子量,初步确定菌株所产的脂肽类化合物种类[15]。
1.2.7 扫描电子显微镜观察抗菌活性物质对细菌生物膜的破坏作用 取24孔板,四周每孔加入2 mL PBS溶液,将直径为0.5 cm的方形玻片平铺在24孔板中,将活菌数为108cfu/mL(OD600为0.4左右)的溶壁微球菌菌液,37 ℃恒温培养24 h。吸弃培养基,0.9%氯化钠漂洗3次。分别加入1 mL LB液体培养基和20 μL粗提物,37 ℃培养0、0.5、1、3、12和24 h。吸弃培养基,0.9%氯化钠漂洗3次后,2.5%戊二醛固定12 h,PBS漂洗3次,每次10 min;依次用30%、50%、70%、90%乙醇进行乙醇梯度脱水,每次10 min,烘干;无水乙醇脱水1次(20 min),二氧化碳临界干燥、喷金,扫描电子显微镜观察生物膜,拍照[16-17]。
1.2.8 抗菌脂肽类粗提物的理化性质 准确称取棕黄色粉末粗提物10 mg,去离子水充分溶解制成粗提液,0.22 μm针孔式有机滤膜过滤,得到除杂无菌粗提液。分别检测粗提液经不同pH、温度、酶以及有机溶剂处理的条件下,对指示菌溶壁微球菌的影响。①pH对粗提物稳定性的影响:取10 mL无菌粗提液,调节pH至2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0,37 ℃温育2 h后pH调回中性。牛津杯法检测抗菌脂肽粗提物耐酸碱抑菌活性,每一组设置3组平行。②温度对粗提物抑菌活性的影响:将粗提液置于无菌EP管中,30、40、50、60、70、80、90和100 ℃条件下分别处理30、60和120 min。待样品自然冷却至室温后,牛津杯法检测抗菌脂肽粗提物抑菌活性,每一组设置3组平行。③酶对粗提物抑菌活性的影响:将粗提液的pH值调至胃蛋白酶、胰蛋白酶、木瓜蛋白酶、蛋白酶K的最适pH值,加入相应的酶至终浓度10 mg/mL,37 ℃水浴2 h后,80 ℃处理10 min停止酶反应,12 000 r/min离心10 min,获得上清液,以未经蛋白酶处理的粗提物作为对照(CK),每一组设置3组平行,牛津杯法检测抗菌脂肽粗提物抑菌活性。④有机溶剂对粗提物抑菌活性的影响:称取10 mg粗提物粉末,分别将氯仿、乙醇、异丙醇、乙腈、正丁醇、丙酮与灭菌去离子水按V水∶V有机溶剂=1∶1混合溶解粗提物,涡旋震荡仪震荡加速溶解。以去甲醇与水混合溶解的粗提物作为对照(CK),每一组设置3组平行,牛津杯法检测抗菌脂肽粗提物耐有机溶剂抑菌活性。
2 结果与分析
2.1 菌株的分离纯化及筛选
分别从渤海湾大连海域海参养殖圈海水及海泥中,粗分离得到892株菌。通过初筛和复筛,筛选出9株至少对两株指示菌具有抑菌效果的菌株(表1),其中大部分菌株只对革兰阳性菌溶壁微球菌和金黄色葡萄球菌具有抑菌作用。而菌株#344和#611对4株指示菌(G+/G-)均具有抑菌作用,其中菌株#344的抑菌效果强于菌株#611。因此,将菌株#344作为后续实验菌株。
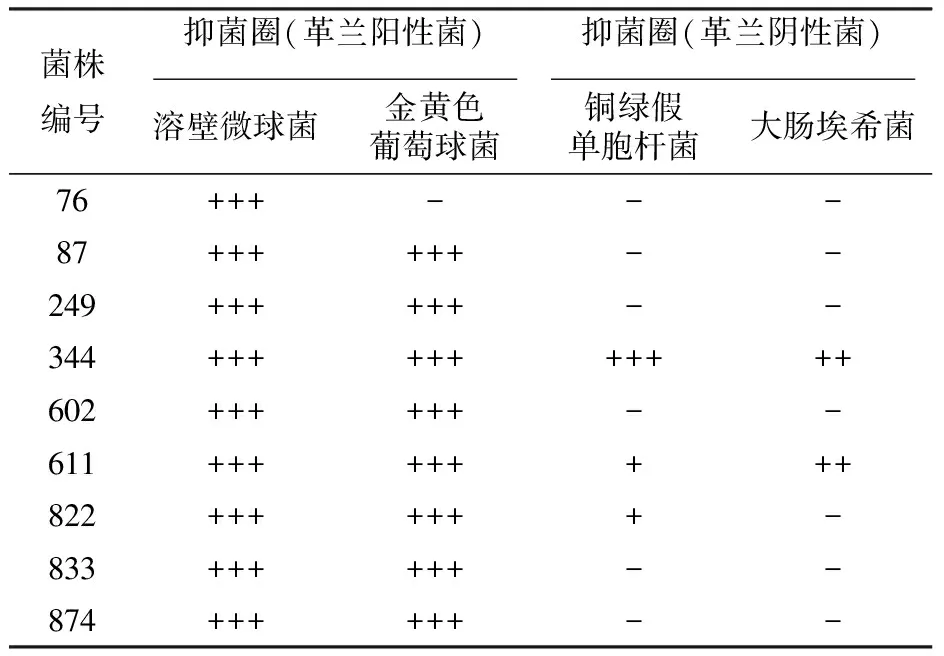
表1 9株初筛菌株的抑菌效果
2.2 菌株的鉴定
2.2.1 菌株形态观察 利用固体平板画线法,检测菌株#344的菌落形态,结果见图1。从图1A可见,菌株菌落为相对规则的圆形,乳白色,半透明,半湿润,边缘凸起且相对整齐。进一步革兰染色观察,结果如图1B,菌株#344革兰染色阳性,形状长杆状,长(3.1±0.2) μm左右,宽0.85 μm左右,无规则链状排列聚集。菌株#344的生理生化试验结果显示,革兰染色、硝酸盐试验、V-P试验淀粉、接触酶试验、明胶水解试验结果均呈阳性;甲基红试验、吲哚试验结果呈阴性。初步判断该菌株为芽胞杆菌属(Bacillussp.)。
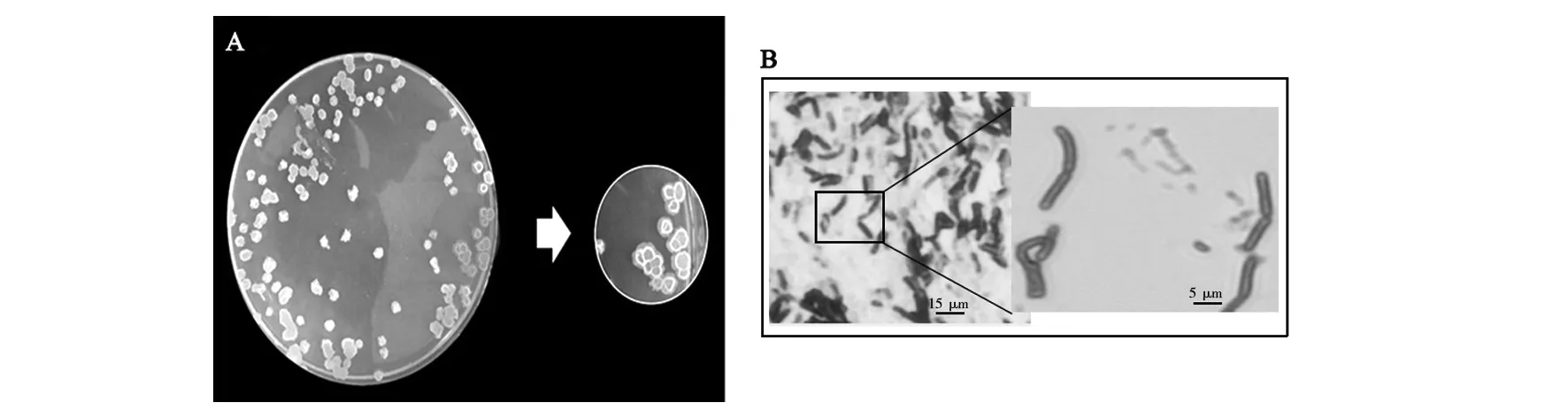
图1 菌株#344的菌落形态图(A)以及革兰染色后的镜检图(B)Fig.1 Colony morphology of strain #344 (A) and microscopic examination of strain #344 after Gram staining (B)
2.2.2 16S rDNA测序进行菌株鉴定 通过对16S rDNA保守序列进行测序,对筛选得到的菌株进行鉴定。利用通用引物8F/1492R,扩增出菌株#344的16S rDNA序列,琼脂糖凝胶电泳检测确定PCR扩增出单一片段且大小(约1 500 bp)与目标序列相似(图2)。将扩增出的条带分离纯化后测序,获得序列的详细信息。将测序获得的菌株16S rDNA序列在NCBI数据库上BLAST比对,进行同源性搜索。结果发现,菌株#344与Bacillusmethylotrophicusstrain HB25(KM659226.1,99.79%)、Bacillusmethylotrophicusstrain HB26(KM659227.1,99.79%)以及Bacillusmethylotrophicusstrain PY3(KC790266.1,99.79%)的序列相似度较高。在此基础上,选择了多条具有不同相似度的芽胞杆菌属已知菌株的16S rDNA序列,通过Clustal X比对后,利用软件MEGA 7.0,采用Maximum Likelihood法构建菌株#344的系统发育树(图3)。结果表明,所选的14个物种序列中,菌株#344与甲基营养型芽胞杆菌Bacillusmethylotrophicusstrain HB25(KM659226.1)聚在同一分支,且亲缘关系最近。但2016年后该种名已经归属到贝莱斯芽胞杆菌(Bacillusvelezensis)内[22]。基于上述结果,初步鉴定菌株#344为贝莱斯芽胞杆菌,并命名为B-VE。
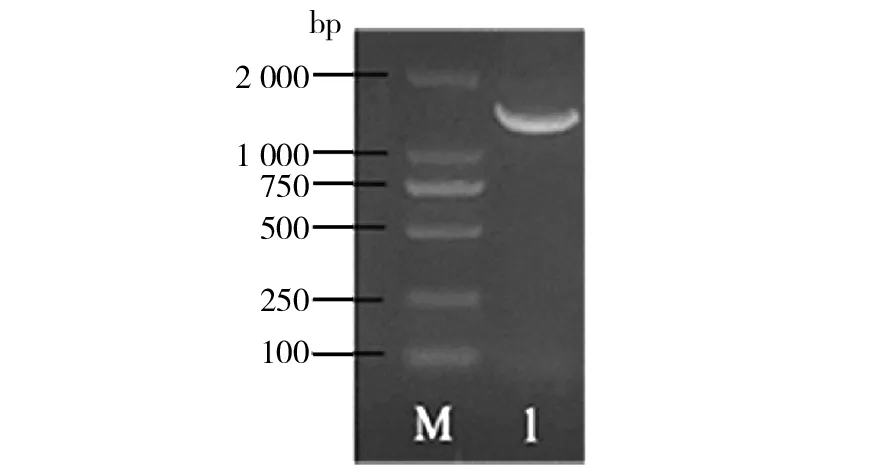
图2 琼脂糖凝胶电泳检测16S rDNA条带的扩增情况Fig.2 Amplification of 16S rDNA bands by agarose gel electrophoresis M:DNA标准分子质量;1:#344菌株的16S rDNA M: DNA marker; 1: 16S rDNA of #344 strain

图3 菌株B-VE的系统发育树Fig.3 Phylogenetic tree of strain B-VE 括号中序号代表菌株序列号;分支点上的数字代表可信度,数值越大,可信度越强;标尺代表遗传距离,标尺越短代表亲缘关系越近 The serial number in brackets represents the serial number of the strain. The number on the branch point represents the credibility, the larger is more credible; The ruler represents genetic distance, and the shorter shows the more closely related
2.3 菌株B-VE的生长曲线及其产抑菌物质曲线
为了确定菌株B-VE产抑菌活性物质的时间,对菌体的生长曲线和抑菌曲线进行了检测。结果如图4所示,经过4 h的延滞期,菌体开始快速生长、分裂,进入生长对数期;32 h后,菌体生长进入平台期。由图4可知,0~8 h时,发酵液没有明显地抑菌效果,8~44 h时,抑菌能力逐渐提高,抑菌圈直径大小约为6~8 mm。随着发酵时间的延长,发酵液的抑菌活性逐渐提高,48~68 h时,抑菌效果最好,抑菌圈直径>8 mm。基于上述结果,确定菌株B-VE的最佳发酵时间为56 h。

图4 菌株B-VE的生长曲线和不同时间 发酵液的抑菌情况Fig.4 Growth curve and bacteriostasis curve of strain B-VE at different fermentation time
2.4 菌株B-VE发酵液中抑菌物质的粗提取与初步鉴定
研究表明,芽胞杆菌产生的次级代谢产物中含有多种抗菌化合物,环脂肽(LPs)类物质是其中比较常见的一种[17]。More等[18]对64株芽胞杆菌进行了脂肽基因鉴定,发现其中48.4%的菌株含有2~4个脂肽基因。环脂肽是一类抗菌物质,包括伊枯草菌素(iturin)、芬荠素(fengycin)和表面活性素(surfactin)等三大类,具有抑菌、促生、诱导防御酶活性等特点[5]。研究人员目前从海洋中分离的多种贝莱斯芽胞杆菌中,均发现含有一种或多种环脂肽类化合物[12-14]。根据菌株的生长曲线及其抑菌曲线,发现菌株的抑菌活性物质是在菌株生长到一定阶段后开始产生的。基于上述原因,推断本研究筛选的具有抑菌作用的贝莱斯芽胞杆菌B-VE可能产生脂肽类化合物。因此,利用酸沉法对菌株B-VE发酵液中的代谢产物进行粗提。粗提物溶于甲醇后,以溶壁微球菌为指示菌,通过牛津杯法鉴定其抑菌活性,如图5所示,粗提物对指示菌溶壁微球菌具有较强的抑菌活性。

图5 酸沉法粗提菌株B-VE的抑菌物质(A)以及 牛津杯法检测抑菌粗提物对溶壁微球菌的抑菌作用(B)Fig.5 The antibacterial substance (A) of crude extract of B-VE by acid precipitation method and Oxford method were used to detect the antibacterial activity of crude antimicrobial extracta on Micrococcus lysodeikticus (B) a:甲醇溶液对照组;b:抑菌物质5 mg/mL a:methanol solution control group; b: antimicrobial substance 5 mg/mL in figure B
实验进一步利用基质辅助激光解吸附飞行时间质谱(MALDI-TOF MS)检测菌株B-VE酸沉粗提的环脂肽类物质的分子量,并根据分子量初步判断其所产的环脂肽的具体类型。根据MALDI-TOF MS的结果,发现菌株B-VE所产的抗菌脂肽有三种类型(表2),分别属于Iturin家族、Fengcin A家族以及Bacillomycin D家族。根据分子量确定其含有Iturin家族中由14个碳原子形成的脂肽C14 ([M+H]+=1 044.410 11; [M+Na]+=1 066.414 45)、C15 ( [M+H]+=1 058.424 49; [M+Na]+=1 080.416 18)两个成员和Fengcin A家族中的C15 ([M+H]+=1 449.685 48; [M+Na]+=1 471.648 51)、C16 ([M+H]+=1 463.698 94; [M+Na]+=1 485.643 16)、C17 [M+H]+=1 477.655 82; [M+Na]+=1 499.620 77; [M+K]+=1 515.609 55)和C18 ([M+H]+=1 491.616 65; [M+Na]+=1 513.663 832; [M+K]+=1 529.600 97)四种物质以及Bacillomycin D家族中的C15([M+H]+=1 045.400 59;[M+Na]+=1 067.432 87)(表3)。综上所述,菌株B-VE粗提物中含有的抗菌脂肽类物质主要包括Iturin C14-C15、Bacillomycin D C15和Fengcin A C15~C18。
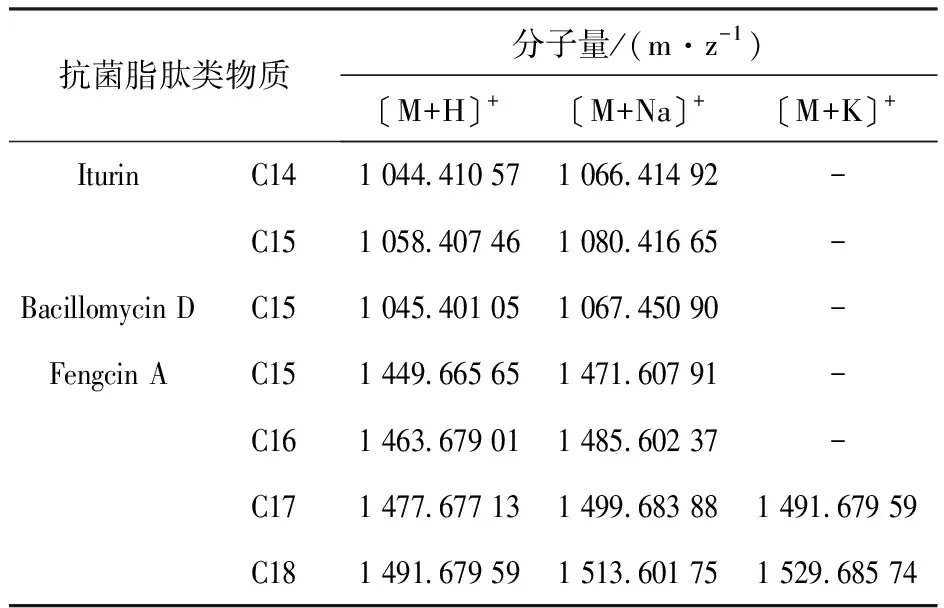
表2 菌株B-VE粗提物中抗菌脂肽的分子量
2.5 SEM检测菌株B-VE的粗提物对溶壁微球菌的抑菌情况
根据B-VE的脂肽物质推出其可以破坏细菌生物膜。利用扫描电子显微镜(SEM)观察B-VE发酵产生的脂肽物质对溶壁微球菌细胞壁和细胞膜的破坏情况,结果见图6。放大20 000×可见0 h时,溶壁微球菌的菌体边缘清晰、饱满、整齐、完整、无缺陷;0.5 h时,菌体表面出现褶皱;1 h时,菌体表面明显出现凹陷,菌体变形;3 h时,菌体破裂,细菌表面透明;12 h后细菌基本形态彻底变形,细胞膜破裂流出的细胞质包裹着其他细菌。24 h细胞质全部流出,细菌彻底死亡。
以上结果表明,B-VE产生的抗菌脂肽,推测应该是其在溶壁微球菌的细胞膜上形成了孔道造成了细胞内物质泄漏,使细菌不能保持正常的渗透压,导致细菌细胞膜破碎,细菌内容物流出,细菌无法进行正常的新陈代谢,导致细菌生物膜内细菌死亡[16]。由于细菌生物膜内活细菌数降低,导致细菌在生长繁殖时分泌胞外聚合物减少,生物膜的黏性降低,导致生物膜脱落,从而降低了细菌的生物膜含量[19-20]。
2.6 B-VE菌株抗菌脂肽类粗提物的稳定性
实验结果表明,该抗菌脂肽类粗提物的抑菌效果在pH 8.0时最好。当pH为5.0~8.0时,该抗菌脂肽类粗提物也具有较高稳定的抑菌效果。但是当pH继续升高至9.0~11.0时,目标物质的抑菌活性显著下降(图7A)。从图7可知,贝莱斯芽胞杆菌B-VE的抗菌脂肽类粗提物对pH较为敏感,但是在pH为4.0~10.0的范围内对溶壁微球菌具有较强的抑菌活性。
在20~40 ℃的范围内,无论孵育时间的长短,抗菌脂肽类粗提物对溶壁微球菌均具有较强的抑制作用;随着温度的逐渐升高(50~80 ℃),抗菌脂肽类粗提物的抑菌活性出现了一定程度的下降,同时其活性随着孵育时间的延长出现轻微降低,但是,在此温度范围内抗菌脂肽类粗提物对溶壁微球菌仍具有较高的抑菌作用。当温度≥90 ℃后,抗菌脂肽类粗提物的活性明显下降,100 ℃时其抑菌作用基本消失(图7B)。根据上述结果可知,贝莱斯芽胞杆菌B-VE的脂肽类物质的最适抑菌温度为20~40 ℃,且其具有一定的耐高温特性。
表3表明,目标菌株抗菌脂肽类粗提物的脂肽类化合物对多种蛋白酶,如胃蛋白酶、木瓜蛋白酶、蛋白酶K和胰蛋白酶均不敏感,在37 ℃处理60 min后均能对溶壁微球菌保持较高的抑菌活性。
贝莱斯芽胞杆菌的脂肽提取物能够溶于多种有机溶剂。表4结果表明,粗提物在乙醇和异丙醇溶液中保持了绝大部分的活性,抑菌圈直径达(16.9±0.21) mm和(15.2±0.36) mm。在氯仿和正丁醇存在时,脂肽提取物会失去部分活性(81.98%和80.81%)。但是,抑菌圈的变化趋势表明该脂肽提取物在这几种常用的有机溶剂中均具有较好的稳定性。

表3 不同蛋白酶处理后抗菌活性蛋白 对溶壁微球菌的抑菌活性

表4 有机溶剂对脂肽提取物抑菌活性的影响

图6 扫描电镜(SEM)检测菌株B-VE抑菌粗提物对溶壁微球菌的裂解作用Fig.6 Scanning electron microscopy (SEM) was used to detect the lysis effect of the crude antibacterial extract of strain B-VE on Micrococcus lysozyme a~f分别代表B-VE产生的抗菌抑菌物质处理溶壁微球菌0、0.5、1、3、12和24 h的样品 a-f represents the antibacterial substances produced by B-VE to deal with the samples for 0,0.5,1,3,12 and 24 h, respectively

图7 不同pH处理后(A)以及不同温度处理后(B)抗菌脂肽类粗提物对溶壁微球菌的抑菌作用Fig.7 The antibacterial effect of crude antimicrobial lipopeptide extracts on Micrococcus lysodeikticus after different pH treatments (A) and different temperature treatments (B)
3 讨 论
贝莱斯芽胞杆菌在生物防治方面具有巨大的潜力,其来源非常丰富,广泛分布于海水、底泥、土壤、昆虫肠道、植物根际和叶片、鱼类肠道、动物粪便中[21]。作为拮抗菌株,贝莱斯芽胞杆菌已被大量分离和鉴定,其研究主要集中在陆地拮抗微生物筛选和研究中,所以近年来人们开始将目光转向生境独特的海洋微生物资源。王青华等[22]从西太平洋雅浦海沟6 000 m深的海水中分离的贝莱斯芽胞杆菌DH82具有较宽的抑菌谱和较强的抑菌活性。魏新燕等从沧州渤海湾海洋样品中分离的贝莱斯芽胞杆菌BH21(曾用名为甲基营养型芽胞杆菌[23]),该菌体及其发酵液对灰霉病菌均具有较强的拮抗作用[13]。本研究从渤海湾大连海域仿刺参养殖圈海水及海泥中筛选分离出的贝莱斯芽胞杆菌B-VE,对溶壁微球菌、金黄色葡萄球菌、铜绿假单胞杆菌、大肠埃希菌均具有良好的抑菌效果。通过酸沉法分离以及飞行时间质谱分析确定其含有三种抗菌脂肽,分别为伊枯草菌素(Iturin)、芬荠素(Fengycin A)和杆菌霉素(Bacillomycin D)。
贝莱斯芽胞杆菌主要通过分泌脂肽类抗生素、聚酮类化合物和抗菌蛋白等产生抑菌作用[24]。魏新燕等[13]的研究表明贝莱斯芽胞杆菌BH21菌株的有效活性成分是fengycin类脂肽,其对葡萄灰霉病菌有较强的拮抗作用。Gao等[25]通过基因组测序检测并鉴定出贝莱斯芽胞杆菌V4菌株能够产生伊枯草菌素、Macrolactin和Difficidin等抗菌物质,而且该菌株分泌的抑菌物质能够破坏杀鲑气单胞菌(Aeromonassalmonicida)细胞膜的完整性,与细胞表面相互作用,细胞膜形成穿孔,造成细胞内容物流失。本研究利用SEM检测B-VE发酵产生的脂肽物质对菌体细胞壁和细胞膜的破坏情况,主要表现在细菌的菌体表面出现褶皱、凹陷、变形、菌体破裂、细胞质流出、死亡等。这与已有的芽胞杆菌产生的脂肽类物质对病原真菌的抑制效果的报道基本一致。初步试验显示贝莱斯芽胞杆菌B-VE产生的主要抑菌物质对温度、pH、蛋白酶稳定,且能在几种常用的有机溶剂中保持一定的活性,这与之前报道的贝莱斯芽胞杆菌JK3产生的主要抑菌物质Surfactin、Bacillomycin、Bacillysin、Fengycin 和iturin A的理化特性相一致[26]。伊枯草菌素、芬荠素和杆菌霉素主要对真菌类微生物具有显著的抑制活性。但是研究发现,伊枯草菌素除了具有抗真菌的活性,也能对某些细菌类微生物,如黄褐微球菌具有明显的拮抗作用[27]。基于此,推测源于贝莱斯芽胞杆菌B-VE抗菌脂肽类粗提物中的伊枯草菌素在抑制指示菌的过程中发挥了一定的作用。但值得注意的是,由于使用的粗提物浓度较大,且贝莱斯芽胞杆菌也会产生其他类型的抑菌物质,所以不排除粗提物中存在其他活性成分并具有抑菌作用,这有待于进一步的研究。

