基于QuEChERS EMR-Lipid技术结合气相色谱-串联质谱测定陈皮中153种农药残留
陆颖,徐骞,付强强,刘桐,蔡恩茂,王文静,3b
1.上海市长宁区疾病预防控制中心 a.理化检验科 b.主任办公室,上海 200051
2.上海市疾病预防控制中心 a.化学品毒性检定所 b.慢性非传染性疾病与伤害防治所,上海 200336
3.同济大学附属杨浦医院 a.全科医学科 b.临床与转化医学中心,上海 200090
陈皮是芸香科植物橘及其栽培变种的干燥成熟果皮,作为中药饮片和复方制剂的原料,药用历史悠久,在国内外需求量很大。但在其原植物橘中,出现滥用农药导致的农残超标问题[1],影响陈皮的质量安全,危害人群健康。因此,建立高通量、快速灵敏的陈皮基质中农药残留检测方法,在保障陈皮安全使用方面具有重要意义。
农药多残留快速检测方法是开展中药材风险评估的主要筛查技术。目前,农药多残留检测方法主要有气相色谱-串联质谱法(gas chromatographytandem mass spectrometry,GC-MS/MS)[2]、液相色谱-串联质谱法(liquid chromatography-tandem mass spectrometry,LC-MS/MS)[3],其中结合QuEChERS(Quick,Easy,Cheap,Effective,Rugged,Safe)前处理技术的GC-MS/MS 检测方法由于操作简单、有机溶剂用量少、分析效率高而应用最广。
陈皮中含大量的挥发油、色素和生物碱等物质,其中挥发油占总质量的2%~4%左右[4],使得前处理存在净化效率低、基质效应大等困难。有研究报道采用固相萃取小柱-LC-MS/MS和QuEChERS-GC-MS/MS分别测定陈皮中农药残留[5],此研究无法通过一种检测手段完成对多农残的分析,实验步骤多、耗时长。此外,所涉及农药的数量最多几十种,限制了方法的实用性。增强型脂质吸附材料(enhanced matrix removal,EMR)可以去除基质中脂类干扰且不造成分析物损失[6],常用于肉类样品前处理方法中,还没有在中药材中使用的报道。本研究首次将新型净化材料EMR 用于QuEChERS前处理方法中,针对性除去中药材基质中油脂成分,采用基质匹配标准溶液校准和内标法降低基质干扰,建立GC-MS/MS 快速测定陈皮中多种农药残留的检测方法。
1 材料与方法
1.1 主要仪器与试剂
7890A-7000 气相色谱-三重四级杆质谱联用仪(美国Agilent),5810R 高速离心机(德国Eppendorf),AG204电子天平(瑞士Mettler),Buchi Syncore 平行浓缩仪(瑞士Buchi)。
内标环氧七氯(纯度≥95%,德国Dr.Ehrenstorfer),153种农药混标套装(4组,每组质量浓度均为50 mg·L-1,北京振翔BePure),乙酸乙酯(色谱纯,德国Merck),乙腈(色谱纯,德国Merck),EMR 净化管(美国Agilent),十八烷基键合硅胶吸附剂(C18,中国安谱CNW),N-丙基乙二胺(primary secondary amine,PSA,美国Supelco),石墨化碳黑(graphitized carbon black,GCB,美国Supelco)。
1.2 方法
1.2.1 净化条件优化在空白陈皮基质中添加0.1 mg·kg-1混合标准溶液,考察1 mL上述溶液中加入不同质量的PSA(25、50、75、100 mg)和GCB(5、10、20、50、100 mg)的农药回收率,以验证其净化效果。在GC-MS/MS 仪器SCAN 模式下,分别比较经EMR 除脂、C18 除脂以及不除脂处理后的空白基质溶液。在空白陈皮基质中添加0.1 mg·kg-1混合标准溶液,除不添加PSA 和GCB 外均按照“1.2.2”处理,考察EMR 对待测农药的回收率的影响。
1.2.2 前处理方法的建立将陈皮样品粉碎后过50目筛,称取2 g 于50 mL 离心管中,加入10 mL 超纯水浸泡30 min,再加入15 mL 1%乙酸-乙腈、6 g 无水硫酸镁、1.5 g 醋酸钠及1 颗陶瓷均质子,4 500 r·min-1离心3 min(离心半径为12.3 cm)。每毫升上述提取液中加入150 mg无水硫酸镁、50 mg PSA及10 mg GCB于15 mL离心管中涡旋振荡,4 500 r·min-1离心3 min(离心半径为12 cm)。移取5 mL 乙腈层至经过5 mL 水活化的EMR萃取管中漩涡混合,4 500 r·min-1离心3 min(离心半径为12 cm)。取2 mL 上清液氮吹至近干,分别加入20 μL 内标溶液和980 μL乙酸乙酯稀释待测。
1.2.3 色谱条件色谱柱:VF-1701MS(30 m×0.25 mm×0.25 μm)。升温程序:初始温度40℃,保持1 min;40 ℃·min-1升至120 ℃,保持0 min;5 ℃·min-1升至300℃,保持3 min。进样口温度:280℃;载气:氦气(纯度≥99.999%);柱流量:1.0 mL·min-1,不分流进样,进样体积1.0 μL。
1.2.4 质谱条件取153 种农药的混合标准溶液经GC-MS/MS SCAN Q3 模式运行,辅以美国国家标准与技术研究院(National Institute of Standards and Technology,NIST)数据库确定目标化合物及其保留时间,选择质量数相对更大、丰度更高的特异性离子为母离子,进行子离子扫描,选择最佳定性、定量离子对和最优碰撞能量。
电离方式:电子轰击电离源;离子源温度:300℃;传输线温度:280℃;离子化能量70 eV;溶剂延迟:3 min;碰撞气为氮气,载气为氦气;数据采集方式:动态多反应监测(dynamic multiple reaction monitoring,dMRM)模式。
1.2.5 基质匹配标准溶液制备及性能指标检测将4组农药标准品用乙酸乙酯稀释成质量浓度为1.0 mg·L-1的153 种农药混合标准溶液。将环氧七氯内标用乙酸乙酯溶解并稀释成质量浓度为5.0 mg·L-1的内标储备液。选取不含目标农药残留的陈皮样品(空白陈皮),按照“1.2.2”步骤处理得空白基质溶液。吸取适量的上述混合标准溶液和内标储备液,配制质量浓度系列为5.0、10.0、50.0、100.0、500 μg·L-1的基质匹配混合标准工作溶液。
取2 g 空白陈皮基质添加农药混合标准溶液后按“1.2.2”方法前处理,以各定量离子信噪比的3 倍计算检出限(limits of detection,LOD),信噪比的10 倍计算定量限(limits of quantification,LOQ)。分别在0.05、0.20、0.80 mg·kg-1三组添加水平下进行6 次平行检测,计算平均回收率和精密度。通过待测物在基质与纯溶剂标准点比值来考察基质效应对实验结果的影响。
1.3 方法应用
为验证方法的实用性,利用所建立的方法对市售12 批次陈皮样品进行农药残留分析。
2 结果
2.1 前处理方法的优化
2.1.1 PSA和GCB用量对农药回收率的影响添加25 mg PSA 时,153 种农药回收率为71.6%~138.5%;添加量为50~100 mg 时,回收率在73.4%~128.7%之间。添加5 mg GCB 时,净化液颜色较深,色素去除率低;添加量为10 mg GCB 时,农药的回收率为70.1%~81.6%;当添加量增加到20 mg GCB 时,农药的回收率为54.6%~64.8%。图1为不同用量GCB 下的六氯苯、嘧霉胺、五氯苯胺、毒壤磷经两次平行测定的回收率结果。因此确定每毫升样品中PSA 和GCB 的添加量为50 mg和10 mg。
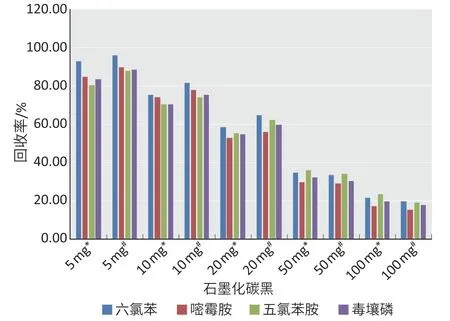
图1 不同量的石墨化碳黑对平面结构农药吸附后的回收率Figure 1 Recovery rates of planar pesticides adsorbed by different amounts of graphitized carbon black
2.1.2 EMR 对净化效果的影响与未经净化直接进样的空白基质溶液(图2A)和经过C18 除脂后的空白基质溶液(图2B)相比,经过EMR 除脂后的空白基质溶液(图2C)在10~23 min 之间基质信号有明显降低,而且杂质峰更少。
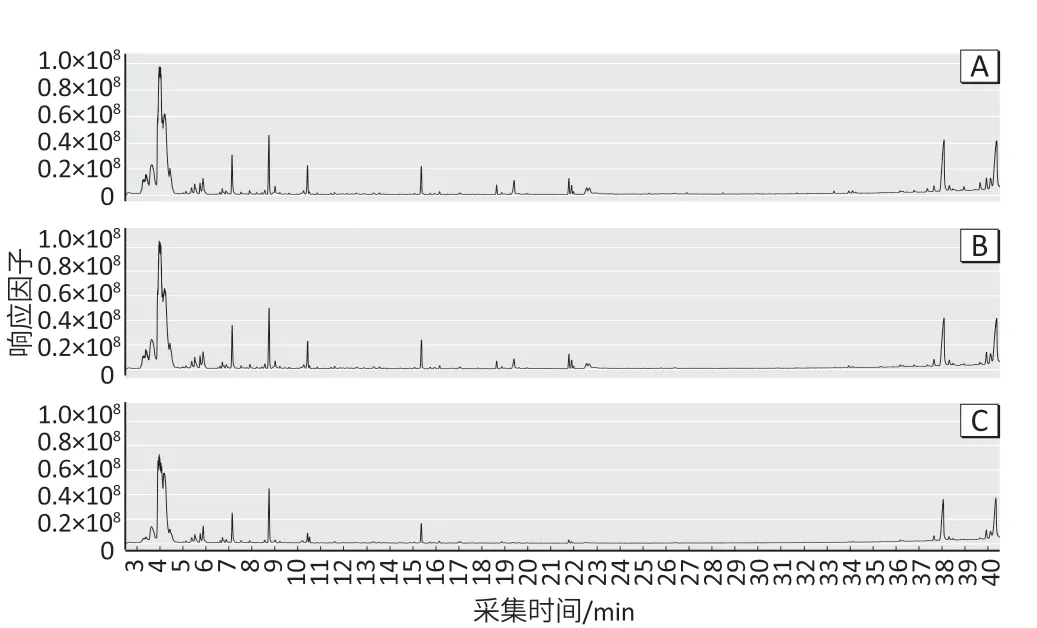
图2 采用不同除脂方法得到的空白基质全扫描色谱图Figure 2 Full scan chromatogram of blank matrix by different degreasing methods
2.1.3 EMR 对待测农药的回收率的影响153 种农药的回收率为70.7%~129.3%。
2.2 色谱条件的优化
两种色谱柱均有较高响应者,其中VF-1701MS 色谱柱对六六六、滴滴涕、菊酯类同分异构化合物分离效果好,而这些物质在HP-5MS 色谱柱上分离度不理想。因此选择VF-1701MS 色谱柱作为本实验的色谱分离柱,优化后的色谱条件同“1.2.3”。
2.3 dMRM方法的建立
根据获得的参数信息建立dMRM 检测方法,优化后的GC-MS/MS 质谱条件见补充材料http://www.jeom.org/article/cn/10.13213/j.cnki.jeom.2021.21035。陈皮中153种农药在GC-MS/MS上的总离子流图见图3。
图3 153种农药在GC-MS/MS上的总离子流图Figure 3 Total ion currents of 153 pesticides on GC-MS/MS
2.4 方法学验证
2.4.1 线性范围和相关系数采用内标法定量,结果显示,153 种农药在0.005~0.50 mg·L-1范围内呈良好的线性关系(r>0.997)。
2.4.2 检出限和定量限当取样量为2.0 g 时,153 种农药的LOD 为0.000 1~0.014 8 mg·kg-1,LOQ 为0.000 3~0.048 9 mg·kg-1。
2.4.3 准确度和精密度153 种农药平均回收率在71.3%~126.9%之间,相对标准偏差范围为1.1%~13.0%(n=6)(见补充材料http://www.jeom.org/article/cn/10.13213/j.cnki.jeom.2021.21035)。本实验方法具有较好的准确度和精密度,满足陈皮中多农残分析的要求。
2.4.4 基质效应(matrix effect,ME)在0.1 mg·kg-1添加水平下,153 种农药中有122 种农药其ME>50%,具有强烈的基质增强效应;12种农药的ME 在20%~50%之间,具有较弱的基质增强效应;17 种农药的ME在-20%~20%之间,属于无基质效应;乙烯菌核利的ME 在-50%~-20%,有较弱的基质抑制效应;氯苯胺灵的ME<-50%,有强烈的基质抑制效应。
2.5 实际样品检测
总批次检出率为50%,6 批次阳性样品中共检出12种农药残留,大部分为杀菌剂;其中抑霉唑的检出率和残留量最高。见表1。
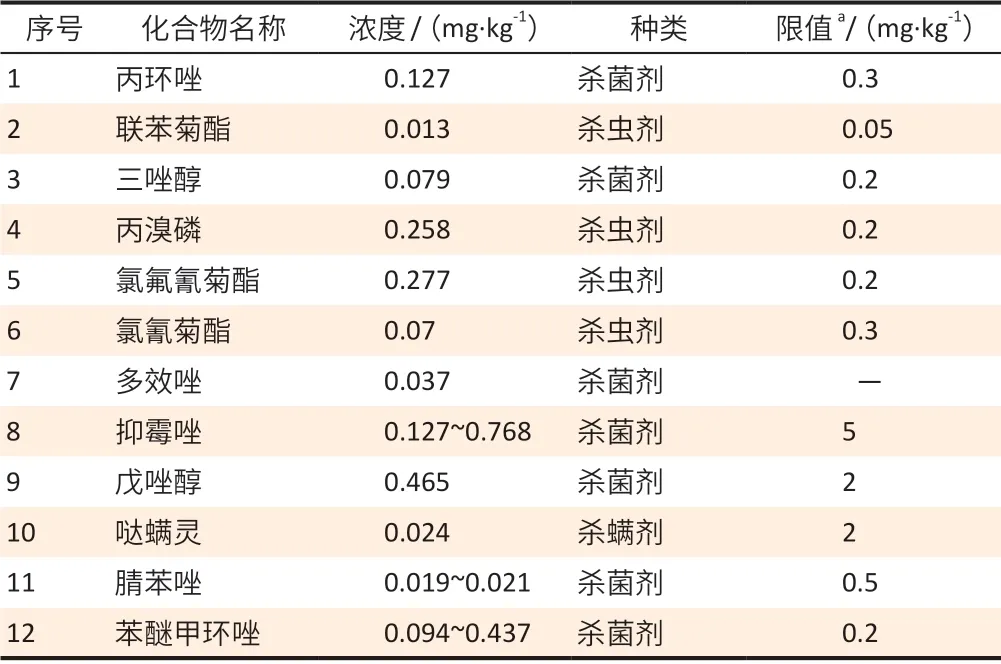
表1 陈皮中农药的检出结果Table 1 Detection of pesticide residues in Pericarpium Citri Reticulatae
3 讨论
由于中药陈皮基质成分复杂,在进行多农药残留检测时,经净化氮吹浓缩后,待测液有明显橘黄色黏稠液滴仍无法吹干,影响结果测定的准确性。为解决这一问题,本研究首次将EMR 加入QuEChERS 前处理方法中并加以优化。通过观察EMR 净化后样品的外观颜色,发现提取液油脂和色素含量少于C18 净化和未经净化的,且色谱杂质峰数量比后两者有所减少。PSA、GCB 都是经典的QuEChERS 吸附剂。PSA 主要作用是去除基质中极性的有机酸。从结果看出,PSA 的添加降低了回收率大于130%的农药数量,说明其对基质增强效应有降低作用;但随着PSA 添加量的增加,回收率没有明显变化。GCB 对色素吸附能力很强,但亦容易吸附具有平面结构的化合物,本实验中六氯苯、嘧霉胺、五氯苯胺、毒壤磷这4 种平面性较强的农药随着GCB 用量增大回收率降低。基于净化效果和农药的回收率两方面考虑,采用QuEChERS EMR-Lipid净化技术是陈皮样品农药残留检测前处理步骤中较优的净化方式。
153 种农药中绝大多数在GC-MS/MS 上呈现出基质增强效应,这类农药具有极性强、热稳定差等特点,如抑霉唑、溴氰菊酯、甲胺磷等。因此采用基质匹配标准溶液进行校正,经校正后可有效消除基质效应带来的影响。此外,定量检测采用在基质匹配标准溶液和样品溶液中同时加入内标物环氧七氯,通过内标法校正待测目标农药,进一步提高检测结果的准确度。
在陈皮样品中检测出较高浓度的杀菌剂,其原因是在柑橘贮藏前会对其进行防腐保鲜,即将采摘后的柑橘浸入防腐保鲜药液中,常用的防腐保鲜药为抑霉唑、苯醚甲环唑、异菌脲等,与此次测定的结果相符。参考GB 2763—2019《食品安全国家标准 食品中农药最大残留限量》中柑橘的限量要求,本次市售陈皮中检出的丙溴磷、氯氟氰菊酯、苯醚甲环唑的残留量高于限值,推测其原因是陈皮干制后水分流失导致其浓度变高。
本研究通过优化净化方法和色谱质谱参数,建立dMRM 模式下GC-MS/MS 检测陈皮中153 种常用农药残留检测的方法,具有复杂基质一次性提取、快速净化、准确定量、高效测定等优点,可为农药残留检测方法的完善提供参考依据,同时也可为基质类似中药的农药残留方法提供借鉴。

