哺乳期双酚A暴露致小鼠睾丸生精细胞减数分裂阻滞的机制研究
黄晓迪,凌远超,赵程,陈建美,张金枝,刘雅楠,解美娜,b
潍坊医学院 a.生命科学与技术学院 b.医学研究实验中心,山东 潍坊 261053
双酚A(bisphenol A,BPA)又称双酚基丙烷,其化学结构与雌激素类似,属于环境内分泌干扰物的一种。BPA是世界上使用最多的工业化学品之一,被广泛用于制造餐具、塑料容器、水管、医疗器具、电子设备、玩具等消费品。BPA进入机体后能够模拟内源性激素的作用,干扰内分泌系统,造成精子数量下降,精子畸形率升高,性功能减退以及不育率增加等各种不良影响[1-2]。由于BPA暴露途径众多,在食物、水、空气、尘埃颗粒、土壤、人体尿液和母乳中均可检测到BPA[3-6],因此BPA对雄性生殖系统健康的影响已不容忽视。
哺乳期是睾丸发育的关键时期,在这一过程中,睾丸原始生精细胞在曲细精管管腔中通过有丝分裂和减数分裂经精原细胞、初级精母细胞、次级精母细胞最终分化为圆形精子细胞[7]。由于哺乳期生殖系统处于发育阶段,且尚未形成血睾屏障,对激素样活性物质尤其敏感[8],因此研究哺乳期BPA 暴露对生殖系统的影响和相关机制具有极为重要的意义。
细胞周期是生命活动中最重要的过程,在精子发生过程中,有丝分裂与减数分裂的准确发生都依赖有序的细胞周期调控。尽管国内外已经有大量研究证实了BPA 的生殖毒性,但鲜有文献报道BPA 对精子发生过程中减数分裂阻滞的机制研究。本研究拟建立哺乳期雄性小鼠体内BPA 染毒模型,在断乳后检测BPA 对小鼠睾丸细胞分化的影响,并通过检测睾丸中细胞周期相关蛋白Cdc25A、Cdc25C、Wee1、p-Tyr15 Cdc2、CDK1 表达量的变化,以及细胞周期相关基因Cdc25A、Cdc25C、Wee1、CDK1mRNA水平的变化情况,以了解BPA对相关周期调控因子转录和翻译的作用,进一步探讨BPA影响睾丸细胞减数分裂周期进程的分子机制。
1 对象与方法
1.1 主要仪器与试剂
超低温冰箱(SANYO,日本),高速冷冻离心机(Heraeus,德国),流式细胞仪(BD,美国),小型垂直电泳转印装置系统(Bio-Rad,美国),化学发光凝胶成像系统(Protein Simple,美国),PCR 仪(Bio-Rad,美国),凝胶成像分析系统(UVP,美国)。
双酚A、玉米油(Sigma-Aldrich,美国),DNA 含量检测试剂盒(BD,美国),RIPA 裂解液(强)(北京康为世纪,中国),Na3VO4、NaF(上海生工,中国),抗Cdc25A 一抗、抗Cdc25C 一抗、抗Wee1 一抗、抗p-Tyr15 Cdc2 一抗、抗CDK1 一抗(Santa Cruz,美国),抗β-actin 一抗、山羊抗小鼠辣根过氧化物酶二抗(北京中杉金桥,中国),化学发光试剂盒(上海碧云天,中国),Trizol 试剂(上海生工,中国),RNA 逆转录试剂盒、PCR 扩增试剂盒(北京康为世纪,中国)。
1.2 实验动物分组与染毒
健康的ICR 妊娠母鼠12 只,购自济南朋悦实验动物繁育有限公司,许可证号SCXK(鲁)20190003。实验期间饲养环境温度控制在(24±2)℃,相对湿度40%~50%,自由进食繁殖期饲料,饮清洁水。在母鼠分娩后按照随机原则将新生小鼠分为3组,对照组(玉米油)、BPA 低剂量组(0.1 mg·kg-1,相当于环境相关暴露剂量)和BPA 高剂量组(5 mg·kg-1,未观察到动物明显不良反应的最低剂量),每组10 只。以玉米油为溶剂配制BPA 溶液,对照组给予玉米油。由于新生期小鼠口服给药困难,且有研究发现,与BPA 结合的酶(UDP-葡萄糖醛糖基转移酶)在新生儿中的表达水平很低,口服和非口服给药的药代动力学没有差异[9]。因此,本研究选择皮下注射途径染毒。从小鼠出生后第1 天(postnatal day 1,PND1)起每日对雄性仔鼠颈背部皮下注射药物(4 μL·g-1)直至PND21 断奶,染毒周期20 d。在PND22 颈椎脱臼处死小鼠,称取体重,剥取睾丸组织并对睾丸组织进行称重,流式细胞仪检测睾丸生精细胞DNA 含量。用于RT-PCR 和Western blotting 检测的睾丸样本冻存于-150℃超低温冰箱。本研究已获潍坊医学院医学伦理委员会审查通过[潍医伦研2017第(016)号]。
1.3 检测指标及方法
1.3.1 睾丸组织系数的计算计算睾丸组织系数,计算公式为:睾丸系数=睾丸重量(湿重)/体重×100%。
1.3.2 睾丸生精细胞DNA含量的测定剥离睾丸白膜后加入胶原酶和DNAase 消化,300×g离心5 min 收集细胞,预冷的PBS 清洗两次。将细胞以1.0×106个·mL-1密度重新悬浮至1 mL 缓冲溶液中。吸取500 μL 细胞悬液,每样品加入250 μL 胰蛋白酶缓冲液,轻拍混匀,室温反应10 min 后加入200 μL 胰蛋白酶抑制剂,室温反应10 min,加入冷的碘化丙啶200 μL,4℃避光孵育10 min后,流式细胞仪进行DNA倍体分析,ModFit LT 3.1软件分析睾丸细胞分群情况。
1.3.3 睾丸内细胞周期相关蛋白相对表达量的测定取冻存睾丸加入裂解液(含100×蛋白磷酸酶抑制剂、100×PMSF、100×蛋白酶抑制剂混合液),冰上裂解提取蛋白。聚丙烯酰胺凝胶电泳,转膜后将PVDF膜置于5%的脱脂奶粉(100 mmol·L-1Na3VO4、200 mmol·L-1NaF)中4℃封闭1 h,加入一抗Cdc25A(1∶500)、Cdc25C(1∶500)、Wee1(1∶1 000)、p-Tyr15 Cdc2(1∶300)、CDK1(1∶1 000)、内参蛋白β-actin(1∶1 000)4℃孵育 过 夜。用TBST(含100 mmol·L-1Na3VO4、200 mmol·L-1NaF)漂洗3 次,二抗(1∶5 000)室温孵育1 h,TBST(含100 mmol·L-1Na3VO4、200 mmol·L-1NaF)洗膜,滴加ECL化学发光液,化学发光凝胶成像系统采集图像。采用Image J 1.8.0软件对结果进行分析。
1.3.4 睾丸内细胞周期相关基因mRNA 相对表达量的测定取冻存的小鼠睾丸组织,根据Trizol 试剂盒说明提取总RNA,超微量紫外分光光度计测定提取的总RNA的纯度与浓度。按照HiFiScript cDNA合成试剂盒说明书将提取的总RNA反转录成cDNA,用ddH2O代替逆转录酶作为阴性对照。RT-PCR扩增检测mRNA水平。利用 Primer 5.0软件设计引物序列,见表1,委托Sangon Biotech(上海)有限公司合成。PCR扩增体系为:1 μL cDNA,12.5 μL 2×Taq Mix,10 μL ddH2O,正向、反向引物各0.75 μL。Cdc25A、Cdc25C、Wee1、CDK1、β-actin的退火温度分别为57、59、60、55、56℃。扩增产物进行琼脂糖凝胶电泳,凝胶成像分析系统拍照并进行灰度值分析。

表1 引物序列Table 1 Primer sequence
1.4 统计学分析
每组实验独立重复3 次或以上,所有实验数据采用SPSS 25.0软件进行统计学分析,数据均以±s表示,多组间比较时采用单因素方差分析,染毒组与对照组比较采用LSD-t检验。检验水准α=0.05。
2 结果
2.1 小鼠体重和睾丸系数的比较
BPA 给药过程中小鼠生存状态良好,饮食和活动情况无明显变化,均存活至实验结束。与对照组相比,BPA 低、高剂量组小鼠体重、睾丸重量、睾丸系数差异均无统计学意义(均P>0.05,表2)。
表2 BPA对小鼠体重、睾丸重量、睾丸系数的影响(±s,n=10)Table 2 Effects of BPA on body weight,testicular weight,and testicular coefficient of mice (±s,n=10)

表2 BPA对小鼠体重、睾丸重量、睾丸系数的影响(±s,n=10)Table 2 Effects of BPA on body weight,testicular weight,and testicular coefficient of mice (±s,n=10)
剂量组/(mg·kg-1) 体重/g 左睾重/mg 右睾重/mg 睾丸系数/%0 16.26±2.73 39.70±6.07 41.40±6.15 0.50±0.06 0.1 15.54±1.37 41.50±5.93 44.30±5.58 0.55±0.08 5.0 15.27±1.94 41.70±9.55 42.80±8.77 0.55±0.08 F 0.59 0.45 0.43 1.45 P 0.559 0.511 0.653 0.252
2.2 睾丸生精细胞DNA含量的变化
由表3可见,与对照组相比,BPA 处理组睾丸内生精细胞百分比发生了明显变化,低、高剂量组二倍体细胞(精原细胞、次级精母细胞和支持细胞)占比明显减少,四倍体细胞(初级精母细胞、G2/M 期的精原细胞)占比明显增多,差异均具有统计学意义(均P<0.01)。而低、高剂量组中单倍体细胞和S 期细胞占比与对照组相比,差异无统计学意义(均P>0.05)。
表3 BPA对小鼠睾丸生精细胞DNA 含量的影响(±s,n=4)Table 3 Effects of BPA on DNA content of spermatogenic cells in mice testis (±s,n=4) 单位(Unit):%
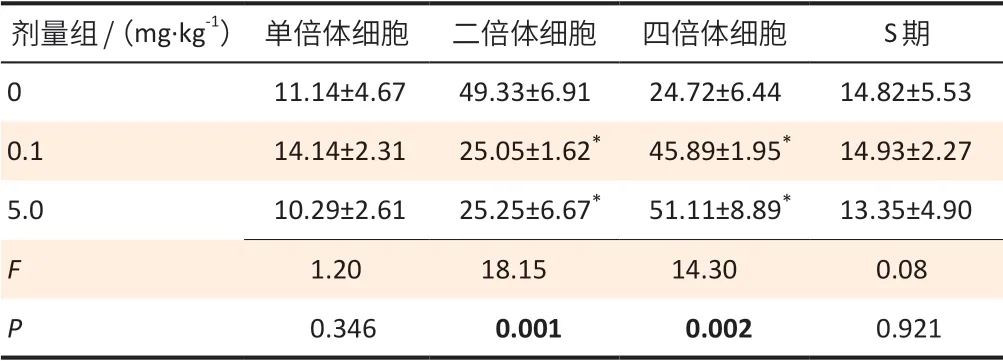
表3 BPA对小鼠睾丸生精细胞DNA 含量的影响(±s,n=4)Table 3 Effects of BPA on DNA content of spermatogenic cells in mice testis (±s,n=4) 单位(Unit):%
[注]*:与对照组相比,P<0.01。
剂量组/(mg·kg-1) 单倍体细胞 二倍体细胞 四倍体细胞 S期0 11.14±4.67 49.33±6.91 24.72±6.44 14.82±5.53 0.1 14.14±2.31 25.05±1.62* 45.89±1.95* 14.93±2.27 5.0 10.29±2.61 25.25±6.67* 51.11±8.89* 13.35±4.90 F 1.20 18.15 14.30 0.08 P 0.346 0.001 0.002 0.921
2.3 睾丸组织细胞周期相关蛋白表达的变化
图1A 为免疫印迹蛋白电泳图。Western blotting检测结果显示:与对照组相比,Cdc25A、Cdc25C、Wee1、p-Tyr15 Cdc2 蛋白表达水平在低、高剂量组中均降低(P<0.05 或P<0.01),CDK1 表达水平无明显改变(均P>0.05)(图1B)。
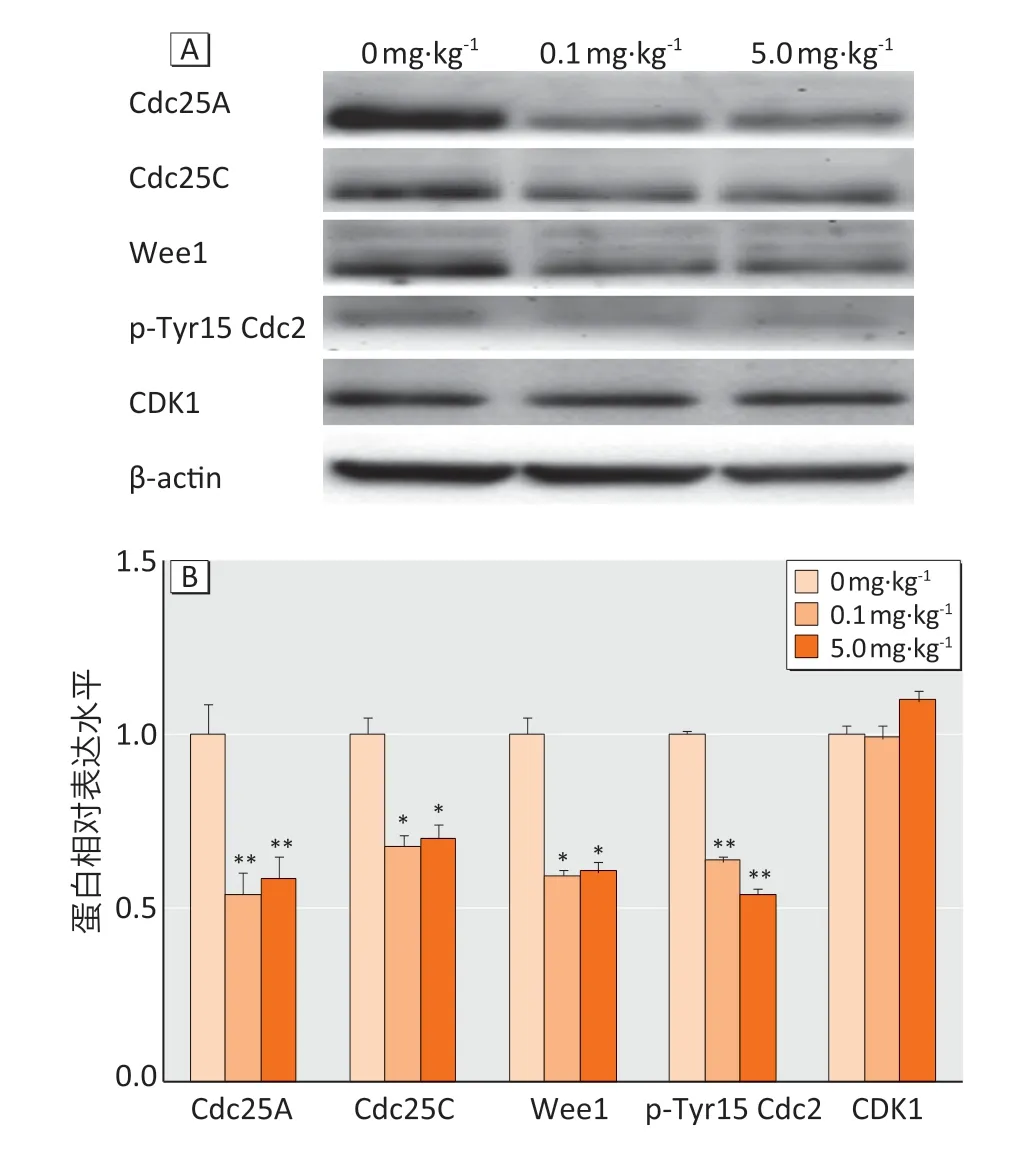
图1 BPA对哺乳期小鼠睾丸内Cdc25A、Cdc25C、Wee1、p-Tyr15 Cdc2、CDK1蛋白相对表达水平的影响(n=10)Figure 1 Effects of BPA on protein relative expression levels of Cdc25A,Cdc25C,Wee1,p-Tyr15 Cdc2,and CDK1 in the testis of lactational mice (n=10)
2.4 睾丸组织细胞周期相关基因mRNA水平的变化
由图2可见,在BPA 低剂量、高剂量组中Cdc25A、Cdc25C、Wee1、CDK1mRNA的表达水平与对照组相比较,差异均无统计学意义(均P>0.05)。

图2 BPA 对哺乳期小鼠睾丸内Cdc25A、Cdc25C、Wee1、CDK1 mRNA 相对表达水平的影响(n=10)Figure 2 Effects of BPA on mRNA relative expression levels of Cdc25A,Cdc25C,Wee1,and CDK1 in the testis of lactational mice(n=10)
3 讨论
在小鼠出生后第1-21 天,睾丸精原细胞完成分化转变为初级精母细胞,初级精母细胞完成减数分裂形成圆形精子细胞,是研究外源生殖毒性物质对减数分裂进程影响的最佳阶段。因此本研究选择小鼠出生后第1-21 天染毒BPA,探讨BPA 对小鼠精子发生过程中减数分裂的影响。研究发现,BPA 暴露导致小鼠睾丸生精细胞中四倍体细胞比例增加,二倍体细胞比例减少。小鼠睾丸中四倍体细胞主要包括处于细线期、偶线期、粗线期和双线期中的初级精母细胞和G2/M 期的精原细胞,二倍体细胞主要包括次级精母细胞、精原细胞和支持细胞[9-10]。22日龄小鼠睾丸中初级精母细胞比例增大,精原细胞比例减小[7],且细胞G2/M 期转换持续时间较短,这说明,BPA 暴露导致小鼠睾丸中生精细胞减数分裂阻滞在初级精母细胞阶段,进入减数分裂下一阶段的初级精母细胞量减少,减数分裂进程发生紊乱。这与Ali 等[11]发现的BPA 导致大鼠睾丸曲细精管部分精母细胞减数分裂阻滞的结果一致。BPA 将生精细胞减数分裂阻滞在初级精母细胞阶段,必然会干扰精子发生。已经有不少研究证实BPA 暴露会影响精子发生,降低精子数量和精子质量[12-13]。
本课题组前期研究发现,BPA 暴露于小鼠出生后第1-21 天会导致在精母细胞内特异表达的Boule 蛋白下调[14]。Boule基因可以通过调节Cdc25A 的翻译水平来活化成熟促进因子(mature promoting factor,MPF),即CDK1/CyclinB 复合物,启动减数分裂G2 期向M 期的转换[15]。因此,本研究检测了BPA是否影响细胞周期调控相关因子的转录和翻译水平,发现BPA引起睾丸内Cdc25A、Cdc25C、Wee1、p-Tyr15 Cdc2 蛋白表达下调,未影响CDK1 蛋白的表达。Cdc25A 与Cdc25C 同属于Cdc25 家族,在细胞周期调控中能够对MPF 的催化亚基CDK1(即Cdc2)的Tyr15 位点去磷酸化,进而激活CDK1/CyclinB 复合物[16]。Cdc25A 与Cdc25C 可以促进细胞G1/S、G2/M 检验点之间的转变,有研究表明Cdc25C 蛋白表达缺失会导致前列腺癌细胞G2/M 期比例增多[17]。Wee1 蛋白在细胞周期调控中发挥检查点作用,主要功能是磷酸化MPF 的催化亚基CDK1 Tyr15位点,避免CDK1/Cyclin B复合物过度激活。研究发现,使用Wee1 抑制剂能够抑制CDK1在Tyr15 处的磷酸化,进而诱导细胞凋亡[18]。因此推测,BPA 暴露导致小鼠睾丸生精细胞减数分裂被阻滞在初级精母细胞阶段与Cdc25A、Cdc25C、Wee1 翻译水平的下调有关。由于Cdc25A、Cdc25C、Wee1 蛋白表达水平下调,导致CDK1 未被及时磷酸化因而磷酸化蛋白(p-Tyr15 Cdc2)水平降低。通过进一步检测BPA 是否影响Cdc25A、Cdc25C、Wee1以及CDK1的转录水平,发现BPA 未影响以上周期调控因子的转录,这说明BPA 主要影响睾丸内Cdc25A、Cdc25C、Wee1的转录后翻译。
综上所述,哺乳期接触BPA 能够干扰小鼠睾丸内生精细胞的分化,BPA 可能通过下调睾丸生精细胞Cdc25A、Cdc25C、Wee1 蛋白表达,影响CDK1 的磷酸化,导致精母细胞减数分裂阻滞,干扰生精细胞分化进程。但在BPA下调Cdc25A、Cdc25C、Wee1蛋白表达的过程中,相关蛋白如何发挥作用影响减数分裂,干扰生精细胞分化,需要继续深入探讨。

