骨髓细胞形态学、M蛋白定量及免疫固定电泳在MM患者诊断中的应用
崇翔 曾慧 万晓婷
多发性骨髓瘤(multiple myeloma,MM)是恶性克隆性浆细胞疾病,以原发性恶性浆细胞在骨髓中无节制增殖并伴单克隆免疫球蛋白生成为特征[1]。虽然MM 临床发病率并不高,为全身恶性肿瘤的1%,但随着我国人口老龄化的发展,逐年增加的发病率已经对我国人口健康构成威胁,因此,加强对MM 的诊断、治疗和预后研究也迫在眉睫。受限于非血液科医师对该病认识缺乏,极易导致本病的漏诊、误诊[2-3],尤其是MM 伴随的骨痛、蛋白尿、肾功能损害会被误诊为骨质增生、骨折、肾功能不全等疾病,而患者伴随明显症状但不能得到及时、妥当的治疗,病情快速发展至骨髓坏死、尿毒症等阶段,从而失去了最佳治疗时机。可见,提高诊断对于改善MM 治疗效果具有积极作用。骨髓细胞形态学、血清蛋白电泳及免疫学方法是诊断MM 及识别MM 分型的重要手段。本文将MM 患者作为研究对象,分析骨髓细胞形态学、血清蛋白及免疫固定电泳在MM 诊断中的应用,以期帮助临床医师提高对MM 的诊断效果。
1 资料与方法
1.1 一般资料
选取2017年1月至2020年12月本院收治的120 例MM 患者作为研究对象。患者男73 例、女47 例,平均年龄(63.25±5.31)岁。另择同期体检正常的30 例健康人作为对照组,男17 例、女13 例,平均年龄(64.08±5.19)岁。所有患者均知情同意,且经医院伦理委员会同意批准。
纳入标椎:①年龄>45 岁;②均符合《中国多发性骨髓瘤诊治指南》[4]中相关诊断标椎;③临床资料完整;④检查前,未接受化疗、手术切除、局部放射等治疗。排除标椎:①合并其他恶性肿瘤;②合并严重心、肺、肝等重大脏器官障碍者;③合并其他红细胞疾病、白细胞系统疾病、出血性疾病及免疫系统疾病;④精神疾病患者;⑤妊娠期或哺乳期女性。
1.2 方法
1.2.1 细胞形态学
所有患者知情同意的前提下,行骨髓穿刺术,获取骨髓液,并加肝素钠抗凝制取标本,获取骨髓液标本后于6 h 内检测:取一份标本自然干燥,加瑞士吉姆萨染60 s 后,加磷酸盐缓冲液并用洗耳球吹匀以充分混合,15 min 后,流动水冲洗、晾干、上显微镜观察;于低倍镜下观察骨髓增生程度;于高倍镜(或油镜)下观察骨髓浆细胞(数量、分布、形态特征),并计算成熟浆细胞、原始浆细胞、幼稚浆细胞百分比,并分型。
1.2.2 免疫固定电泳
所有受试者均抽取空腹肘静脉血,离心制取血清标本。取患者血清标本,生理盐水稀释,上样品盘,放入全自动电泳仪中做点样、电泳等步骤,之后将胶片放入扫描仪扫描,自动计算结果并上传系统。
1.2.3 免疫球蛋白
取所有受试者血清标本,上BICS 免疫化学分析仪(Beckman 公司,美国)以速率散射比浊法检测免疫球蛋白(IgA、IgM、IgG)水平。
1.3 观察指标
①免疫固定电泳及M 蛋白。所有MM 患者以异常增多的免疫球蛋白类型分为IgA 型、IgD型、IgG 型、轻链型,并根据轻链类型分为κ、λ 亚型。且分析不同受试者血清免疫球蛋白水平。②骨髓细胞形态学。细胞形态学主要观察增生程度及骨髓瘤类型:增生程度依据五级分类法[5]分为Ⅰ~Ⅴ级:Ⅰ级:增生极度活跃,成熟红细胞/有核细胞比例1∶1,且有核细胞>600 LP;Ⅱ级:增生明显活跃,成熟红细胞/有核细胞比例10∶1,且有核细胞200~600 LP;Ⅲ级:增生活跃,成熟红细胞/有核细胞比例20∶1,有核细胞20~200 LP;Ⅳ级:增生减低,成熟红细胞/有核细胞比例50∶1,有核细胞10~20 LP;Ⅴ级:增生极度减低,成熟红细胞/有核细胞300∶1,有核细胞10 LP 以下。骨髓瘤类型包括原始浆细胞、幼稚浆细胞及成熟浆细胞。
1.4 统计学处理
采用统计软件SPSS 22.0 处理数据,计数资料用n(%)表示,行χ2检验;符合正态分布的计量资料用()表示,多组分析采用单因素方差分析、组间两两比较采用多重比较:以P<0.05 为差异有统计学意义。
2 结果
2.1 免疫固定电泳及M 蛋白检测结果
120 例患者血清蛋白电泳结果显示,85 例患者血清蛋白电泳图谱中出现了M 蛋白,表达率70.83%(85/120)。四组不同免疫表型在亚型κ、λ均有检出,但κ、λ 亚型检出率比较差异无统计学意义(P>0.05)。见表1。

表1 MM 患者免疫表型比较[n(%)]Table 1 Comparison of immunophenotypes in MM patients[n(%)]
MM 不同免疫表型患者及对照组血清免疫球蛋白水平分析结果显示,血清IgA、IgM 及IgG 水平差异显著,差异有统计学意义(P<0.05)。MM 各亚组患者血清IgM 均显著低于对照组,差异有统计学意义(P<0.05),血清IgA 水平以IgA 型>IgD 型>IgG 型>轻链型(P<0.05),血清IgM 水平以IgA型、IgD 型>IgG 型>轻链型(P<0.05),血清IgG 水平以IgG 型>IgD 型>IgA 型>轻链型,差异有统计学意义(P<0.05)。见表2。
表2 受试者血清免疫球蛋白水平比较(±s,g/L)Table 2 Comparison of serum immunoglobulin levels of subjects(±s,g/L)
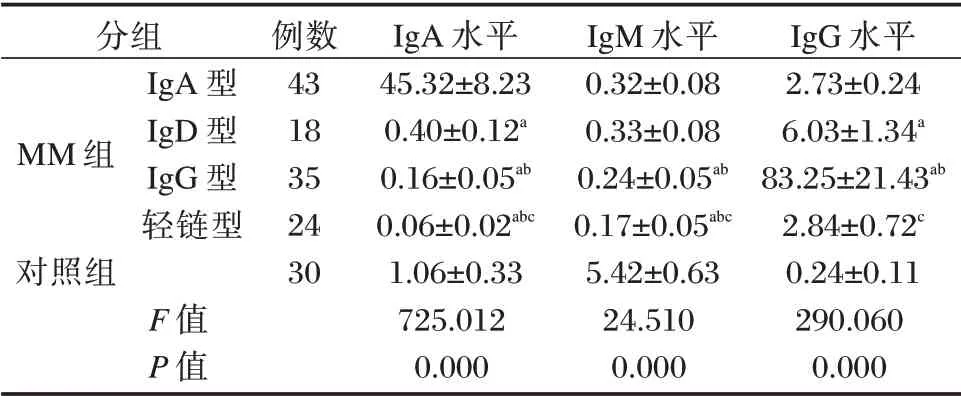
表2 受试者血清免疫球蛋白水平比较(±s,g/L)Table 2 Comparison of serum immunoglobulin levels of subjects(±s,g/L)
注:a与IgA 型组比较,b与IgD 型组比较,c与IgG 型组比较,均P<0.05。
分组MM 组IgA 型IgD 型IgG 型轻链型对照组例数43 18 35 24 30 F 值P 值IgA 水平45.32±8.23 0.40±0.12a 0.16±0.05ab 0.06±0.02abc 1.06±0.33 725.012 0.000 IgM 水平0.32±0.08 0.33±0.08 0.24±0.05ab 0.17±0.05abc 5.42±0.63 24.510 0.000 IgG 水平2.73±0.24 6.03±1.34a 83.25±21.43ab 2.84±0.72c 0.24±0.11 290.060 0.000
2.2 骨髓细胞形态学
四组MM 患者骨髓细胞增生程度分级比较,差异有统计学意义(P<0.05),增生程度Ⅰ级占比以IgG 型>IgA 型>IgD 型>轻链型,差异有统计学意义(P<0.05),增生程度Ⅱ级占比以IgD 型、轻链型>IgA 型>IgG 型,差异有统计学意义(P<0.05),增生程度Ⅲ级则以轻链型>IgA 型、IgD 型>IgG 型,差异有统计学意义(P<0.05)。四组MM 患者原始浆细胞、幼稚浆细胞占比以轻链型、IgD 型>IgG 型>IgA 型,差异有统计学意义(P<0.05)。见表3。
表3 MM 不同免疫表型骨髓形态学比较[n(%),(±s)]Table 3 Comparison of bone marrow morphology with different immunophenotypes in MM[n(%),(±s)]

表3 MM 不同免疫表型骨髓形态学比较[n(%),(±s)]Table 3 Comparison of bone marrow morphology with different immunophenotypes in MM[n(%),(±s)]
注:增生程度:a示与IgA 型组比较,b示与IgD 型组比较,c示与IgG 型组比较,均P<0.05。
分组IgA 型IgD 型IgG 型轻链型χ2/F 值P 值n 浆细胞占比43 18 35 24增生程度Ⅰ级25(58.14)6(33.33)29(82.86)ab 0(0)abc 46.903 0.000Ⅱ级12(27.91)10(55.56)a 6(17.14)ab 12(50.00)acⅢ级6(13.95)2(11.11)0(0)ab 12(50.00)abcⅣ级0(0)0(0)0(0)0(0)Ⅴ级0(0)0(0)0(0)0(0)原始浆细胞14.75±3.25 31.07±6.39a 19.93±3.87ab 32.66±6.42ac 98.464<0.001幼稚浆细胞15.87±4.1 32.79±6.65a 20.14±4.11ab 31.16±6.72ac 72.850<0.001成熟浆细胞11.35±2.10 12.06±2.18 10.24±2.21 11.92±2.15 0.879 0.460
3 讨论
MM 是一种B 淋巴细胞介导的浆细胞恶性增殖性疾病,以中老年人群为高发群体,其生存期数月到数十年不等[6-7]。当前认为,MM 细胞可通过自分泌方式促进恶性增殖,也可通过旁分泌方式作用于骨髓机制细胞,两者相互作用并引起骨髓微环境的变化而利于MM 细胞的生长,同时,MM细胞又会引起溶骨性病变、肾功能损害、贫血等症状。据统计[8],70%~80%MM 患者存在不同程度的骨质破坏,其可能是MM 细胞刺激会导致核NF-JB受体激活因子和骨保护素之间失衡[9],导致破骨持续活化而产生进行性骨质破坏,并引发病理性骨折、骨痛等骨病。MM 细胞侵袭骨髓而抑制促红细胞生成素的生成、骨髓中炎性因子的作用、自身免疫性溶血性贫血等又会引发贫血。此外,M 蛋白在肾小球沉积、过量游离轻链毒性/自聚集/等电点引发近端肾小管复合性功能缺陷疾病,溶骨性病变所引发的高钙血症也会引起钙沉积而损伤肾功能[10]。另有研究显示[11],不同分子免疫表型的MM 患者生存时间有所差异,并以IgD 型生存时间相对较短。可见,分析免疫表型对于指导MM 患者的治疗及预后干预方案具有重要意义。
对于MM 患者而言,由于单克隆恶性浆细胞合成的κ(或λ)过量而λ(或κ)抑制时,导致κ、λ明显差异,且已有诸多研究表明[12-13],κ、λ 与MM早期进展相关,依据κ、λ 可预测自体干细胞移植效果。准确了解骨髓瘤瘤细胞负荷、增生程度、各类浆细胞情况非常重要。本组案例结果与既往研究一致[14]。因此,单纯依靠骨髓瘤细胞诊断MM效果不佳。结合三种检查手段的优势与不足,且考虑免疫表型与瘤细胞多种抗原表达的特异性相关、骨髓细胞形态学观察的增生程度、浆细胞占比等又是评估预后的重要因素之一,临床医师应当综合考虑骨髓细胞形态学、M 蛋白及免疫固定电泳结果制定治疗手段。
本研究仅选择较常见的四种分型纳入分析,对于其他免疫表型免疫固定电泳亚型及骨髓细胞形态学又是如何,有待于后续更为细致的研究;除免疫表型外,Durie-Salmon(DS)分期标准也是临床常用分型,本研究未分析免疫表型与DS 分期之间是否存在相关性;此外研究其获取资料有限,未能分析不同分型患者临床特征以及预后差异,且部分患者因移植后反应性改变、治疗导致易感基因的表达、原克隆通路受抑制等导致的Ig 类型转变,其细胞形态学又如何变化,都需要后续工作者的探究。总体而言,本研究结果显示免疫固定电泳检测不同免疫表型的MM 患者血清IgA、IgM 及IgG 等水平具显著差异,且骨髓细胞形态学观察的增生程度及原始浆细胞、幼稚浆细胞占比也有差异。

