WEE2基因纯合突变Lys195Asn导致受精失败和女性不孕的家系分析
刘顿 陈创奇 苏念军 何天文 燕瑾 刘风华★ 张曦倩★
成功受精是人类生育的重要前提,而正常受精的基础是获能后的单倍体精子与成熟的单倍体卵子相互融合[1]。在辅助生殖(Assisted reproduction,ATR)治疗中,成熟卵子经体外受精(In vitro fertilization,IVF)或卵胞浆内单精子显微注射(Intracytoplasmicsperminjection,ICSI)后实现精卵融合,体外受精率通常可达70%~80%[2],然而仍有1%~3%的ICSI 周期出现低受精率(≤25%)或完全受精失败[3-4]。导致ICSI 周期低受精率或完全受精失败的因素比较复杂,如卵子细胞核与细胞质成熟不同步,纺锤体异常或者是缺乏卵子激活过程中的一些关键酶等[5]。近年来,随着基因检测技术的发展与普及,一些由遗传致病基因突变导致的受精障碍案例逐渐被报道,例如男性中PLCZ1基因突变导致卵母细胞激活失败[6-8],女性中WEE2基因突变导致卵子授精后无法形成原核等[9-11]。WEE2基因(WEE1同源体,也称为WEE1B)属于母源基因,仅在卵巢的卵母细胞中高表达。在小鼠GV 期卵子中降调Wee2基因表达后,小鼠卵母细胞能够完成减速第一次分裂后排出极体,由MI 卵子发育至PB1 卵子,但通过IVF受精后,卵子不能形成原核,表现为受精障碍[12]。由此可见WEE2基因在卵母细胞受精过程中发挥至关重要的作用。本研究中应用全外显子组测序技术对一受精失败家系进行了遗传学病因的鉴定,发现该案例中女性WEE2基因纯合错义突变是导致其反复ART 失败的原因,并通过家系研究进一步阐明了WEE2基因型与表型的关系。
1 材料与方法
1.1 患者资料
夫妇2017年7月首次就诊于本院生殖医学中心时女方27 岁,男方26 岁。女方双侧输卵管通畅,其余妇科检查基本正常。男方精液检查参数基本正常(密度:54.2×106/mL,前向运动比率:66.4%,活率:72.5%,正常形态率:4.8%)。临床诊断为不明原因的原发不孕症,不孕年限为3年。患者夫妇通过ART 治疗反复失败,主要表现为不孕和受精障碍。本研究通过了广东省妇幼保健院医学伦理委员会审查批准,同时征得了患者及其家人遗传基因分析的知情同意。
1.2 控制性促排卵方案和体外受精
根据患者年龄、体重、激素水平及卵巢储备情况选择相应的经典促排卵方案。取卵、精液处理、体外授精、人工卵母细胞激活(Intracytoplasmicsperminjection,AOA)和胚胎培养技术均采用标准方法[13]。
1.3 遗传基因分析
采集夫妇双方及女方父母和哥哥的外周血,采用传统的酚氯仿方法提取基因组DNA 用于遗传分析。首先,根据标准实验方法对夫妇双方进行全外显子组测序(Whole Exome Sequencing,WES):基因组DNA 经片段化、末端修复、3'端加A 尾、连接测序接头、PCR 扩增,使用杂交捕获方法制备DNA 文库,然后使用Illumina NovaSeq 高通量测序平台进行全外显子组的测序。随后,对下机数据进行后续的生物信息学分析,包括将原始的FASTQ 格式文件与人类基因组hg19(GRCh37)参考序列进行比对;对短序列变异的检出、过滤和注释;分别应用PolyPhen-2(http://genetics.bwh.harvard.edu/pph2/)和Mutation Taster(http://www.mutationtaster.org)蛋白质预测软件对变异的有害性进行预测;利用人类外显子组数据库ExAC(http://exac.broadinstitute.org/)和基因组变异频率数据库gnmoAD(http://gnomad.broadinstitute.org/)查找突变位点频率,用人类基因突变数据库HGMD(http://www.hgmd.cf.ac.uk/ac/)查询突变是否被收录;应用Clustal Omega 软件通过比对不同物种蛋白序列,分析变异位点在不同物种之间的保守性。最后,对潜在的致病基因突变进行Sanger 测序验证以及进一步的家系验证和表型分析。
2 结果
2.1 临床结果
不孕症夫妇双方通过ART 助孕过程和结果总结如下:3 个周期B 超监测排卵指导同房后未妊娠;两人工授精(Artificial insemination of husband's sperm,AIH)周期未妊娠;1 个IVF 周期低受精率,无可移植胚胎;1 个ICSI 周期完全受精失败;1 个ICSI-AOA 周期完全受精失败。体外授精的具体临床实验结果见表1。在ICSI-AOA 治疗周期中,1 个卵子授精后出现了第二极体,但无法形成原核和进一步卵裂(见图1)。
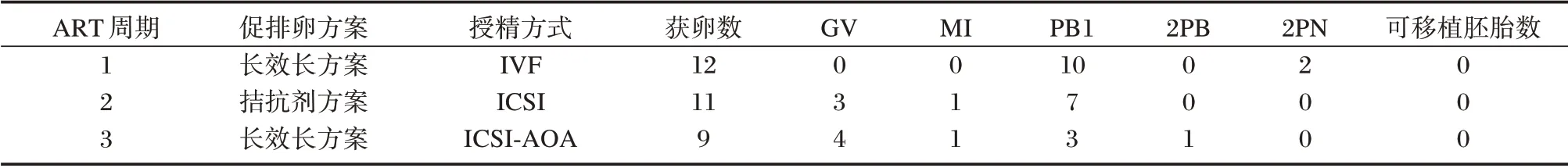
表1 患者ART 治疗中的临床表型Table 1 Clinical genotypes of the affected couple
2.2 全外显子组基因测序、Sanger 测序验证和家系分析
男方全外显子组基因测序未找到与受精障碍相关致病基因变异。女方测序发现一个与受精障碍高度相关的基因变异WEE2(NM_001105558):c.G585C(p.K195N)纯合错义突变(图1)。蛋白预测软件PolyPhen-2 和MutationTaster 的算法预测均提示该变异为有害突变。通过对先证者家系分析和Sanger 测序验证发现该患者WEE2纯合突变分别遗传至患者无症状的父亲(I-1)和母亲(I-2),先证者的哥哥(Ⅱ-2)与先证者一样发生了WEE2基因突变纯合突变。氨基酸保守性分析表明,WEE2 蛋白第195位氨基酸Lys 在不同物种间高度保守。见图2。
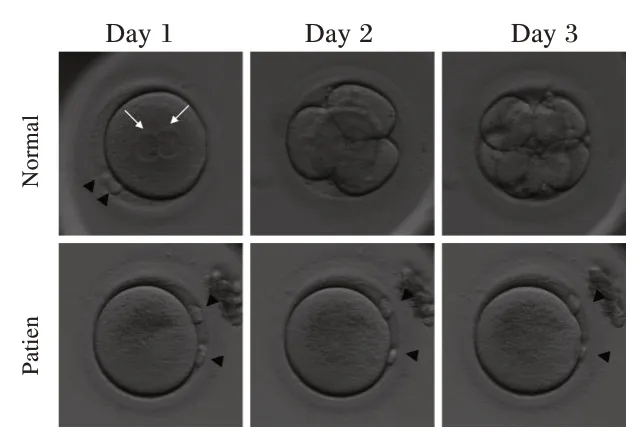
图1 授精后观察正常合子和患者卵子的形态学变化Figure 1 Morphology of a normal zygote and a affected individual oocyte after ICSI-AOA
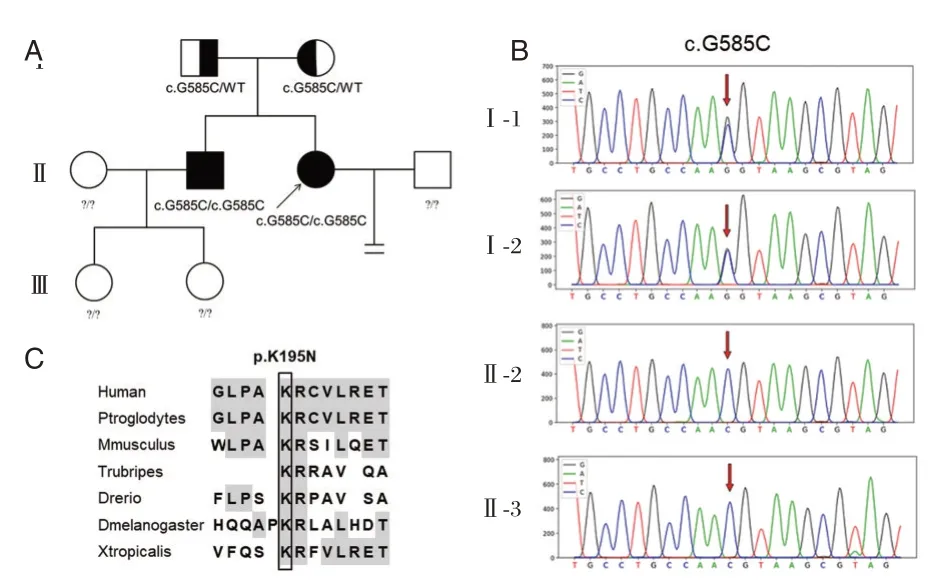
图2 先证者家系Sanger 测序结果和WEE2 蛋白(p.K195N)不同物种氨基酸序列Figure 2 Sanger sequencing results of proband family and WEE2(p.K195N)amino acid sequence of different species
3 讨论
人类正常受精过程需要经历一系列的生化过程,包括精子获能,顶体反应,精卵结合,精卵质膜融合,卵子激活,完成第二次减速分裂,雌、雄原核形成和融合[1,14]。ART 周期中完全受精失败并不十分常见,仅有1%~3%的ICSI 周期出现低受精率(≤25%)或完全受精失败[3-4]。由于伦理和研究技术的限制,目前ICSI 完全受精失败的分子机制并不完全清楚,且难于改善和治疗。遗传学因素导致的受精失败中,由于男性PLCZ1基因突变或圆头精子症导致卵母细胞激活失败,可以通过ICSIAOA 技术进行治疗改善[6-8],而女性的遗传学因素导致的受精障碍,临床上尚无良好的补救措施。
本研究通过WES 技术鉴定了WEE2(NM_001105558):c.G585C(p.K195N)纯合错义突变导致ART 周期中受精失败和女性不孕的家系。Poly-Phen-2 和MutationTaster 软件的算法预测该突变为有害变异,且通过检索人类外显子组数据库ExAC和基因组变异频率数据库gnmoAD 发现该变异频率为0,目前人类基因突变数据库HGMD 尚未收录该突变。根据Sanger 测序验证和随后的家系分析,发现先证者父母均为无症状的WEE2杂合突变携带者,说明疾病的遗传方式符合孟德尔常染色体隐性遗传,女性杂合子携带者不致病。此外,由于WEE2基因是母源基因,在卵母细胞中高度特异性表达,因此一般推断WEE2纯合杂合突变可能不影响男性生育力。本研究结果证实了WEE2基因纯合突变仅仅会导致女性不孕,并不影响男性生育。这也是目前世界上首个报道WEE2基因纯合突变的男性案例。目前对于该类患者,王磊教授研究团队通过向WEE2突变的卵母细胞中注射野生型WEE2-cRNA进行治疗[9],拯救实验结果显示注射后的卵子能正常形成原核并受精,且能进一步培养后发育至囊胚阶段,但是由于生物安全方面因素考虑,研究者并未移植囊胚到患者子宫,此项技术还无法应用到临床治疗当中,因此对于此类患者一旦明确了基因突变诊断结果,推荐直接采用供卵进行治疗。
近年来,越来越多的遗传基因突变被证明与ART 周期中卵子和胚胎异常有关,从而导致女性不孕。例如,TUBB8和PATL2基因突变导致女性卵子成熟障碍[15-17],ZP1/ZP2/ZP3基因突变导致卵子透明带异常或空卵泡综合征[18],PADI6基因突变导致胚胎早期发育阻滞[19],WEE2[9-11]和TLE6[20]基因突变导致受精障碍和PANX1基因突变导致卵子死亡[21]等。WES 技术适合于ART 周期中各种极端异常表型的遗传学病因的确诊和研究,为患者进一步的助孕治疗提供合理指导。本研究中WEE2基因突变家系完整的展示了WEE2基因型、表型以及性别的关系,为ART 周期中低受精率和完全受精失败的分子诊断和遗传咨询提供了理论依据。

