rh-TPO与rhIL-11治疗儿童急性髓系白血病化疗后血小板减少症疗效分析
苏于泰 刘炜 马平 管玉洁 宋丽丽
急性髓系白血病约占儿童恶性肿瘤的4.5%。联合化疗是治疗急性髓系白血病的常用方法,但在提高患者生存率的同时,常会出现一系列并发症,其中化疗后血小板减少是常见的一种。化疗所致血小板减少症(CIT)是化疗对骨髓中的巨核细胞产生抑制作用,导致外周血小板减少的一种并发症[1]。发生CIT会延缓化疗进度,影响疗效和患者生存,增加血液制品的输注数量及医疗费用。CIT的治疗包括血小板输注,rh-TPO、rhIL-11应用。本研究回顾性分析我院收治的84例骨髓完全缓解的急性髓系白血病患儿资料,按照应用rh-TPO、rhIL-11,不应用升血小板药物分为三组,观察rh-TPO、rhIL-11疗效及不良反应。
1 材料与方法
1.1 研究对象收集2017年3月~2020年3月在我院诊治的急性髓系白血病患儿。入选及排除标准:①均为化疗缓解后巩固强化者;②采用IAH、IAE、MA、Clasp、HA方案化疗者;③排除急性髓系白血病M3、治疗后严重感染、血栓、DIC者。共84例患儿符合标准,其中男44例,女40例,中位年龄6岁(1~14岁)。随机分为实验组和对照组。实验组分为两组,一组28例患儿在化疗后应用rh-TPO(rh-TPO组),一组28例患儿化疗后应用rhIL-11(rhIL-11组);对照组28例,化疗后不应用升血小板药物。三组患儿的性别、年龄、化疗方案等一般资料比较,差异均无统计学意义(P>0.05)。本研究经我院伦理委员会批准通过,且患儿家属均知情同意并签署知情同意书。
1.2 治疗方法上述方案化疗结束后24h内,rh-TPO组和rhIL-11组分别应用rh-TPO 300U·kg-1·d-1和rhIL-11 50μg·kg-1·d-1,最多应用14d。对照组不应用升血小板药物。骨髓抑制期间,当血小板<20×109/L时或血小板<30×109/L有明显出血倾向时输注单采血小板预防严重出血。
1.3 观察指标观察各组血小板<30×109/L持续时间(表示化疗后骨髓抑制期血小板减少时自发性出血风险),血小板恢复至≥50×109/L所需时间(表示化疗后骨髓抑制期血小板减少后至恢复至安全水平所需时间),血小板恢复至≥100×109/L所需时间(表示血小板恢复至正常水平所需时间),不良反应的发生情况。
1.4 统计学分析用SPSS 25.0软件进行统计学分析。定量资料应用±s表示,采用方差分析检验样本间的差异性。P<0.05为差异有统计学意义。
2 结果
2.1 化疗后血小板减少持续时间和血小板恢复时间rh-TPO组和rhIL-11组的血小板<30×109/L持续时间均短于对照组(P<0.05);rh-TPO组短于rhIL-11组,但差异无统计学意义(P>0.05)。
rh-TPO组和rhIL-11组血小板恢复至≥50×109/L所需时间均短于对照组(P<0.05);rh-TPO组短于rhIL-11组,但差异无统计学意义(P>0.05)。
rh-TPO组血小板恢复至≥100×109/L所需时间最短,rhIL-11组次之,对照组时间最长,两两比较差异均有统计学意义(P<0.05)。见表1。

表1 化疗后血小板减少持续时间和血小板恢复时间(天)
2.2 化疗后输注血小板数目84例患儿中,3例未输注血小板,均为rh-TPO组。rh-TPO组输注血小板(2.53±1.05)治疗量,rhIL-11组输注(3.20±1.37)治疗量,对照组输注(4.98±1.89)治疗量。与对照组比较,rh-TPO组及rhIL-11组输注血小板数均少于对照组(P=0.057)。实验组中的rh-TPO组输注血小板数少于rhIL-11组(P<0.05)。
2.3 血小板动态变化趋势从图1可以看出,第1~12天三组血小板计数均有下降趋势,且三组间血小板计数差异无统计学意义。从化疗后第12天开始,实验组血小板计数上升速度明显高于对照组,差异有统计学意义(P<0.05);实验组血小板计数上升第22天达到峰值,后与对照组趋于一致。
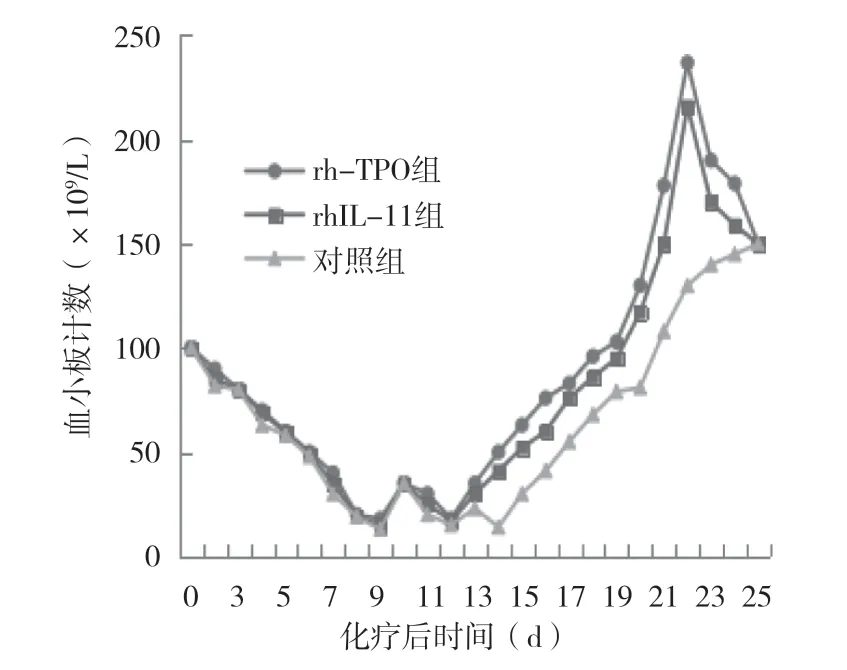
图1 血小板动态变化趋势
2.4 不良反应发生情况rh-TPO组中2例出现发热,1例出现肌肉疼痛,1例出现注射部位红肿。rhIL-11组中2例出现发热,2例出现肌肉疼痛,1例出现注射部位红肿,1例出现晕厥。两组不良反应发生后,未特殊处理,均较快好转。与rhIL-11组比较,rh-TPO组不良反应发生率低,但差异无统计学意义(14.3% vs 21.4%,P=0.36)。
3 讨论
目前已发现多种血小板生长因子,如rhIL-11、rh-TPO、聚乙二醇化重组人巨核细胞生长发育因子、TPO受体激动剂(c-mp1)(如罗米司汀、艾曲波帕等)。但目前TPO受体激动剂尚未获得我国食品药品监督管理总局(CFDA)批准用于治疗CIT。
TPO是调节巨核细胞增殖成熟和血小板生成的内源性细胞因子,其通过与巨核细胞表面的特异性受体c-mp1结合而发挥生物学作用,在巨核细胞增殖、分化、成熟并产生有功能的血小板过程中起促进作用。目前临床应用的rh-TPO是利用基因重组技术由中国仓鼠卵巢细胞表达,经提纯制成的全长、天然人氨基酸序列的糖基化分子,与内源性TPO具有相似的升高血小板的药理作用,其循环半衰期为20~40h。目前只有中国批准rh-TPO治疗化疗诱导的CIT和免疫性血小板减少性紫瘢(ITP)。早期有研究显示[2],化疗前3周每周单剂量应用rh-TPO,血小板计数在第21天即化疗开始前高于基线水平,且血小板计数增加呈剂量相关关系。近年一项Ⅱ期临床实验研究显示[3],应用rh-TPO预防大剂量阿糖胞苷化疗引起的CIT,化疗前模式较标准模式血小板减少率更低,血小板输注更少。本研究中,rh-TPO组较对照组能有效缩短有出血风险的较低血小板持续时间,快速提升血小板至正常范围。同时观察到,rh-TPO组较对照组输注血小板数目更少,应用期间未发生严重不良反应。故预防性应用rh-TPO治疗CIT是安全有效的。
IL-11是由造血微环境基质细胞和部分间叶细胞产生的多效性细胞因子。IL-11的促造血功能主要表现是直接刺激造血干细胞和巨核系祖细胞的增殖,诱导巨核细胞分化成熟,促进高倍性巨核细胞生成,增加单个巨核细胞、血小板的产量,从而增加血小板的生成[4]。IL-11刺激巨核细胞生长和血小板生成,并非通过TPO的释放或协同作用介导,并且与TPO受体无关[5,6]。1991年,IL-11基因被整合到大肠杆菌中表达,生产出rhIL-11并且进入临床试验阶段,促进巨核细胞和血小板的生成。1997年,美国食品和药品监督管理局(FDA)正式批准rhIL-11上市,预防CIT的发生。2003年,中国CFDA批准了国产rhIL-11用于化疗所致Ⅲ、Ⅳ级CIT的二级预防和有指征治疗[7]。临床研究发现,rhIL-11(50μg·kg-1·d-1)可轻度减轻化疗诱发的血小板减少和降低血小板输注需求[8],本研究中rhIL-11组较对照组,可缩短CIT持续时间及减少血小板输注,提示rhIL-11在预防CIT方面同样有效,与报道相互佐证。
本研究中,实验组较对照组,在缩短CIT持续时间及减少血小板输注上有明显优势。rh-TPO组在血小板<30×109/L持续时间,血小板恢复至≥50×109/L所需时间少于rhIL-11组,但差异无统计学意义(P>0.05),可能与样本量少有关,应在临床中进一步观察。rh-TPO组在血小板恢复至正常范围所需时间最短,rhIL-11组次之;rh-TPO组输注血小板数少于rhIL-11组(P=0.057)。以上结果提示rh-TPO组较rh-IL11组,在CIT后恢复血小板至正常范围及减少血小板输注上具有一定优势,与成人研究报道相符[9]。rhIL-11治疗血小板减少症临床应用中国专家共识指出,rhIL-11主要不良反应为乏力、发热、水肿、心动过速、短暂贫血及结膜充血等,大多数为轻至中度,停药后均能迅速消退。相关文献显示[10],rh-TPO的不良反应主要为与注射相关的不良事件,主要包括发热、乏力、关节肌肉酸痛等。本研究中,与rhIL-11组比较,rh-TPO组不良反应发生率低,但差异无统计学意义(P>0.05)。提示两种药物在CIT治疗中安全可行,rh-TPO似乎更优。
综上,rh-TPO与rhIL-11均可缩短儿童急性髓系白血病化疗后血小板减少时间,减少血小板输注量,降低不良反应发生率,且rh-TPO更具优势。

