乙型肝炎后肝硬化患者外周血免疫指标的水平及临床意义
邢亚斯 秦方园 杨静文 翟亚萍
乙型肝炎病毒(HBV)感染人体后,主要通过免疫损害引起肝脏病变。肝硬化是HBV感染后肝病发展的晚期阶段。该病并发症多,且发病率和死亡率均较高,发展成为肝衰竭和肝癌的风险极大[1]。乙型肝炎肝硬化(乙肝肝硬化)的发病机制与HBV感染机体后的一系列免疫反应所致的免疫病理损害相关,多种免疫细胞和细胞因子共同参与了其发生和发展的过程[2]。本研究对慢性乙肝、乙肝肝硬化患者及健康志愿者外周血中淋巴细胞亚群及其血清中细胞因子的水平变化进行了对比,从细胞免疫的角度分析了乙肝肝硬化患者的免疫状态,为乙肝肝硬化患者的临床评估和早期干预提供理论依据。
1 材料与方法
1.1 材料
1.1.1 一般资料 选择2017年1月~2018年5月在我院感染科就诊的30例慢性乙肝患者(A组),男15例,女15例,平均年龄(45.37±10.28)岁;32例乙肝肝硬化患者(B组),男17例,女15例,平均年龄(48.75±9.43)岁,另选取同期30例健康志愿者作为对照组(C组),男15例,女15例,平均年龄(46.40±13.77)岁。以2015版《慢性乙型肝炎防治指南》及2012版《肝衰竭诊疗指南》作为诊断标准[3,4]。患者排除其它病原体感染、自身免疫性疾病、酒精性肝病、肝癌、三个月内使用过免疫调节剂或者激素等情况。三组性别、年龄比较差异无统计学意义(P>0.05)。本研究经我院伦理委员会批准,且所有入组患者或家属签署知情同意书。
1.1.2 主要试剂及仪器 流式细胞术检测淋巴细胞亚群,标记所用抗体:CD3 FITC、CD4 PE-Cy7、CD8 APC-Cy7、CD45 PerCP-Cy5-5、CD19 APC、CD16+CD56 PE、CD4 FITC、CD25 PE、CD127 APC、CD3 PE-Cy7、CD5 APC、CD19 FITC、HLA-DR APC(BD公司,美国),AimPlex流式多因子检测试剂盒(旷博生物公司,北京),流式细胞仪(BD公司Canto Plus,美国)。
1.2 实验方法
1.2.1 样本采集 清晨采集患者及健康志愿者空腹时肘静脉血,2ml置于乙二胺四乙酸二钠(EDTANa2)抗凝管中,2ml置于无抗凝剂的采血管中。EDTANa2抗凝管颠倒混匀数次并于2h内进行淋巴细胞亚群的检测。无抗凝血采集后避免颠倒混匀以免发生溶血,室温静置2h,待红细胞凝固自然析出血清后,取出上清液,置-80℃冰箱保存备检。采用流式法检测外周血淋巴细胞亚群比例及细胞因子含量。
1.2.2 淋巴细胞亚群检测 采用淋巴细胞亚群检测试剂检测三组受试者外周血中各细胞亚群百分比,所用试剂及检测内容见表1。在流式管中分别取相应量的试剂及50μl抗凝血混匀,室温避光孵育20min,每管中分别加入1ml溶血剂,混匀,室温避光孵育9min,1 500r/min离心5min,弃上清,加入2ml流式鞘液,1 500r/min洗涤5min,弃上清并加入500μl流式鞘液重悬,立即用流式细胞仪检测。采用Diva Analysis软件分析淋巴细胞百分比。

表1 淋巴细胞亚群及其试剂
1.2.3 血清中相关细胞因子的检测 取出-80℃冰箱保存备用的血清,采用AimPlex流式多因子检测试剂盒对三组受试者血清中的IL-2、IL-4、IL-6、IL-10、IL-17A、INF-γ、TNF-α七种因子同时进行处理,操作步骤严格按照试剂盒说明书进行,流式细胞仪上机检测并分析结果。
1.3 统计学方法采用SPSS 19.0统计学软件对数据进行分析,A、B、C三组同时符合正态分布的计量资料采用t检验,以均数±标准差(±s)表示,三组中有一组或多组不符合正态分布的计量资料采用非参数检验,用中位数(四分位数间距)表示,以P<0.05为差异有统计学意义。
2 结果
2.1 B组患者外周血淋巴细胞亚群流式结果通过三种组合Panel检测乙肝肝硬化患者的外周血淋巴细胞亚群流式结果,见图1。
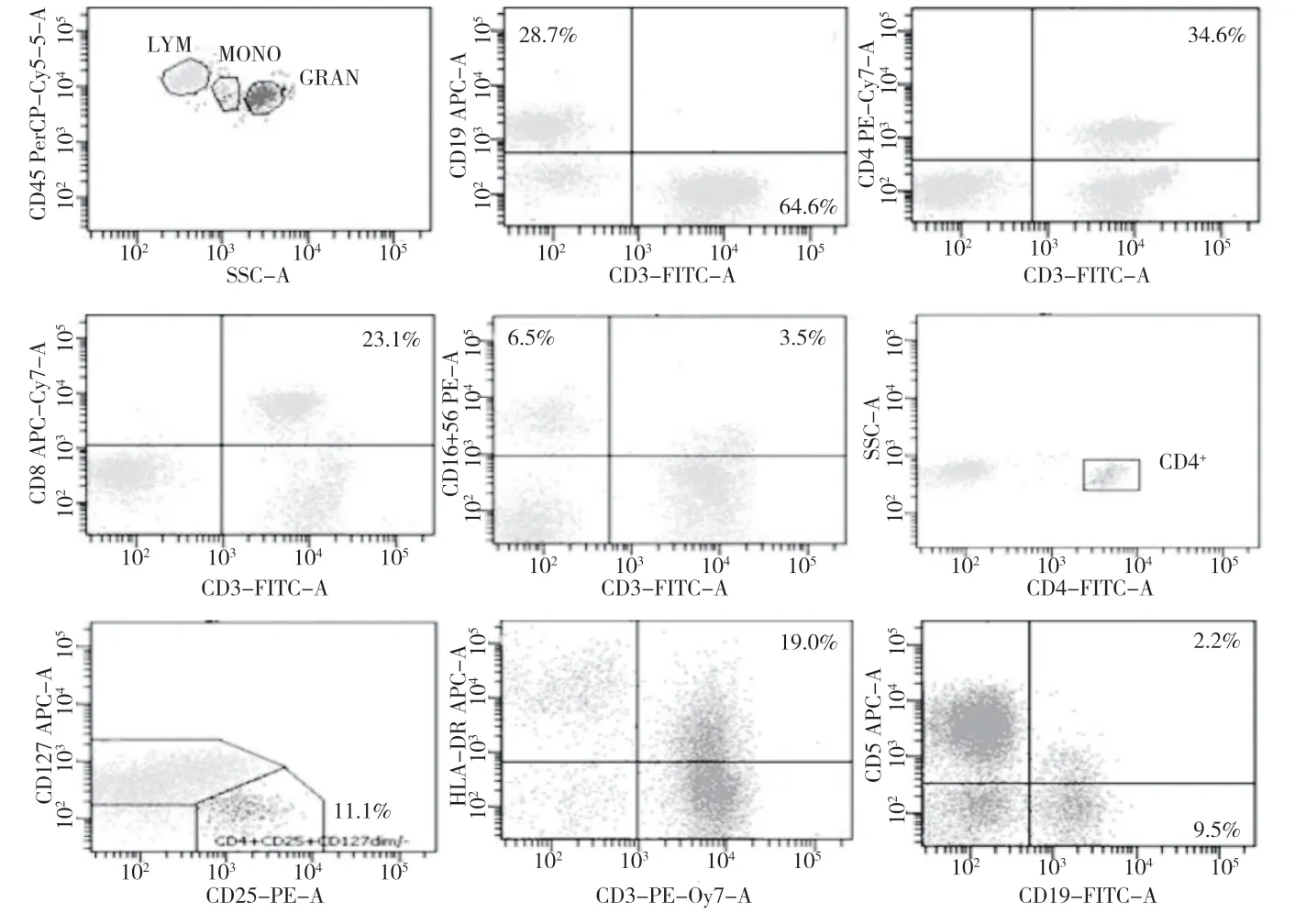
图1 乙肝肝硬化患者外周血淋巴细胞亚群鉴别
2.2 三组外周血中淋巴细胞亚群水平比较B组外周血中淋巴细胞、Th、NK、T、Tc、NKT细胞比例、CD4+/CD8+均低于A组和C组,差异有统计学意义(P<0.05),A组除Tc细胞较C组稍高,其余指标均低于C组,但只有NK细胞的降低比例较C组差异有统计学意义(P<0.05),其余差异均无统计学意义(P>0.05)。B组中B、B1、B2、Treg、活化T细胞比例显著高于A、C组(P<0.05),且A组中除B2细胞低于C组,其余指标均较C组升高,但只有Treg细胞及活化T细胞的升高比例较显著(P<0.05),见表2。
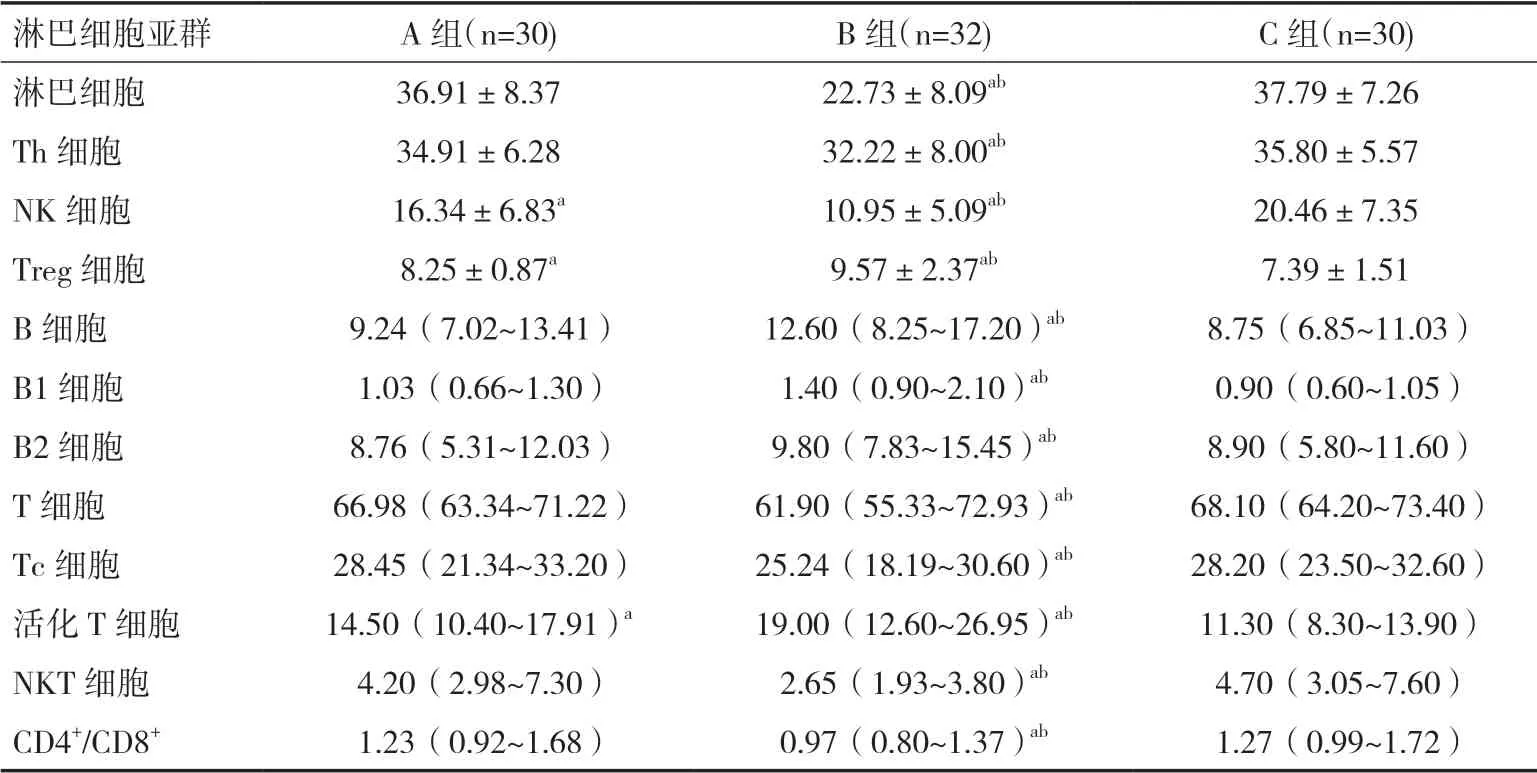
表2 三组外周血中淋巴细胞亚群水平比较(%)
2.3 三组血清中细胞因子水平的比较外周血血清中的IL-2、IL-4、IL-6、IL-10、IL-17A、INF-γ在B组中的含量显著高于A、C组,差异有统计学意义(P<0.05)。TNF-α在B组中的含量显著高于C组(P<0.05),但与A组比较差异无统计学意义(P>0.05)。A组中IL-6、IL-10、IL-17A、INF-γ与C组相比显著升高(P<0.05),而IL-2、IL-4、TNF-α较C组差异无统计学意义(P>0.05)。见表3。

表3 三组外周血血清中细胞因子水平比较(pg/ml)
3 讨论
宿主免疫调控紊乱是导致肝损伤的主要原因,肝硬化相关的免疫功能紊乱包括一系列的免疫功能异常、免疫缺陷和全身性的炎症。乙肝肝硬化的病程也与宿主的免疫状态相关[5]。
T淋巴细胞亚群介导的细胞免疫及细胞因子网络在免疫调控中起着重要作用。T淋巴细胞主要分为Th、Tc亚群,Th细胞又分为Th1、Th2、Treg和Th17。Th细胞在免疫应答中被抗原激活后诱导细胞免疫和体液免疫,能促进B细胞、Tc细胞及其它免疫细胞的增殖和分化,具有较强的抗病毒作用[6]。Tc细胞包括抑制性T细胞和杀伤性T细胞,其在被细胞因子激活后,产生穿孔素和颗粒酶,将靶细胞破坏,这是HBV感染机体后引起肝细胞损伤的主要原因,也是机体清除细胞内病毒的主要机制[7]。Treg细胞在机体自身耐受的维持中发挥着重要作用,与免疫调节、自身免疫性疾病、移植耐受、肿瘤免疫、乙肝慢性化等相关。B淋巴细胞主要分为B1a、B1b和B2三个细胞亚群,B细胞分泌多种自身抗体及抗病原菌抗体,参与许多自身免疫性疾病和肿瘤的发生。NK细胞是机体重要的执行非适应性免疫反应的免疫细胞,它介导天然的免疫应答,不依赖抗体和补体,能直接杀伤靶细胞,具有抗感染、免疫调节和免疫监视的作用[8]。本研究结果显示B组患者外周血中总淋巴、T、Th、Tc、NK、NKT细胞比例及CD4+/CD8+均低于A组和C组,差异有统计学意义(P<0.05),A组中除Tc细胞较C组稍高外,其余指标均低于C组,但只有NK细胞的降低比例较C组差异有统计学意义(P<0.05),其余差异均无统计学意义(P>0.05)。提示随着乙肝病情的进展,患者体内的T细胞和NK细胞的比例逐渐降低,长期的HBV感染可导致机体免疫功能降低,且病情越重免疫功能降低的越明显,这可能是导致HBV感染慢性化的原因之一[9,10]。B组中B、B1、B2、Treg、活化T细胞比例显著高于A、C组(P<0.05),且A组中除B2细胞低于C组,其余指标均较C组升高,但只有Treg细胞及活化T细胞的升高比例较显著(P<0.05)。提示HBV感染机体后,B细胞主要发挥体液免疫应答和抗原递呈作用,B细胞比例的升高,提示B细胞可能参与乙肝肝硬化的进展。Treg细胞是具有免疫抑制功能的T细胞亚群,能负向调节对自身和外来抗原的免疫反应,慢性乙肝和肝硬化患者中Treg细胞比例逐渐升高,认为其可抑制HBV抗原特异性T细胞,从而导致免疫耐受和免疫逃逸而使病毒长期存在,最终致使肝细胞损伤发生[11]。患者机体被HBV抗原刺激后,T细胞及B细胞处于活化状态。T细胞的活化与病毒的杀伤和清除相关,虽然T细胞处于活化状态,但慢性乙肝及肝硬化患者中T细胞的比例降低,长期持久的病毒抗原刺激导致T细胞应答能力较弱,故而不能有效清除病毒[12]。而B细胞的活化与体液免疫及肝病的进程相关。HBV感染机体后通过各种病毒抗原激发机体免疫系统使致敏的B细胞转化为浆细胞,并产生相应抗体,从而对HBV进行反应并杀灭,而在此过程中受感染的肝细胞亦遭到攻击,使肝细胞受到损伤[13]。有研究报道,外周血B1细胞随着乙肝转为慢性乙肝到重症乙肝最后发展成肝硬化,其水平有逐步升高的趋势,说明B1细胞可能参与多种肝病的发展过程[14]。
Th细胞中的Th1细胞亚群主要分泌IL-2、TNF-α、IFN-γ。IL-2能反映机体的免疫状态,是重要的免疫增强剂,它能刺激T细胞增殖,激活NK和巨噬细胞。TNF-α可增强抗原提呈细胞促进免疫应答的能力,也可产生抗病毒蛋白,起到抑制病毒复制的作用。IFN-γ也具有抗病毒和免疫调节的功能,可激活肝细胞自身抗病毒机制从而抑制HBV DNA的复制[15]。本研究中IL-2、TNF-α和IFN-γ在A组和B组中有所升高,且与C组相比,B组的升高比例更显著,说明HBV感染机体后,患者体内的T细胞被病毒抗原所激活,使体内的细胞因子含量逐渐升高,这些因子又可使机体产生大量的Tc细胞,从而有利于HBV的清除。但由于T细胞的比例随着病情的进展逐渐降低,导致其分泌的因子含量不足以抑制和清除病毒,最终导致病毒长期存在和疾病进展。Th2细胞亚群主要分泌IL-4、IL-6、IL-10,主要作用于B细胞,刺激B细胞的活化并分泌免疫球蛋白,介导体液免疫。IL-4是诱导前体细胞向Th2分化的直接刺激因子,是Th2应答强度的重要衡量指标,王茸等[16]研究表明,IL-4在慢性肝炎、重型肝炎组中呈升高趋势,说明IL-4升高与HBV感染病情进展及肝硬化、肝癌的发生有关,与本研究中的结果一致。IL-6和IL-10都是具有多种功能的细胞因子[17,18],HBV感染机体后可刺激单核巨噬细胞产生IL-6和IL-10, IL-6在肝内可以调节许多急性期反应蛋白的合成,同时也是一种与慢性肝病相关的调节因子。IL-10是免疫抑制剂,可通过抑制Th1细胞的增殖及IFN-γ等细胞因子的分泌而抑制机体的抗病毒能力。本研究中乙肝肝硬化患者IL-6水平显著高于正常人和慢性乙肝患者,说明IL-6与乙肝的慢性化相关,IL-10水平的升高提示其合成的增加限制了机体清除HBV的能力,导致病程的延长。IL-17A是由Th17细胞分泌的一种重要的促炎因子,且与HBV感染后肝脏的炎性损伤密切相关。IL-17A可以动员、募集和激活中性粒细胞,引发严重的组织炎症,并促进自身免疫性疾病的发展[19]。有研究表明血清IL-17A水平的升高,可作为肝损伤严重程度的标志物[20]。本研究中IL-17A在乙肝肝硬化患者体内的水平显著高于正常人和慢性乙肝患者,且慢性乙肝患者中该水平显著高于正常人,反映了HBV感染机体后,随着病情进展,患者肝脏的损伤程度进一步恶化,提示IL-17A可做为检测肝脏损伤程度的重要参考指标。
乙肝肝硬化的发生是一个复杂的过程,免疫系统紊乱在其发病过程中起着重要作用,乙肝肝硬化患者外周血淋巴细胞亚群、血清中细胞因子的水平较正常人及慢性乙肝患者都发生了明显变化,免疫功能的失调使得乙肝肝硬化的病死率和肝移植风险显著升高。因此,在乙肝肝硬化发生的早期对其进行诊断,并采取有效的措施进行治疗干预,对提高患者的生存质量具有重要意义。

