基于网络药理学的爵床抗肿瘤活性成分及作用机制研究
胡进 陈辉 张欢 谢周涛
中药爵床为爵床科植物爵床Rostellularia procumbens (L.) Nees的干燥全草,是传统的中草药。爵床具有清热解毒、利尿消肿之功效,临床用于治疗感冒发热、咽喉肿痛、痢疾、肠炎、肾盂肾炎等症,外用治疗痈疮疖肿等[1]。爵床全草的现代研究表明,其主要化学成分为木脂素及其苷类、黄酮类、生物碱、三萜类化合物等。现代药理研究表明,爵床具有抗肿瘤、抗病毒、抗菌等多种生物活性[2],目前爵床的药理作用研究仍不够系统与全面。
网络药理学作为一种系统性、整体性的研究药物、疾病、靶点之间相互关系的分析方法,与中药多成分、多靶点、多途径作用特征相吻合,可系统发掘中药潜在活性成分和作用靶点[3,4]。我们采用网络药理学的研究方法,预测爵床抗肿瘤的活性成分、治疗靶点和信号通路,并使用分子对接进行验证。
1 材料与方法
1.1 化学成分库构建通过检索国内外相关文献,构建爵床的化学成分库,结合 Pubchem数据库,采用 Chemoffice软件绘制成分的化学结构并保存为MOL2格式。
1.2 活性成分筛选药物的体外筛选模型主要涉及药物的肠吸收、血脑屏障渗透性、体外代谢、药物相互作用和各种体外毒性模型等,并以人体肠道吸收(HIA)、Caco-2细胞渗透性(简称Caco-2)和血浆蛋白结合(PPB)作为关键参数进行筛选[5]。将该格式的化合物导入 https://preadmet.bmdrc.kr/网站,计算并预测药物吸收、分布及代谢。筛选出HIA大于20,Caco-2渗透性大于4和PPB大于70的所有化学成分作为候选药效成分。
1.3 药效成分靶点预测将筛选好的各成分的MOL2结构导入 Pharm Mapper服务器中,采用反向药效团匹配方法进行靶点预测,将匹配得分靠前的靶点在Uniprot数据库进行检索,限定物种为人,对靶点名称进行统一。
1.4 疾病相关靶点筛选通过 GeneCards数据库检索关键词“cancer”,得到与肿瘤相关的基因,最后导入 Uniprot数据库进行基因名标准化处理后归纳整理,获得肿瘤潜在相关基因靶点。
1.5 构建蛋白互作(PPI)网络将潜在靶点导入 String数据库,获得PPI关系,设置置信度大于0.900,隐藏无PPI关系的靶点,以 TSV格式保存结果,再将数据导入 Cytoscape 3.6.1软件进行可视化处理和分析。
1.6 靶点通路注释分析KEGG(Kyoto encyclopediaof genes and genomes)在网络药理学中常用于信号通路的注释,对靶点基因进行通路注释,可以了解靶点基因参与的信号通路。Gene Ontology(GO)数据库涵盖的生物学包括:细胞组分(Cell component,CC)、分子功能(Molecular function,MF)、生物过程(Biological process,BP)3个方面。将所有潜在靶点基因上传至 DAVID数据库,进行 KEGG通路注释与 GO富集。设置阈值P<0.05,根据P值排序保留得分靠前的结果,并进行可视化分析。
1.7 “成分-靶点-通路”网络构建利用Cytoscape 3.6.1软件构建靶点基因-活性成分网络及靶点基因-富集通路网络,网络节点表示活性成分、作用靶点及作用通路,网络边表示两节点之间存在关联。通过构建网络模型研究爵床多成分、多靶点、多通路的抗肿瘤作用机制。
1.8 分子对接从PBD数据库下载度值较高的靶点蛋白结构文件(PBD格式),利用 AutoDockTools软件对下载的靶蛋白进行加氢、加电子等前处理;靶点与活性成分进行 AutoDock分子对接验证实验,同时遴选阳性药进行分子对接,以此结合能比较靶点和活性成分结合的性能。
2 结果
2.1 药效成分筛选通过筛选共得到 27种候选药效成分,其中有17个为木质素类成分,如 Justicidin C等;5个三萜类化合物,如friedelin;4个为黄酮类成分,如kaempferol;1个有机酸化合物,如 Palmitic acid。见表1。
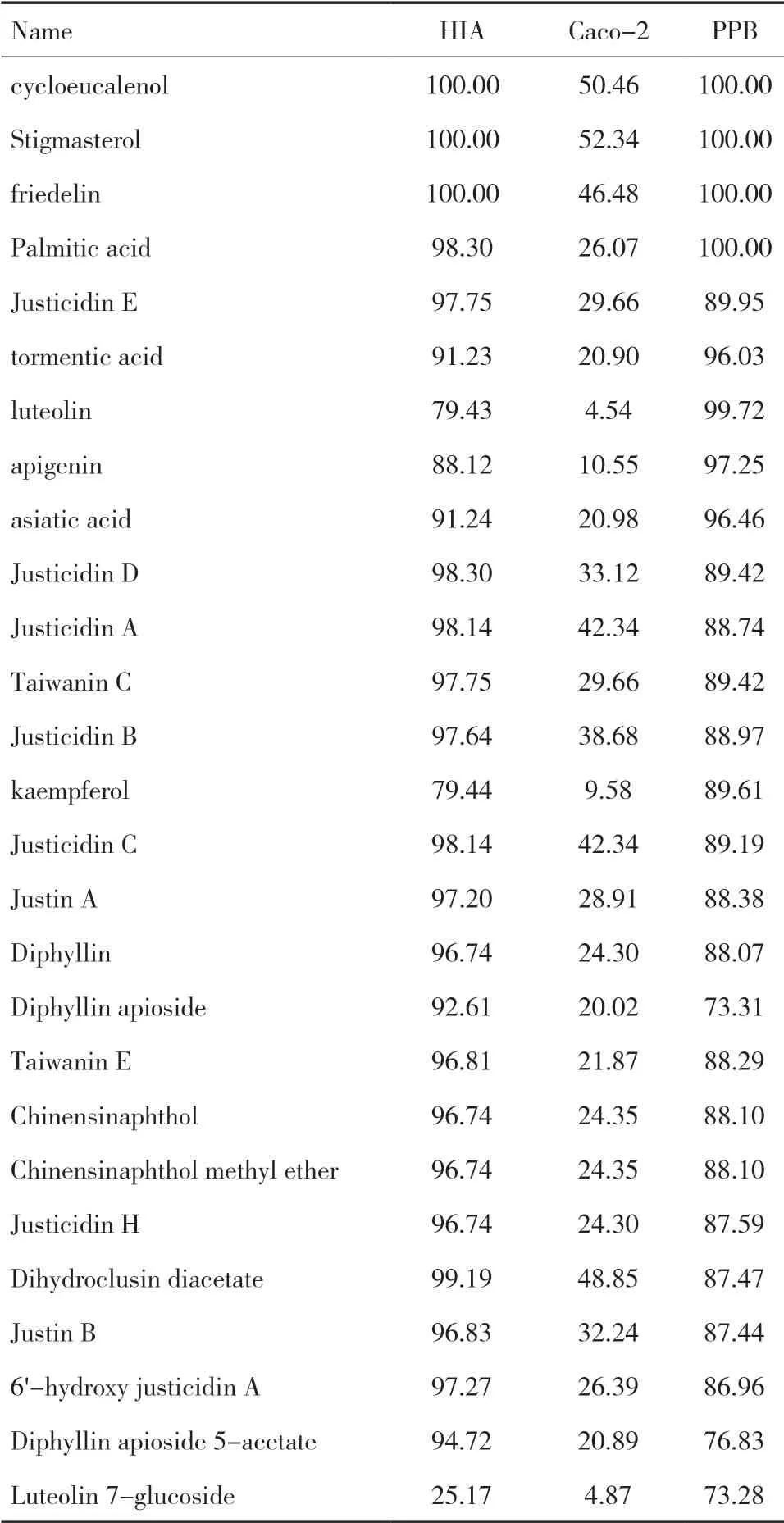
表1 药效成分筛选结果
2.2 肿瘤相关靶点的筛选分析通过 GeneCards数据库检索关键词“cancer”,得到与肿瘤相关的基因,最终得到肿瘤靶点基因 1 480个,选取得分≥20的 397个基因进行分析。得分位于前10的基因为BRCA2、BRCA1、TP53、CDH1、MLH1、MSH2、MSH6、APC、ATM、PTEN。
2.3 PPI网络构建与分析将活性成分作用的潜在靶点与肿瘤相关疾病基因进行比对,获得爵床抗肿瘤活性成分潜在靶点基因,共得到54个与肿瘤聚集相关的基因数据,见表2。使用 Network Analyse功能对PPI网络进行分析,见图1。图中共有54个节点,176条边,平均度值为6.52。在PPI网络中度值较高的靶点有SRC、苏氨酸激酶1(Akt1)、丝裂原活化蛋白激酶1(MAPK1)、PIK3R1、PTPN11等。

图1 PPI网络图

表2 爵床抗肿瘤活性成分潜在靶点基因
续表2
2.4 活性成分潜在靶点的通路注释利用 DAVID数据库对爵床抗肿瘤的靶点进行富集分析,将P<0.05作为注释结果的筛选条件并绘图。
GO功能富集分析结果显示,在BP与正调控RNA聚合酶Ⅱ启动子的转录、正调控细胞增殖、负调控 RNA聚合酶Ⅱ促进转录相关性最大;MF与生长因子活性、ATP结合、受损 DNA结合相关性最大;CC与细胞外空间、核浆、细胞质相关性最大。见图2~4。
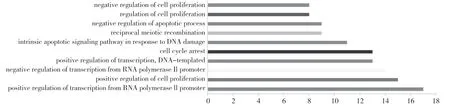
图2 GO功能富集 BP分析
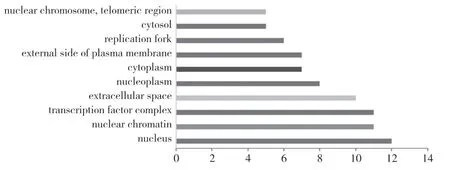
图3 GO功能富集 CC分析

图4 GO功能富集 MF分析
KEGG通路注释结果显示,有96条抗肿瘤相关信号通路,排名前十的通路为:PI3K-Akt信号通路、雌激素信号通路、Ras信号通路、催乳激素信号通路、甲状腺激素信号通路、ErbB信号通路、FoxO信号通路、Rap1信号通路、趋化因子信号通路和MAPK信号通路。见图5。
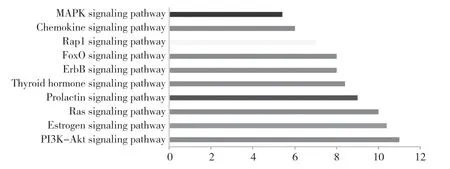
图5 相关通路 KEGG富集分析
2.5 “活性成分-靶点-通路”网络构建分析选取了 27个活性成分、53个靶点基因和 KEGG通路分析的 15条通路,构建“活性成分-靶点-通路”网络图。该网络共包含 95个节点, 456条边,见图 6。
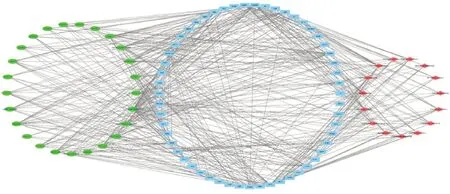
图6 活性成分-靶点-通路网络分析图
2.6 分子对接验证结合文献分析选择排名靠前的基因,选择 AKT1、MAPK1两个靶点作为分子用于对接实验。从PBD数据库中分别选择了3O96(AKT1),5NHO(MAPK1)作为对接的蛋白结构。选择度值较高的化合物Chinensinaphthol,Diphyllin,Taiwanin E,tormentic acid与上述2个靶点蛋白进行分子对接 ;通过文献分析并结合当前的研究热点,选取了 ulixertinib、resveratrol分别作为MAPK1、AKT1蛋白靶点的阳性对照药,以结合能判断化合物与靶点蛋白的亲和力。见表3。
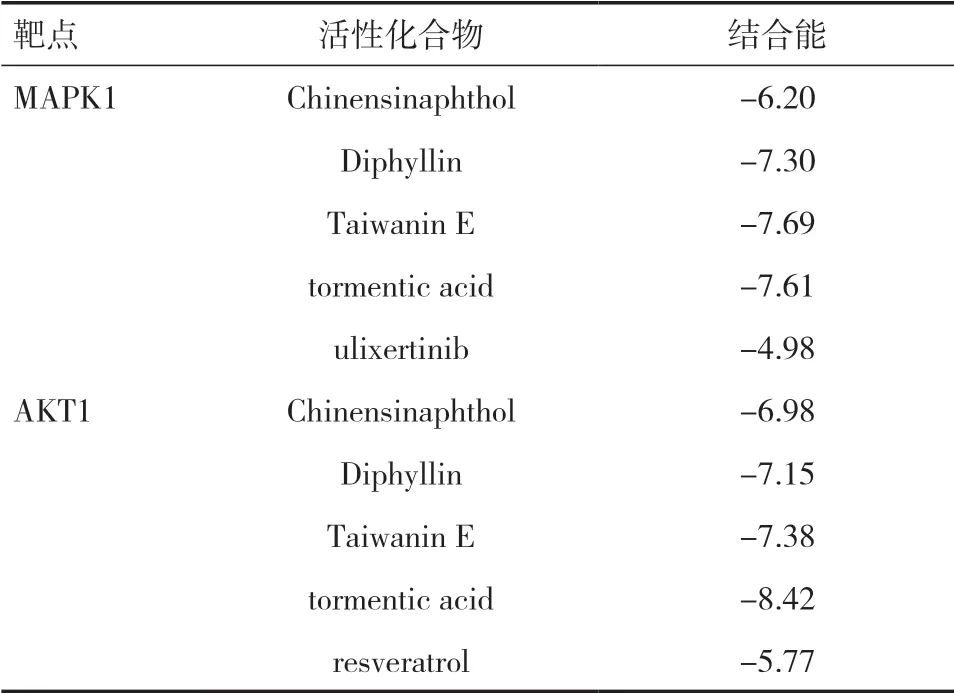
表3 有效成分与核心靶点的分子对接
3 讨论
肿瘤已经成为严重影响人类生命健康的常见疾病,近年来其发病率和死亡率呈现不断上升趋势。中医学历史悠久,在研究肿瘤的发生、发展和防治方面已形成了特色鲜明的肿瘤学科体系,在预防肿瘤发生以及减毒增效、抗耐药、防止复发转移等方面具有明显优势,已成为防治肿瘤疾病不可或缺的重要医疗措施[6]。
本研究发现爵床的主要抗肿瘤活性成分有山荷叶素(Diphyllin)、委陵菜酸(Tormentic acid)、木犀草苷等化学成分。Diphyllin属于木脂素类化合物,有研究证明具有较好的抗肿瘤活性,且对正常细胞毒性小[7]。Tormentic acid可诱导白血病细胞的凋亡,导致细胞核固缩以及核碎裂,提高了其细胞中Caspase-3的表达水平,促进了细胞色素 C的释放,表现出明显的抗肿瘤作用[8]。木犀草苷的低、中、高剂量组对 A431细胞的增殖抑制率上升,迁移和侵袭细胞数均降低。沈琴等[9]研究发现,木犀草苷可抑制皮肤鳞状细胞癌细胞增殖、迁移和侵袭 ,可能与其促进 ST7L基因表达有关。
基于 PPI网络分析可知爵床抗肿瘤的主要靶点为 SRC、Akt1、MAPK1、PIK3R1、PTPN11等。SRC基因是具有内在酪氨酸激酶活性的人类癌基因,SRC蛋白能介导生长因子、黏附因子、趋化因子等多条下游信号通路[10]。研究表明,SRC的过度表达和活化,在调节肿瘤血管生成、细胞增殖、迁移及侵袭等方面起着十分重要的作用[11~13]。MAPK1作为 MAPK家族中的一员,在肿瘤的增殖、分化和侵袭过程中也发挥着十分重要的作用[14,15]。Lei等[16]研究表明,MAPK1的表达上调与多种肿瘤的发生与发展有着十分密切的联系。
从通路富集结果可知,爵床抗肿瘤的主要通路有PI3K-Akt信号通路、雌激素信号通路、FoxO信号通路、Rap1信号通路、MAPK信号通路等。 PI3KAkt通路可在多种肿瘤中引发细胞生长、上皮间质转化和血管生成[17]。Hirashima等[18]研究发现PI3K-Akt通路可刺激食管癌增殖、侵袭与转移,所以激活PI3K-Akt通路可促进食管癌进展。Rap1信号通路调控细胞黏附、迁移及血管生成等,其过程与恶性肿瘤的发生、发展有着非常强的相关性[19,20]。FoxO信号通路与细胞凋亡有着十分密切的相关性,FoxO家族参与线粒体依赖性和非依赖性的凋亡过程,因而激活死亡受体配体的表达[21]。雌激素在肝细胞癌中具有保护性作用,雌激素可抑制炎症诱导的肝细胞癌发生,其介导各种致癌信号通路的抑制[22~25]。以上研究结果都验证了雌激素在肝细胞癌发生、发展中具有十分重要的调控作用。
综上所述,抗肿瘤的作用机制复杂,涉及多个基因与多个信号通路。本研究借助中药网络药理学的方法,初步预测爵床的主要活性成分、靶点与抗肿瘤的相关靶点,为爵床有效成分的筛选及深入研究提供一定科学依据。

