个体化运动训练对急性心肌梗死经皮冠状动脉介入术后患者体适能的影响
陈伟 范秋季 洪钱沁 何民 李瑾
中国心血管病报告指出,我国冠心病急性发病人数和急性心肌梗死(Acute myocardial infarction,AMI)的死亡率呈快速上升趋势且患者趋于年轻化,接受经皮冠状动脉介入治疗(Percutaneous coronary intervention,PCI)的患者数量也进一步增加[1,2]。但仅依赖于 PCI术和规范的药物干预治疗并不能持续有效地改善预后,多数患者仍存在术后心肺功能、运动能力下降及焦虑抑郁等问题,影响生活质量[3]。
心脏康复是借助于运动训练、循证规范用药、心理干预等多种综合的干预措施,是冠心病康复与二级预防的重要组成部分,但目前国内外对于心脏康复运动形式的研究存在运动形式单一的问题,较多局限于单独的有氧运动或抗阻运动[4]。此外,关于冠心病患者运动康复训练疗效的研究多关注对心肺功能及运动能力的提高,很少关注运动训练对患者整体功能及体适能的改善作用。
体适能(Physical fitness)是指人们拥有的与完成体力活动相关的一系列要素或特征,由于 AMI患者特殊的运动危险性,给予AMI患者精确、定量的功能评估及康复训练方案,对改善患者体适能有重要意义。心肺运动试验(Cardiopulmonary exercise test,CPET)是衡量人体整体机能水平的无创性心肺功能检测方法,是评估心肺耐力的金标准[5]。功能性运动检测[6](Functional movement screen,FMS)是一套用以检测人体基础运动能力的简单量化的方法,可识别出常规医学方法检测不到的个体的功能受限和不协调性,其结果为个体化康复训练方案的制定提供了重要依据。
鉴于上述问题,本研究通过对PCI术后的AMI患者行基于CPET和FMS检测结果的个体化运动训练,探讨运动训练对 AMI患者体适能的影响,同时探讨 FMS在心脏运动训练中的有效性及使用价值,为康复医师制定个体化运动处方提供临床参考。
1 材料与方法
1.1 研究对象选取2018年3月~2020年8月在我院就诊的首次 PCI术后的AMI患者46例。本研究经我院伦理委员会批准,所有患者及家属知情并签署知情同意书。
纳入标准:①符合2017年欧洲心脏病学会 ST段抬高型急性冠脉综合征诊治指南和 2015年欧洲心脏病学会非 ST段抬高型急性冠脉综合征诊治指南[7,8];② PCI术后1~6个月;③年龄40~75岁;④既往无运动习惯,运动频率 <3次/周,运动时间<30min/次。
排除标准:①认知障碍者;②神经系统及骨骼肌肉疾病导致的运动障碍者;③合并心、脑、肾功能不全者;④左室射血分数<40%者;⑤严重的心律失常合并血流动力学异常者;⑥合并糖尿病严重并发症者;⑦依从性差,不愿意配合康复训练或中途退出者;⑧病情加重或训练期间出现严重心血管不良事件而无法继续参与康复训练者。
采用随机分组法将患者分为观察组(n=23)和对照组(n=23)。对照组按循证指南予以循证用药,并定期随访。观察组在药物治疗的基础上行基于症状限制性的 CPET和 FMS结果的个体化运动训练,共 36次。对照组只进行康复评估,不指导运动训练。研究期间所有患者尽量保持用药不变,且分别在干预前及干预后行体适能评估。
1.2 研究方法
1.2.1 体适能评估 在运动干预前,对纳入研究的患者进行体适能评估,包括:CPET、FMS及身体成分评估。
1.2.1.1 心肺运动试验 采用意大利 COSMED公司生产的运动心肺功能测试仪器,借助于功率自行车实施。患者在测试前12h禁烟、酒、茶及咖啡。测试前,进行气体流量、容量和浓度定标。患者取骑坐位并调整座椅高度。连接 12导联心电图、血压监测仪和指脉氧仪,佩戴面罩,检查无漏气后连接气体分析系统。根据患者的个体化指标选择10~20W/min的斜坡式功率递增试验 (Ramp)方案[9]。先静息3min,后以(60±5)r/min零负荷蹬车3min,以该速度继续运动,期间踏车功率以 10~20W/min速度呈斜坡式递增,至达到症状限制性运动试验终止指征中的任何一项,则卸载运动负荷[10]。
收集反映心肺功能的指标:无氧阈(Anaerobic threshold,AT)、峰值氧脉搏(Peak oxygen pulse,peak VO2/HR)、摄氧量与运动负荷之间的关系(Relationship of oxygen uptake and workload,ΔVO2/ΔWR)、峰值心率与收缩压乘积(Peak rate-pressure product,peak RPP)、1min心率恢复(Heart rate recovery at 1 min,HRR1)、峰值通气量(Peak ventilation,peak VE)、二氧化碳通气当量斜率(Ventilation/carbon dioxide production relationship,VE/VCO2slope)。反映运动能力的指标:峰值摄氧量(Peak oxygen uptake,peak VO2)、峰值代谢当量(Peak metabolic equivalents,peak METs)、峰值运动负荷(Peak workload,peak work)。
1.2.1.2 功能性运动检测(FMS) FMS套件包括 3根测量棒、1个测量板、1条测量皮筋、1个滑块。 FMS由 7个动作组成:①过顶深蹲,检测双肩、胸椎、髋、膝、踝关节的灵活性和对称性。②跨栏步,检测身体的协调性、稳定性。③直线弓步蹲,评价膝、踝关节的灵活性和稳定性,股四头肌的柔韧性。④肩部灵活性,评价双肩关节的内收内旋及外展外旋的能力。⑤直腿主动上抬,评价下肢的柔韧性。⑥躯干稳定俯卧撑,检测躯干的稳定性。⑦旋转稳定性,检测躯干在上下肢共同运动时的稳定性及对称性[11]。
1.2.1.3 身体成分 体质指数(Body mass index,BMI)是目前国际上普遍使用的衡量人体是否健康以及胖瘦程度的特异性指标,也是常用的评价身体成分的指标[12]。
1.2.2 个体化训练方案 观察组根据患者的评估结果制定个体化的康复训练方案,共训练 36次,详细的训练方案如下。
1.2.2.1 运动准备期 采用低水平的有氧运动:老年关节灵活操,使患者逐渐从静息过渡到运动状态,降低运动损伤的风险。运动强度为身体微出汗为宜,持续 5~10min。
1.2.2.2 运动训练期 包括有氧运动和抗阻运动,以提高患者的心肺功能和运动能力。①有氧运动主要为踏车、步行。以 AT时的功率作为踏车功率,采用 50%的 peak METs制定步行速度,患者可先通过 3~5次的适应性训练,逐步适应目标强度,同时结合 Borg评分法(RPE:11~13分)和心率储备法(设定运动强度在50%~80%,要求患者在运动中达到目标心率)。然后在运动训练的过程中,随着患者体能改善,结合患者的心率水平和 Borg评分,逐步调整运动强度,每次的运动强度在以往基础上增加5%,最高至80%。BMI≥24.0kg/m2者,训练时间为50min,踏车、步行各25min,5次/周;BMI<24.0kg/m2者,踏车或步行根据各自爱好任选一种,训练时间为 30min,3次/周。②抗阻运动。通过调节弹力带的长度来调整运动时的阻力大小。参考湘雅医院第二套站立位《弹力带强心复健操》。要求患者训练时的RPE为11~13分。主要包括核心肌群、上下肢肌群等交替训练;1组训练包括8~10种抗阻运动,每个动作重复10~15次,每次2~3组,组间休息2~3min,2次/周。
1.2.2.3 运动恢复期 ①柔韧性训练:静力拉伸法,拉伸上下肢及躯干各部位的肌肉和韧带。每部位6~15s,逐渐增至30~90s,运动期间正常呼吸。运动强度以有牵拉感但未感觉到疼痛为宜,每个动作重复3~5次。此外,对于 FMS发现的异常情况,进行针对性加强训练,如加强“4字”牵伸训练、弓步训练等以提高髋部柔韧性,降低潜在的运动损伤风险。②平衡训练:单肢负重,尽可能保持 1min,单腿赤足站立,非支撑侧足抬高离地 20cm,双上肢自然下垂于躯干两侧或非支撑手也可握住非支撑足站立,双下肢交替进行训练。运动5~10min。患者病情越重,放松训练所需时间越长。
1.2.3 运动监护及注意事项 根据患者的运动危险分层,采用远程心电运动监护仪 (美国 Welch Allyn公司 )或指夹式脉搏血氧仪 (江苏鱼跃医疗设备公司 )实时监测心电图、血氧饱和度变化。同时询问患者在训练过程中有无胸闷、心慌及呼吸困难等症状,若有任何不适,立即终止运动。在36次运动训练结束后 (约8~12周)复测患者体适能指标。
1.3 统计学方法数据采用SPSS 22.0进行处理,符合正态分布的计量资料以均数±标准差(±s)表示,组间数据比较采用两独立样本t检验,组内训练前后数据比较采用配对样本t检验;不符合正态分布的计量资料以中位数 (四分位间距 )[M(QR)]表示,组间比较采用 Mann-Whitney U检验,组内比较采用 Wilcoxon符号秩检验。以α=0.05为检验水准,P<0.05为差异有统计学意义。
2 结果
2.1 一般资料研究过程中,观察组脱落2例,因在训练期间主动要求终止训练;对照组脱落3例,因依从性差,未参加再次评估。最终纳入患者 41例,观察组 21例,对照组20例。两组患者的性别、年龄、病程、合并症、心肌梗死类型等一般资料比较差异均无统计学意义(P>0.05),见表1。
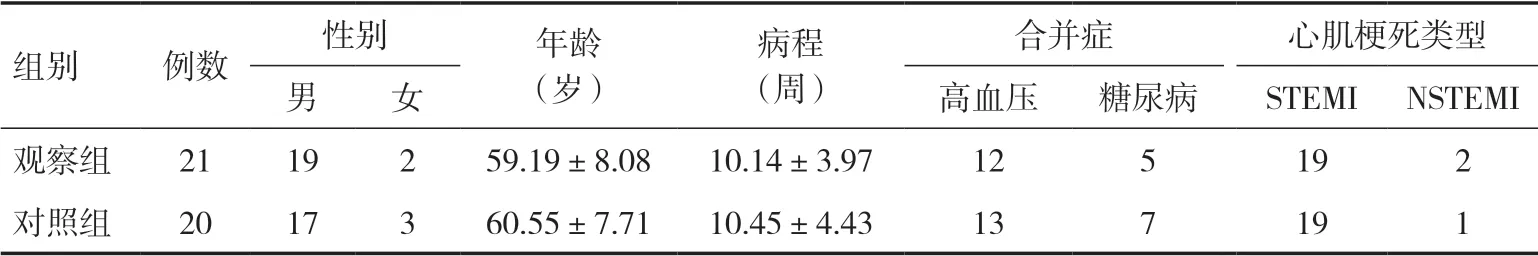
表1 两组患者一般资料比较(例)
2.2.1.2 两组患者运动训练干预前后运动能力指标比较 干预后,观察组患者 peak VO2、peak METs、peak work较干预前上升,差异有统计学意义(P<0.05);与对照组相比,干预后,观察组患者 peak VO2、peak METs、peak work高于对照组,差异有统计学意义(P<0.05),见表3。
表3 两组患者运动训练干预前后运动能力指标比较 (±s)

表3 两组患者运动训练干预前后运动能力指标比较 (±s)
注:与干预前比较,aP<0.05;与对照组比较,bP<0.05
组别例数peak VO2(ml·kg-1·min-1)peak METs(METs)peak work(W)观察组干预前 21 15.78±2.51 4.50±0.73 95.81±14.72干预后 21 20.08±3.34ab 5.72±0.97ab105.57±19.29ab对照组干预前 20 16.20±2.12 4.63±0.61 94.95±12.05干预后 20 16.93±2.03 4.82±0.58 97.45±10.52
2.2.2 两组患者运动训练干预前后 FMS结果比较干预后,观察组患者 FMS各项得分(过顶深蹲、跨栏步、直线弓步蹲、肩部灵活性、直腿主动上抬、躯干稳定俯卧撑、旋转稳定性)及总分较干预前上升,差异有统计学意义(P<0.05);与对照组相比,干预后,观察组患者 FMS高于对照组,差异有统计学意义(P<0.05),见表4。

表4 两组患者运动训练干预前后FMS 结果比较[M(QR),分]
2.2.3 两组患者运动训练干预前后身体成分比较干预后,观察组患者 BMI较干预前下降,差异有统计学意义(P<0.05);与对照组相比,干预后,观察组患者BMI低于对照组,差异有统计学意义(P<0.05),见表5。
表5 两组患者运动训练干预前后 BMI比较(±s,kg/m2)

表5 两组患者运动训练干预前后 BMI比较(±s,kg/m2)
注:与干预前比较,aP<0.05;与对照组比较,bP<0.05
组别例数干预前干预后观察组 21 24.65±3.07 23.19±1.54ab对照组 20 24.14±2.53 24.21±2.47
2.2 体适能比较
2.2.1 CPET结果比较
2.2.1.1 两组患者运动训练干预前后心肺功能指标比较 干预后,观察组患者AT、peak VO2/HR、ΔVO2/ΔWR、HRR1、peak RPP、peak VE较干预前上升,VE/VCO2slope较干预前下降,差异有统计学意义(P<0.05);与对照组相比,干预后,观察组患者AT、peak VO2/HR、ΔVO2/ΔWR、HRR1、peak RPP、peak VE高于对照组,VE/VCO2slope低于对照组,差异有统计学意义 (P<0.05),见表2。
表2 两组患者运动训练干预前后心肺功能指标比较 (±s)
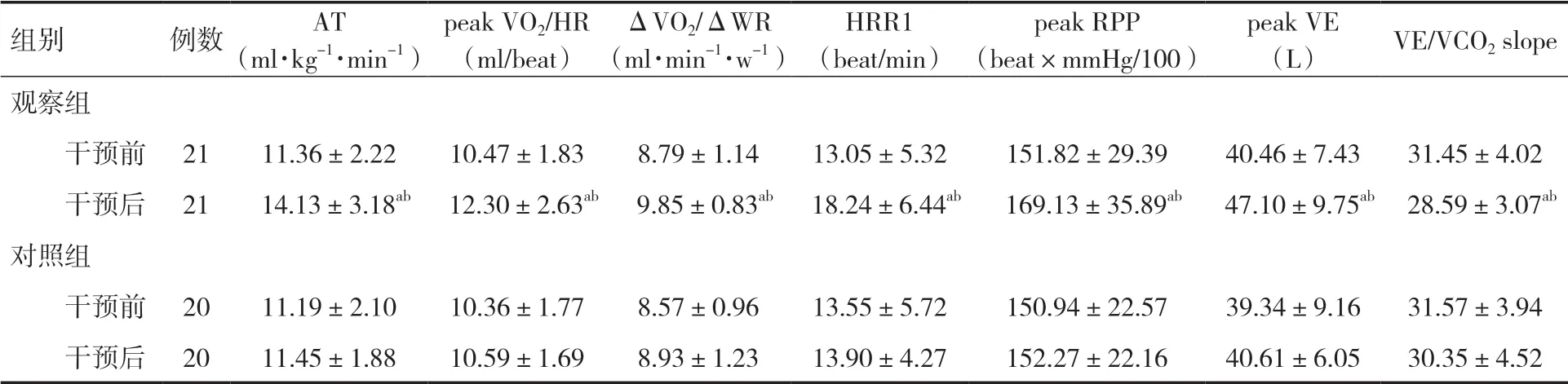
表2 两组患者运动训练干预前后心肺功能指标比较 (±s)
注:与干预前比较,aP<0.05;与对照组比较,bP<0.05
组别例数AT(ml·kg-1·min-1)peak VO2/HR(ml/beat)ΔVO2/ΔWR(ml·min-1·w-1)HRR1(beat/min)peak RPP(beat×mmHg/100)peak VE(L) VE/VCO2 slope观察组干预前 21 11.36±2.22 10.47±1.83 8.79±1.14 13.05±5.32 151.82±29.39 40.46±7.43 31.45±4.02干预后 21 14.13±3.18ab 12.30±2.63ab 9.85±0.83ab 18.24±6.44ab 169.13±35.89ab 47.10±9.75ab 28.59±3.07ab对照组干预前 20 11.19±2.10 10.36±1.77 8.57±0.96 13.55±5.72 150.94±22.57 39.34±9.16 31.57±3.94干预后 20 11.45±1.88 10.59±1.69 8.93±1.23 13.90±4.27 152.27±22.16 40.61±6.05 30.35±4.52
3 讨论
AMI是冠心病最严重且常见的类型之一,PCI术是 AMI患者首选的治疗方法,可有效降低死亡率。但心肌在缺血缺氧后往往发生不可逆性的损伤,给患者生活质量造成严重影响。研究发现, PCI术后个体化的康复训练对提高冠心病患者的心肺功能和运动能力、改善预后具有临床意义[13]。CPET作为一种无创、定量、客观的检测方法,可全面精确评估机体的心肺代谢一体化联合调控反应[14,15],不仅为 AMI患者心肺功能及整体功能状态的评估提供客观、精确的指标,也为个体化运动处方的制定提供了参考依据。本研究联合 CPET和 FMS来评估 AMI (PCI术后 )患者的功能状态水平,并根据评估结果制定个体化的运动训练处方,探讨运动训练对 AMI患者体适能的改善作用以及 FMS在运动训练中的有效性及使用价值。
3.1 心肺功能与吸烟、肥胖、高血压等传统的危险因素相比,低心肺功能已被认为是心血管疾病死亡率和全因死亡率的独立危险因素[16]。本研究中,观察组患者心肺功能指标均明显改善(P<0.05),而对照组心肺功能相关指标均无显著性变化(P>0.05),由此可知,与单纯的药物治疗相比,个体化运动训练对改善AMI(PCI术后)患者的心肺功能状态有效,究其原因主要得益于科学规范的运动处方、严密的运动监护及运动安全性的把控,从而提高了患者运动训练的积极性及依从性,进一步达到良好的康复效果。
Kong等[17]对已行 PCI治疗的 AMI患者进行 8周的有氧运动训练,发现运动训练可明显提高患者的AT、peak VO2/HR、peak RPP、peak VE(P<0.05),本研究中个体化运动训练对上述指标的改善结果与此一致。本研究同样发现个体化运动训练能显著改善观察组患者 AT、peak VO2/HR、ΔVO2/ΔWR、VE/VCO2slope等指标,且较对照组改善明显,差异具有统计学意义 (P<0.05)。Elshazly等[18]曾用 HRR1来评价运动训练(步行、静力拉伸训练等 )对 AMI患者心脏自主神经系统功能的改善作用,发现运动干预后患者的 HRR1显著提高,认为运动训练可维持交感神经与副交感神经的平衡,本研究中个体化运动训练对 HRR1的改善结果与此一致。综上所述,可进一步认为个体化运动训练可有效改善 AMI (PCI术后 )患者的心肺功能。
3.2 运动能力由表3可知,个体化的运动训练可以提高观察组患者的 peak VO2、peak METs、peak work,且结果较对照组均有改善,差异有统计学意义(P<0.05)。Andjic等[19]对PCI术后的AMI患者行短期综合康复训练,发现心脏康复可有效提高患者运动能力,说明个体化运动训练对改善AMI (PCI术后)患者的有氧运动能力具有积极作用。
研究表明, FMS简便、实用、可操作性强,为运动能力的评估提供了具体、量化的指标[20]。本研究经过 36次的个体化运动训练,观察组患者的FMS总分明显提高,且较对照组有改善,差异有统计学意义(P<0.05),这与 Kiesel等[21]的研究结果一致。本研究发现,运动训练后观察组患者的 FMS各分项得分较训练前有改善 (P<0.05),且较对照组改善明显。一方面可能是因为我们创新性地将基于 FMS评估结果的柔韧及平衡训练融入了本套运动干预程序,另一方面可能是因为经过运动干预后患者的下肢肌力、肌耐力及整体功能状态较前增强,因此可认为,本套运动训练程序可有效改善 AMI(PCI术后)患者的运动能力、柔韧性及平衡稳定性。
本研究中,个体化的运动训练后,患者的 peak VO2、peak METs、peak work及 FMS总分均较干预前提高,且既往相关研究已经证实 FMS在骨关节疾病等伤病患者、运动员等运动能力评估中的有效性。因此将 FMS用于 AMI(PCI术后)患者运动能力的评估是可行的。
3.3 身体成分本研究发现观察组患者的 BMI有所下降,且较对照组改善明显(P<0.05),提示运动训练可以改善患者的BMI。孙佩伟等[22]关于运动训练对老年冠心病患者危险因素影响的随访研究中亦有相同表现。因此,可认为个体化运动训练可降低 AMI(PCI术后)患者体重,改善患者 BMI和身体成分。
3.4 运动的安全性一项关于心脏康复的调查研究显示,心脏康复中威胁生命安全的不良事件的发生率为 3.13%,由此得出心脏康复训练是安全的[23]。本研究中,观察组有 1例患者在运动训练期间出现头晕、心悸症状,心电监护未见明显异常变化,嘱其立即停止运动,经休息后症状缓解并继续参与运动训练,其后未再出现类似情况。其余患者在干预期间未发生严重心血管不良事件。
3.5 本研究的创新与不足之处本研究首次探索性地将 CPET与 FMS相结合应用于 AMI (PCI术后 )患者的运动康复领域,以保证运动康复的安全性。以往, FMS多用于竞技体育及运动健身领域,其在AMI (PCI术后 )患者康复训练中的应用尚空缺。根据患者 CPET与 FMS评估结果,制定个体化的运动处方,可全面改善患者的体适能水平。
本研究的样本量少,探索性地将 FMS应用于AMI (PCI术后 )患者体适能评估及康复疗效评价之中,未来尚需开展大规模的研究来进一步证实其在冠心病康复领域的可行性及有效性。

