气相色谱-串联质谱法测定电子烟烟液中的10种生物碱含量
严 俊,王红娟,陈志燕,陈 欢,周 芸,罗彦波,范 忠,付亚宁,邓宾玲,刘 彤,韦入丹,黄世杰,韩书磊*
(1.广西中烟工业有限责任公司,广西 南宁 530001;2.国家烟草质量监督检验中心,河南 郑州 450001)
电子烟通过内置雾化器将烟液雾化供人吸食,一般由雾化器、电池、烟液、传感器等部分组成[1-3]。电子烟烟液一般含有雾化剂(如1,2-丙二醇、丙三醇)、各种调味添加剂、烟碱(尼古丁)等[4-7]。烟碱是电子烟烟液的重要物质和标签,含量一般为0~36 mg/g[4,8],是人们消费电子烟的重要原因之一,国外多个电子烟法规或标准均限定了电子烟烟液中的烟碱含量[9-12]。电子烟烟液中的烟碱一般来源于烟草提取,而降烟碱、假木贼碱、新烟草碱、麦斯明、β-二烯烟碱、可替宁、2,3’-联吡啶等是烟草中的主要次要生物碱,均与烟碱具有类似的结构和化学特性,在烟碱的提取和纯化过程中往往难以完全去除,是影响烟碱感官及生理效应的重要因素,并可能作为判别烟碱来源的“指纹图谱”[7-8]。因此,电子烟烟液中生物碱的检测具有重要意义。
目前,电子烟烟液中生物碱的分析报道相对较少,测定方法主要有气相色谱法(GC/FID)[4,13]、气相色谱-质谱法(GC-MS)[14]、液相色谱法(HPLC/UV)[7,15]、液相色谱-串联质谱法(HPLC-MS/MS)[16]等。由于电子烟烟液基质复杂,可能含有多种添加剂和香味物质[17],GC/FID和HPLC/UV仅使用保留时间定性,易出现假阳性结果,GC-MS虽快速、灵敏度高,但其抗基质干扰能力有限,而HPLC-MS/MS仪器昂贵,普及率相对较低。基于此,本文建立了一种液-液萃取/气相色谱-串联质谱法(LLE/GC-MS/MS)测定电子烟烟液中10种生物碱含量的分析方法,方法具有分析速度快、灵敏度高、选择性好等优点。
1 实验部分
1.1 仪器与试剂
气相色谱-三重四极杆质谱联用仪(2010-plus气相色谱仪,配TQ 8030三重四极杆质谱仪,日本岛津公司);AE163电子天平(感量:0.000 1 g,瑞士Mettler公司);Talboys数显型多管式旋涡混合器;电子烟烟液为市售样品。
降烟碱(纯度98%,美国Alfa Aesar公司);烟碱、N-甲基假木贼碱、麦斯明、假木贼碱、β-二烯烟碱、新烟草碱、2,3’-联吡啶、β-二烯降烟碱、可替宁(纯度>97%,加拿大Toronto Research Chemicals公司);内标物:喹啉(纯度98%,美国Alfa Aesar公司),降烟碱-2,4,5,6-D4(降烟碱-D4,纯度98%,加拿大CDN Isotopes公司),2,2’-联吡啶-D8(纯度98%,加拿大CDN Isotopes);甲醇、正己烷、甲基叔丁基醚、乙酸乙酯、二氯甲烷、三氯甲烷(色谱纯,韩国Duksan公司);氢氧化钠、无水硫酸镁(分析纯,国药集团化学试剂有限公司)。实验用水为Milli-Q系统(Milford,MA,USA)制备的超纯水。
1.2 标准工作溶液配制
内标储备液的配制:用甲醇配制喹啉、降烟碱-D4、2,2’-联吡啶-D8质量浓度分别为50、1.0、1.0 mg/mL的内标储备液。
标准储备液的配制:用甲醇分别配制烟碱、降烟碱和其他8种次要生物碱质量浓度分别为50、2.0、2.0 mg/mL的标准储备液。
标准工作溶液的配制:用二氯甲烷将标准储备液逐级稀释,配制烟碱质量浓度分别为0.025、0.05、0.10、0.50、1.0 mg/mL的标准工作溶液,内标(喹啉)质量浓度为0.25 mg/mL,配制其他9种次要生物碱质量浓度分别为0.002 5、0.01、0.05、0.25、1.0、5.0、20.0μg/mL的标准工作溶液,内标(降烟碱-D4和2,2’-联吡啶-D8)质量浓度为5.0μg/mL,其中,喹啉为烟碱内标,降烟碱-D4为降烟碱内标,2,2’-联吡啶-D8为其他8种次要生物碱内标。
1.3 样品前处理
准确称取0.3 g电子烟烟液样品于15 mL塑料离心管中,再分别加入50μL内标溶液和2.0 mL 2%NaOH水溶液,混匀静置10 min后,加入10 mL二氯甲烷-甲醇溶液(体积比4∶1),加盖密封后置于涡旋振荡器中以2 000 r/min涡旋振荡提取30 min。室温静置1 h后,取下层有机相以无水硫酸镁干燥除水,转移至色谱分析瓶中,待GC-MS/MS分析。
1.4 色谱-质谱条件
1.4.1 色谱条件 DB-35MS毛细管色谱柱(30 m×0.25 mm×0.25μm);进样口温度:250℃;进样量:1μL;载气:氦气(纯度≥99.999%),恒流模式,流速:1.0 mL/min;升温程序:初始温度80℃,保持1 min,以20℃/min升至200℃,再以50℃/min升至300℃,保持5 min;烟碱和9种次要生物碱采用两次进样,其中,烟碱分流比为100∶1,9种次要生物碱分流比为10∶1,烟碱溶剂延迟为5 min,其他次要生物碱溶剂延迟为7 min。
1.4.2 质谱条件 电离方式:电子轰击源(EI);电离能量:70 eV;传输线温度:280℃;离子源温度:250℃;碰撞气:氩气,碰撞气压力200 kPa;质谱扫描方式:多反应监测模式(MRM),监测参数见表1。
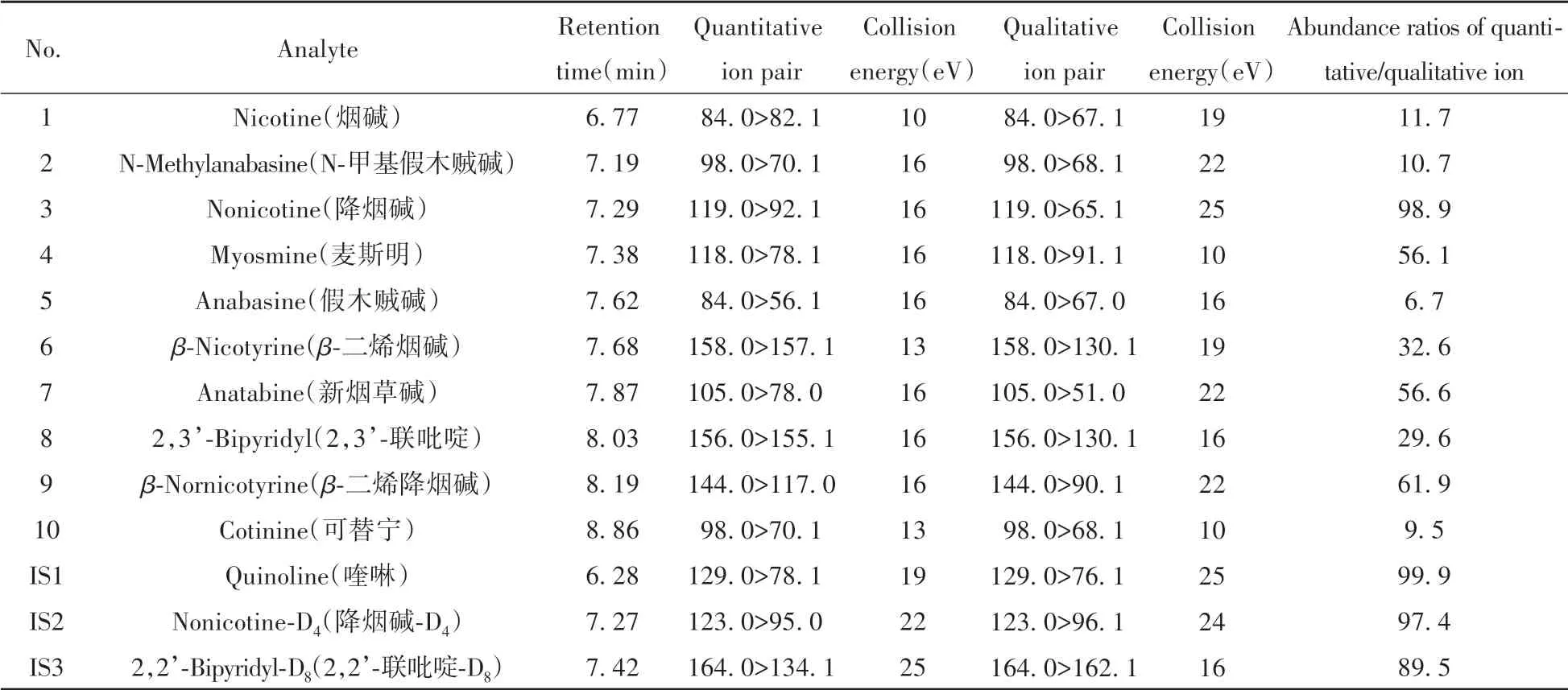
表1 目标物和内标的保留时间和MRM参数Table 1 Retention time and parameters of MRM mode for target analytes and intemal standards
2 结果与讨论
2.1 色谱-质谱条件优化
采用中等极性的DB-35MS毛细管色谱柱为分析柱,在全扫描(Full scan)模式下,通过优化升温程序,在15 min内实现了10种目标物和3种内标物的基线分离,并通过单标溶液对目标化合物进行确认。将一定质量浓度的混合标准工作溶液进行一级质谱全扫描,选择特征明显、质量数高、重现性好的离子作为目标物和内标物的母离子,然后采用产物离子扫描模式优化碰撞能量及产物子离子,对每组母离子/子离子分别选择碰撞能量为1~50 eV进行扫描,间隔3 eV,选择离子对响应最强的碰撞能量,最终确定目标物和内标物的母离子、子离子、碰撞能量、定量/定性离子丰度比等参数,并以丰度最高的子离子进行定量分析,丰度次高的离子对进行定性分析,目标物和内标的MRM参数优化结果如表1所示,优化条件下10种目标物和3种内标物的色谱图见图1。
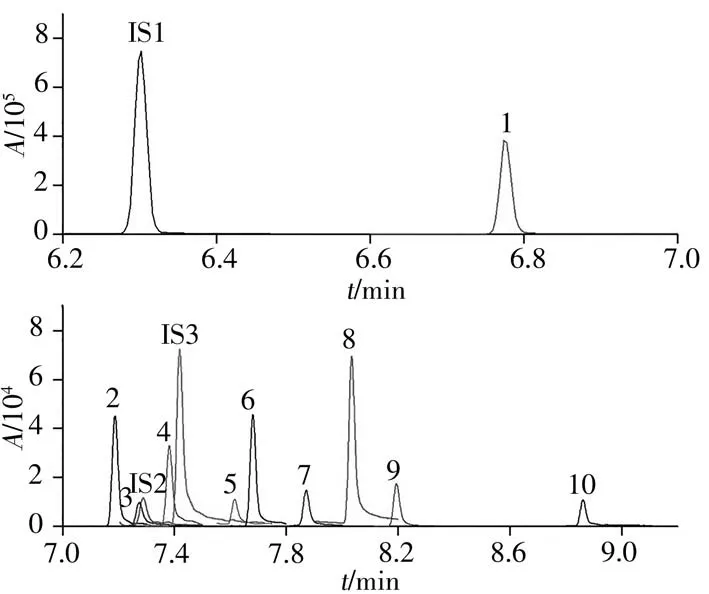
图1 多反应监测模式下标准工作溶液中目标物色谱图Fig.1 Chromatograms of target analytes in standard solution under multiple monitor mode(MRM)the peak numbers(1-10 and IS)were the same as those in Table 1
2.2 萃取溶剂的选择
电子烟烟液一般为弱酸性或弱碱性[18],生物碱是一种含氮杂环有机碱性物质,在酸性条件下具有水溶性,而在碱性条件下为脂溶性,因此,气相色谱分析时需加入适量碱性水溶液将生物碱游离出来,再加入有机溶剂进行液-液萃取。以加入有生物碱混合标准溶液的1,2-丙二醇和丙三醇混合溶剂(质量比为1∶1)为研究对象,参考文献报道的常用生物碱萃取溶剂[19-22],比较了正己烷、甲基叔丁基醚、乙酸乙酯、二氯甲烷、三氯甲烷5种溶剂的萃取效率。结果发现,正己烷对大部分次要生物碱的萃取效率均较低,甲基叔丁基醚对β-二烯烟碱及可替宁的萃取效率较低,乙酸乙酯对可替宁的萃取效率不高,三氯甲烷对降烟碱、假木贼碱及新烟草碱的萃取效率均很低,可能是目标化合物发生了分解或反应生成其他物质,二氯甲烷对所有目标化合物的综合萃取效率最高(92.0%~100%)。根据文献报道[22-23],由于甲醇在水及二氯甲烷中均具有一定溶解度,向二氯甲烷中加入适量甲醇可提高对生物碱的萃取效率,因此比较了不同比例二氯甲烷-甲醇(体积比1∶0、5∶1、4∶1、3∶1、2∶1)对生物碱萃取效率的影响,发现当加入甲醇后,二氯甲烷的萃取效率略有提高,当二氯甲烷与甲醇体积比为4∶1时对生物碱的综合萃取效率最高(96.9%~100%),所以最终选择二氯甲烷-甲醇(体积比4∶1)为萃取溶剂。
2.3 NaOH含量的选择
由于需加入一定量碱性溶剂才能够将电子烟烟液中结合态的生物碱游离出来,从而提高萃取效率,已有文献报道烟草及卷烟主流烟气中生物碱测定多采用1%~8%的氢氧化钠(NaOH)溶液[20,23-25]。因此实验考察了添加2.0 mL不同含量(0.5%、1%、2%、5%、10%)NaOH对回收率的影响。结果显示,不同含量NaOH溶液对回收率(82.3%~100%)的影响不明显,2%~10%的NaOH萃取效率略高于0.5%和1%,因此最终选择2%的NaOH溶液(回收率为91.0%~98.7%),既可满足回收率的要求,又可避免高浓度NaOH可能导致的乳化现象。
2.4 提取方式及萃取时间的选择
实验考察了超声提取、机械振荡、涡旋振荡3种提取方式对回收率的影响。结果发现,超声振荡的效果略差,而机械振荡提取和涡旋振荡提取的回收率差异不明显,考虑到前处理过程的便捷性,最终选择涡旋振荡提取,并对涡旋振荡时间(10、20、30、40、50、60 min)进行了考察,发现涡旋30 min后目标物已基本萃取完全,因此最终选择涡旋振荡萃取30 min。
2.5 目标物在萃取溶液中的稳定性
萃取溶液中的生物碱可能在光、热等作用下发生氧化反应而影响测试结果的准确性[26]。为考察目标物在萃取溶液中的稳定性,将萃取溶液装入色谱瓶中,考察在室温(约20℃)下放置(0~120 h)对测定结果的影响。结果发现,随着放置时间的延长,萃取溶液中的目标化合物含量未发生明显变化,表明目标化合物在萃取溶液中具有较好的稳定性。
2.6 GC-MS/MS与GC-MS方法的比较
电子烟烟液可能存在数百种添加剂和香味物质,这些物质可能对次要生物碱等痕量化合物的测定造成干扰[27]。相比GC-MS,GC-MS/MS仪器价格相对较高,普及率相对较低,但测定准确性更好。因此,在相同样品前处理条件下,对比了GC-MS/MS与GC-MS两种仪器分析方法的测试结果。结果显示:①两种方法测试结果的相对标准偏差不高于12%(表2),表明两种方法的一致性良好;②GCMS在分析部分水果口味样品时部分次要生物碱(如假木贼碱)和内标(降烟碱-D4)均存在明显的基质干扰现象,严重影响了目标物的定性定量分析,而GC-MS/MS因采用二级离子定性定量,解决了杂质碎片离子的干扰问题,提高了分析的准确性;③在灵敏度方面,与GC-MS相比,除个别目标物外(如降烟碱、假木贼碱),GC-MS/MS方法的检出限均低于或显著低于GC-MS(表2),显示了更高的灵敏度。综上所述,与GC-MS相比,GC-MS/MS更适合电子烟烟液中生物碱的测定。
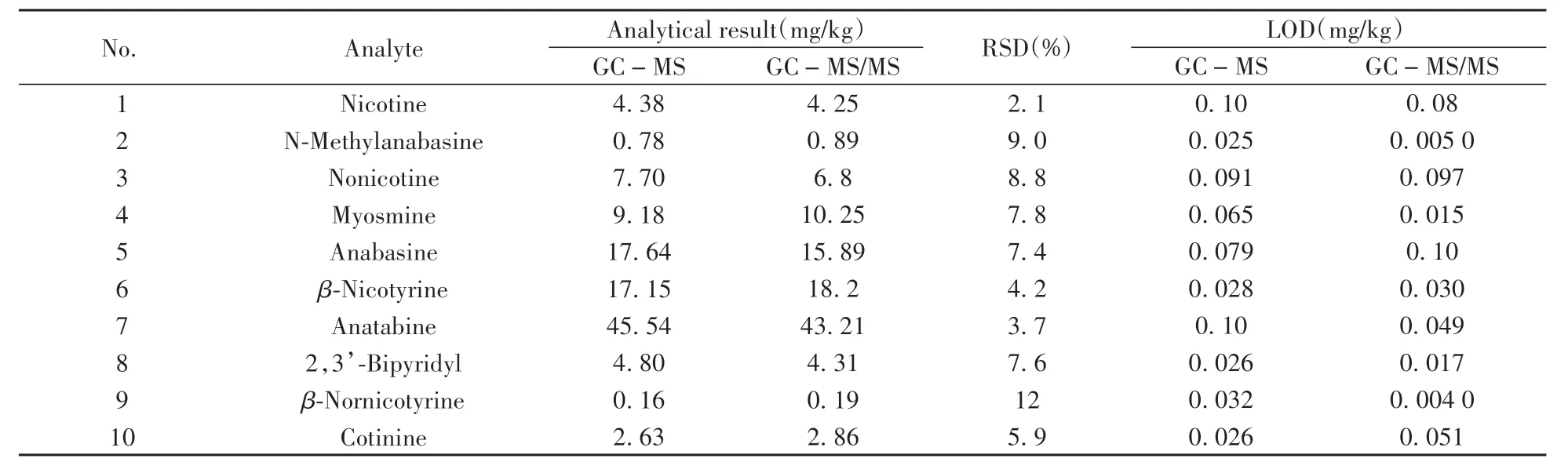
表2 GC-MS/MS与GC-MS方法的比较Table 2 Comparison of GC-MS/MS and GC-MS
2.7 方法学评价
在优化条件下,对10种目标物的系列标准工作溶液进行分析,内标法定量,以各目标物与内标物定量离子峰面积的比值(y)为纵坐标,对应目标物质量浓度(x)为横坐标,绘制标准曲线。并取阴性空白样品为基质进行低、中、高3个水平的加标回收实验,每个加标水平重复测定5次,以3倍信噪比(S/N=3)计算方法的检出限。结果显示:烟碱及9种次要生物碱分别在25~1 000μg/mL及0.002 5~20μg/mL范围内呈良好的线性,相关系数(r2)不低于0.997 1,检出限(LOD)为0.0040~0.10 mg/kg,定量下限(LOQ,S/N=10)为0.013~0.33 mg/kg,10种化合物在3个加标水平下的回收率为87.9%~109%,日内及日间相对标准偏差(RSD)分别不大于6.8%和7.9%。
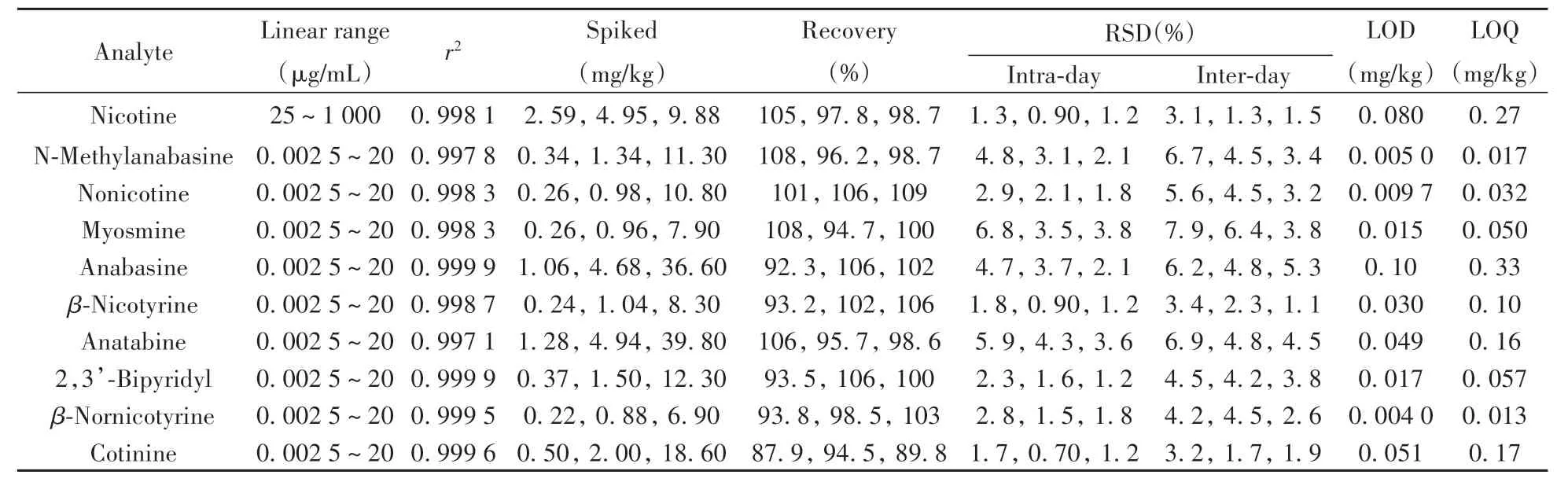
表3 10种生物碱的线性范围、相关系数、回收率、精密度、检出限及定量下限Table 3 Linear ranges,correlation coeffinients(r2),spiked recoveries,RSDs,LODs and LOQs of target analytes
2.8 实际样品分析
利用本方法对23种品牌共计171种型号电子烟烟液中的10种生物碱进行了测定(典型样品色谱图如图2所示)。结果显示,电子烟烟液中烟碱含量为2.16~23.73 mg/g,与文献报道的范围相一致[4,7]。电子烟烟液中9种次要生物碱的检出率为64.91%~99.42%,含量中位值为0.06~7.35 mg/kg,远低于传统烟草[21],这是由于电子烟烟液中的烟碱来源于烟草,在提取和纯化过程中次要生物碱会被逐级去除。此外,有9种电子烟烟液样品的总次要生物碱含量与烟碱含量比例大于1.0%,最高可达4.3%,超出了美国等国家或地区对药典级烟碱纯度的限量要求(1.0%)[12],表明应对电子烟烟液中烟碱纯度作进一步规范。
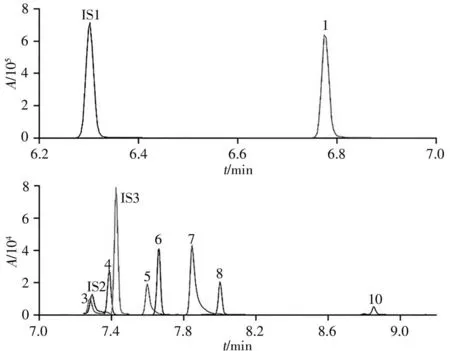
图2 多反应监测模式下样品溶液中目标物色谱图Fig.2 Chromatograms of target analytes in sample solution under multiple monitor mode(MRM)the peak number(1-10 and IS)as those in Table 1
3 结 论
本研究通过优化色谱-质谱条件及样品前处理条件,以2%NaOH溶液为碱性溶液,以10 mL二氯甲烷-甲醇溶液(体积比4∶1)为萃取溶液,建立了一种液-液萃取/气相色谱-串联质谱法测定电子烟烟液中的10种生物碱含量的分析方法,方法灵敏度高,抗干扰能力强,适合电子烟烟液样品中10种生物碱含量的测定。

