基于fl-TiO2/Pt NPs/RuSi NPs的去氧肾上腺素电化学发光传感器的构建和应用
韦富存,欧盼盼,吴叶宇,吴佳雯,林 瑜,杜方凯,谭学才
(广西民族大学 化学化工学院,林产化学与工程国家民委重点实验室,广西林产化学与工程重点实验室,广西林产化学与工程协同创新中心,广西高校食品安全与药物分析化学重点实验室,广西 南宁 530008)
去氧肾上腺素(PHE)是一种重要的拟肾上腺素药物,具有收缩血管并增加血压的效果[1],在医学中通常用作血管加压药物,用于治疗休克和维持麻醉状态下血压的稳定,也用于缓解法洛四联症和阵发性室上性心动过速的发作[2]。医学研究表明,PHE的过量使用易导致人体出现胸痛、呼吸困难、心率异常、震颤或昏厥,甚至危及生命等不良反应[3]。因此,对此类药物进行严格的质量检测在临床治疗和药品质量监控中均具有重大的现实意义。目前,PHE的测定方法主要有高效液相色谱法(HPLC)[4-5]、伏安法(CV)[6]和荧光法(FL)[7-9]。但这些方法的检测时间较长,往往需要复杂的样品前处理,相比之下,电化学发光法(ECL)因操作简单、成本低廉、检测速度快、灵敏度高和仪器简单等优点而备受关注[10]。然而,目前ECL技术在PHE类药物分析中的应用相对较少,因此,开发一种简单、高效和便捷的ECL方法用于检测药物中的PHE具有重要的现实意义。
Ru(bpy)2+3掺杂的二氧化硅纳米粒子(RuSi NPs)作为经典的电化学发光体,在ECL传感器中发挥着重要的作用,然而二氧化硅的导电惰性容易导致RuSi NPs的ECL发光效率降低和灵敏度变差,极大地限制了其在ECL传感器中的应用。目前多种具有大比表面积和良好导电性能的材料已被用于改善RuSi NPs的ECL性能,例如Wang等[11]制备了Ru(bpy)2+3掺杂的Au-SiO2核壳纳米复合材料(Au@SiO2-Ru),并用作ECL传感器的发光体和信号放大元件;张慧等[12]基于3D石墨烯/SiO2@Ru(bpy)2+3复合材料构建了敌草隆的电化学发光传感器;Chen等[13]将羧基化多壁碳纳米管(CMWCNTs)与Ru(bpy)2+3掺杂的二氧化硅纳米球混合制成薄膜,并修饰于玻碳电极的表面,具有优良导电性和大比表面积的CMWCNTs有效提高了复合薄膜的导电性,并显著地提高了Ru(bpy)2+3的ECL信号。然而,目前尚无文献报道关于二氧化钛和RuSi NPs复合物在ECL传感器中的应用。
花状二氧化钛是一种重要的半导体材料,其表面呈现三维的花瓣状结构,因而比其他形貌二氧化钛(如量子点、球状、管状、多孔状等)有着更大的比表面积,而且其表面富含羟基,容易进行功能化修饰,因此受到人们的普遍关注[14]。然而,由于用于合成二氧化钛的钛源试剂(如钛酸四丁酯、四异丙醇钛和四氟化钛等)具有高的反应活性,易在空气中发生水解而导致合成的二氧化钛出现严重团聚的现象,因此极大地限制了其在ECL传感器中的应用。铂纳米粒子(Pt NPs)作为一种重要的催化剂,已被证明是鲁米诺(Luminol)[15]、红荧烯[16-17]、石墨相碳化氮等多种ECL发光试剂的敏化剂。然而由于Pt NPs的颗粒较小,单个Pt NPs的催化作用有限且不稳定,通常需要将其负载于特殊的基底表面以提高其催化活性。
本研究采用溶剂热法制备了一种高度有序的花状分级二氧化钛微/纳米颗粒(fl-TiO2),将其负载于Pt NPs和RuSi NPs,构建了一种基于fl-TiO2/Pt NPs/RuSi NPs的新型固态ECL传感器。Pt NPs优异的电催化活性显著提高了RuSi NPs-三丙胺(TPrA)体系的ECL信号强度,fl-TiO2的巨大比表面积则为Pt NPs和RuSi NPs提供了丰富的结合位点,因此,fl-TiO2/Pt NPs复合物可充当新型的ECL信号放大器,以显著提高RuSi NPs-TPrA体系的ECL发射效率。最后,基于PHE对该传感器的ECL响应信号有强烈的抑制作用,成功地将该传感器用于药物中PHE的检测。
1 实验部分
1.1 仪器与试剂
MPI-EⅡ型电致化学发光检测系统(西安瑞迈分析仪器有限公司);PGSTAT 128N型电化学工作站(瑞士万通中国有限公司);SUPRA 55 Sapphire场发射扫描电子显微镜(德国Carl Zeiss公司);D8 ADVANCE X射线粉末衍射仪(德国布鲁克AXS公司);日立F-4600型荧光分光光度计(日本Hitachi公司);Agilent Cary 60紫外可见分光光度计(美国安捷伦有限公司)。
钛酸四丁酯(TBT)、油酸、曲拉通X-100(TX-100)、六水合氯铂酸、环己烷、3-氨基丙基三乙氧基硅烷(APTES)、正丁醇、硅酸四乙酯(TEOS)、柠檬酸三钠(上海阿拉丁生化科技股份有限公司);三丙胺(TPrA)、浓氨水(25%~28%)、Ru(bpy)3Cl2·6H2O(上海麦克林生化科技有限公司);浓盐酸(36.5%,西陇科学股份有限公司);盐酸去氧肾上腺素(PHE,索莱宝生物科技有限公司);盐酸去氧肾上腺素注射液(1 mL,10 mg,上海禾丰制药有限公司),所用试剂均为分析纯,实验用水为密理博超纯水系统净化的超纯水。
1.2 实验条件
示差脉冲伏安(DPV)、交流阻抗(EIS)和ECL测试均采用三电极体系:fl-TiO2/Pt NPs/RuSi NPs/GCE为工作电极,Ag/AgCl(0.3 mol/L KCl)电极为参比电极,Pt柱电极为辅助电极。DPV测试条件:扫描电位为-0.2~0.6 V,扫描速率为0.1 V/s,电解质溶液为10 mL含有0.1 mol/L KCl和5.0×10-3mol/L K3[Fe(CN)6]的混合溶液。EIS测试条件:频率范围为0.01~100 000 Hz,振幅为0.01 V,测试电位为开路电位,电解质溶液为10 mL含有0.1 mol/L KCl、5.0×10-3mol/L K3[Fe(CN)6]和5.0×10-3mol/L K4[Fe(CN)6]的混合溶液。ECL测试条件:光电倍增管(PMT)的电压为600 V,扫描电位为0~1.25 V,扫描速率为0.2 V/s,电解质溶液为含有2.0×10-3mol/L TPrA的磷酸盐缓冲溶液(PBS,0.1 mol/L)。
1.3 fl-TiO 2/Pt NPs/RuSi NPs复合材料的制备
参照文献制备RuSi NPs[21]:将1.77 mL TX-100、7.5 mL环己烷、1.8 mL正己醇和340μL Ru(bpy)2+3溶液(40×10-3mol/L)混合搅拌0.5 h,然后加入100 mL TEOS和60μL浓氨水,在室温下继续反应24 h,用丙酮破乳沉降,离心收集固体物并依次用无水乙醇和水各洗涤3次,冷冻干燥,得到橙黄色的RuSi NPs。
参照文献制备fl-TiO2[22]:在搅拌下将2 mL浓盐酸、20 mL油酸和4 mL TBT混合均匀后,转移至50 mL Teflon内衬中,在180℃下反应12 h,离心收集产物并用无水乙醇洗涤数次,在60℃下干燥处理,然后在500℃下退火1 h,得到纯白色的fl-TiO2。
Pt NPs的制备方法与文献一致[15]:在剧烈搅拌下,将0.5 mL柠檬酸三钠溶液(3 mol/L)快速注入50 mL沸腾的H2PtCl6溶液(1.0%)中并保持搅拌0.5 h,得到黑褐色的Pt NPs溶液。
fl-TiO2/Pt NPs的制备:在搅拌下将400μL APTES溶液加入2 mL fl-TiO2的无水乙醇分散液(10 mg/mL)中,在室温下反应6 h,离心收集固体物,经无水乙醇洗涤数次,得到氨基功能化的fl-TiO2,然后分散于10 mL Pt NPs溶液中,在室温下搅拌12 h,产物经离心和水洗涤数次后,重新分散于10 mL水中,得到fl-TiO2/Pt NPs的悬浮液。
fl-TiO2/Pt NPs/RuSi NPs的制备:将不同体积(2、4、6、8、10 mL)的fl-TiO2/Pt NPs悬浮液与12 mg RuSi NPs混合均匀,加水定容至10 mL,超声分散均匀后得到fl-TiO2/Pt NPs/RuSi NPs的悬浮溶液。
1.4 传感器的制备
依次用粒径分别为1.0、0.3、0.05μm的α-Al2O3粉末将玻碳电极(GCE)进行抛光处理,然后将4μL的fl-TiO2/Pt NPs/RuSi NPs悬浮液涂覆于GCE的表面,自然晾干后,制成fl-TiO2/Pt NPs/RuSi NPs/GCE传感器。fl-TiO2/Pt NPs/RuSi NPs/GCE传感器的构建过程和检测机理如图1所示。
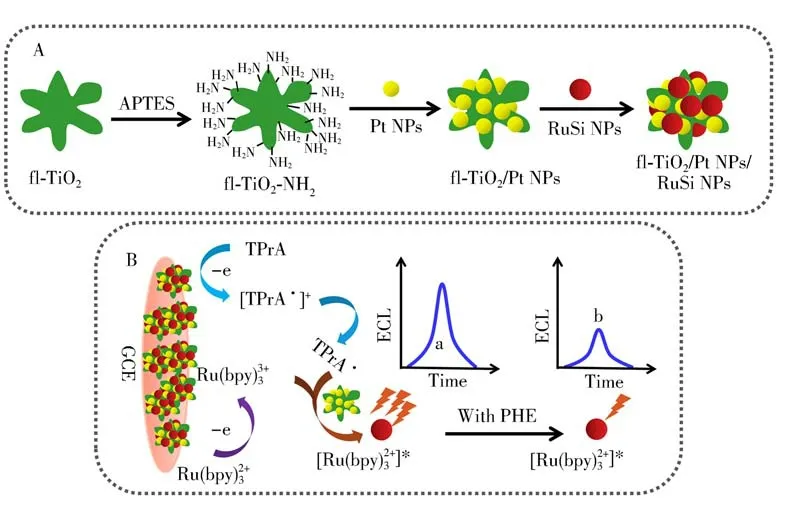
图1 fl-TiO2/Pt NPs/RuSi NPs复合材料的制备过程(A)和传感器的检测机理(B)Fig.1 The preparation process of fl-TiO2/Pt NPs/RuSi NPs(A)and its probable mechanism for PHEdetection(B)
2 结果与讨论
2.1 材料的表征
采用扫描电镜(SEM)分别对fl-TiO2、Pt NPs、fl-TiO2/Pt NPs、RuSi NPs和fl-TiO2/Pt NPs/RuSi NPs共5种合成材料的形貌进行表征。其中,fl-TiO2呈大小均匀、粒径约为5μm的球状颗粒(图2A),其表面是由大量的长方体状晶体由球心向外有序组装而成的花瓣状分级结构(图2B)。fl-TiO2/Pt NPs(图2C)中可明显观察到有大量Pt NPs附于fl-TiO2的表面,结合Pt NPs的SEM图(图2D)可知,Pt NPs与fl-TiO2复合后,原本聚集的Pt NPs均匀地分布在fl-TiO的表面。fl-TiO2/Pt NPs/RuSi NPs(图2E)的表面有大量Pt NPs和球形颗粒填充于fl-TiO2的花状结构中,结合RuSi NPs的SEM图(图2F)可知,这些球形颗粒为RuSi NPs,颗粒大小均匀,直径约为70 nm,初步证明fl-Ti O2/Pt NPs/RuSi NPs已成功制备。

图2 宏观fl-Ti O2(A),微观fl-TiO2(B),fl-TiO2/Pt NPs(C),Pt NPs(D),fl-Ti O2/Pt NPs/RuSi NPs(E)及RuSi NPs(F)的SEM图Fig.2 SEM images of macroscopic fl-TiO2(A),microscopic fl-TiO2(B),fl-TiO2/Pt NPs(C),Pt NPs(D),fl-TiO2/Pt NPs/RuSi NPs(E)and RuSi NPs(F)
图3A展示了RuSi NPs的紫外-可见吸收光谱(曲线a)和荧光光谱(曲线b),可明显观察到RuSi NPs在300 nm和450 nm处分别出现了Ru(bpy)32+的特征吸收峰,其最大荧光发射波长为610 nm,与文献报道基本一致[23],说明成功制备了RuSi NPs。fl-TiO2的XRD图谱(图3B)在2θ为69.9°和36.3°出现的衍射峰分别对应锐钛矿二氧化钛(JCPDS NO.21-1272)的(220)和(103)晶面,在27.6°、39.4°、41.5°、44.2°、54.5°、56.8°、62.9°、64.3°和69.2°出现的衍射峰分别对应金红石相二氧化钛(JCPDS NO.21-1276)的(110)、(200)、(111)、(210)、(211)、(220)、(002)、(310)和(301)晶面,表明fl-TiO2是由锐钛矿相和金红石相组成的混合晶型。fl-Ti O2/Pt NPs/RuSi NPs的EDS图谱(图3C)则表明该材料含有Ti、O、Pt、Ru和Si元素。
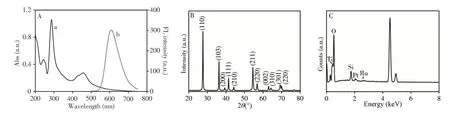
图3 RuSi NPs的紫外-可见吸收光谱及荧光光谱(A),fl-TiO2的XRD图谱(B)及fl-TiO2/Pt NPs/RuSi NPs的EDS图谱(C)Fig.3 UV-Vis absorption spectrum and fluorescence spectrum of RuSi NPs(A),XRD pattern of fl-TiO2(B),and EDS pattern of fl-TiO2/Pt NPs/RuSi NPs(C)
2.2 传感器的电化学行为
采用示差脉冲伏安法(DPV)考察了5.0×10-3mol/L[Fe(CN)6]3-在不同修饰电极上的电化学行为。如图4A所示,裸GCE产生了一个比较强的电流信号(曲线a),这是[Fe(CN)6]3-在电极表面还原为[Fe(CN)6]4-而产生的还原峰电流;当GCE的表面修饰RuSi NPs后产生的电流信号明显减小(曲线b),这是由于导电性较差的SiO2阻碍了GCE表面的电子向扩散层中的[Fe(CN)6]3-发生转移,导致[Fe(CN)6]3-的还原过程受阻;当GCE表面修饰fl-TiO2/RuSi NPs时,响应信号进一步减小(曲线c),这是由RuSi NPs和fl-TiO2对电子传递的阻碍作用所致;fl-TiO2/Pt NPs/RuSi NPs/GCE的电流信号(曲线d)相对于fl-TiO2/RuSi NPs/GCE有所增大,这是因为具有良好导电性和电催化活性的Pt NPs提高了电子在GCE表面的传递效率,从而显著提高了GCE的催化活性。
采用交流阻抗分析(EIS)研究了[Fe(CN)6]3-/4-在不同修饰电极上的电化学行为。如图4B所示,裸GCE的阻抗值较小(Ret=103Ω,曲线a),表明[Fe(CN)6]3-/4-探针在裸GCE表面发生电子转移时受到的阻力较小;RuSi NPs/GCE的阻抗(Ret=815Ω,曲线b)相对于裸GCE明显增大,说明RuSi NPs的导电性较差,对电子的传递有阻碍作用;fl-TiO2/RuSi NPs/GCE的阻抗值(Ret=1 261Ω,曲线c)较RuSi NPs/GCE有所增大,说明fl-TiO2的导电性较差,并降低了电子的转移速率;fl-Ti O2/Pt NPs/RuSi NPs/GCE的阻抗值(Ret=1 125Ω,曲线d)相对于fl-TiO2/RuSi NPs/GCE有所减小,这是因为加入具有良好导电性的Pt NPs改善了RuS NPs/fl-Ti O2的导电性,并加快了[Fe(CN)6]3-/4-在GCE表面的电子转移速率。实验结果与DPV法一致。
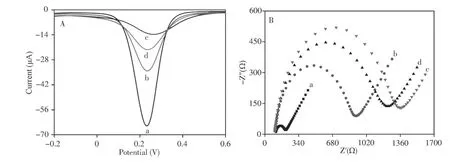
图4 不同修饰电极的DPV响应(A)及EIS图谱(B)Fig.4 DPV curves(A)and the corresponding EIS responses(B)of different electrodes a:bare GCE,b:RuSi NPs/GCE,c:fl-Ti O2/RuSi NPs/GCE,d:fl-TiO2/Pt NPs/RuSi NPs/GCE
2.3 传感器的ECL行为及检测机理
在含有2.0×10-3mol/L TPrA的PBS溶液(0.1 mol/L,pH 8.0)中,考察了5种不同电极的ECL图谱(见图5)。结果显示,裸GCE(曲线a,ECL≈2.0 a.u.)几乎不产生ECL信号,而RuSi NPs/GCE(曲线b,ECL≈9 255 a.u.)、fl-TiO2/RuSi NPs/GCE(曲线c,ECL≈11 510 a.u.)和fl-TiO2/Pt NPs/RuSi NPs/GCE(曲线d,ECL≈16 320 a.u.)电极则随着修饰不同材料后,其ECL响应信号逐渐增大。这是因为具有优异电催化活性的Pt NPs加快了Ru(bpy)-TPrA体系的ECL反应速率(式1~4),而fl-TiO2的丰富分级微/纳米结构则为RuSi NPs和Pt NPs提供了大量的结合位点,并有效缩短了电子在两者之间传递的距离,因此fl-TiO2/Pt NPs复合物可作为RuSi NPs-TPrA体系的ECL信号放大器,三者的结合成功实现了传感器ECL信号的双重放大。当ECL反应体系中含有1.0×10-6mol/L PHE时,fl-TiO2/Pt NPs/RuSi NPs/GCE的ECL响应信号急剧减小(曲线e,ECL≈13 180 a.u.),表明PHE对该传感器的ECL响应信号有显著抑制作用,这可能是因为PHE具有儿茶酚胺结构,容易在阳极被氧化为PHE的氧化物,然后进一步和TPrA•反应,导致TPrA•的数量减少并抑制了RuSi NPs的ECL发射行为。
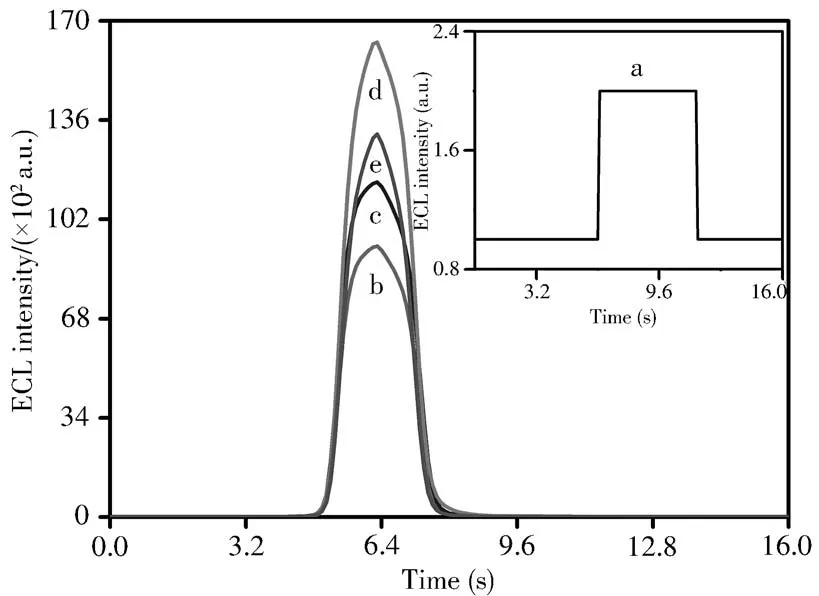
图5 加入1.0×10-6 mol/L PHE前(a~d)后(e),不同电极在2.0×10-3 mol/L TPrA溶液中的ECL图谱Fig.5 ECL curves of different electrodes in 2.0×10-3 mol/L TPrA solution before(a-d)and after(e)adding 1.0×10-6 mol/L PHEa:bare GCE,b:RuSi NPs/GCE,c:fl-TiO2/RuSi NPs/GCE,d:fl-TiO2/Pt NPs/RuSi NPs/GCE,e:fl-TiO2/Pt NPs/RuSi NPs/GCE;0.1 mol/L PBS(pH 8.0)
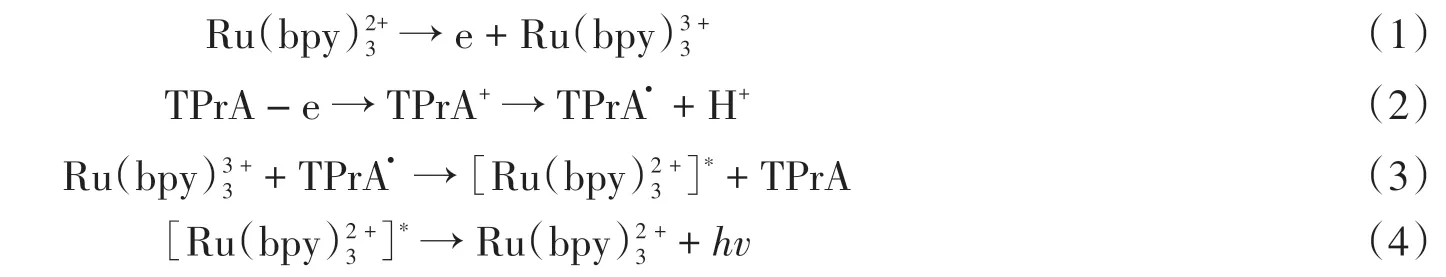
2.4 实验条件的优化
考察了fl-TiO2/Pt NPs/RuSi NPs混合物中fl-TiO2/Pt NPs用量对传感器的影响,如图6A所示,在fl-TiO2/Pt NPs的用量为2~6 mL范围内,传感器的ECL响应信号随着fl-TiO2/Pt NPs用量的增加而增强,当fl-TiO2/Pt NPs的用量继续增加至10 mL时,ECL响应信号则逐渐减小,因此选取6 mL作为fl-TiO2/Pt NPs的最佳用量。fl-TiO2/Pt NPs/RuSi NPs的修饰量对传感器的影响如图6B所示,随着fl-TiO2/Pt NPs/RuSi NPs的修饰量由2μL逐渐增加至4μL时,产生的ECL响应信号逐渐增至最大值,当修饰量继续增大至6μL时,ECL信号则逐渐减弱,这是因为大量的fl-TiO2和RuSi NPs堆积于GCE表面时,易造成电子在电极表面的运动受阻,从而抑制了ECL信号的产生,因此选择fl-TiO2/Pt NPs/RuSi NPs的最佳修饰量为4μL。ECL反应体系pH值对传感器的影响如图6C所示,pH值在6.0~10.0范围内对传感器响应的ECL信号产生显著影响,且当pH 8.0时,传感器的ECL信号最强,因此选取pH 8.0作为ECL反应体系的最佳pH条件。
图6 fl-TiO2/Pt NPs用量(A)、fl-TiO2/Pt NPs/RuSi NPs修饰量(B)及pH值(C)对ECL反应体系的影响Fig.6 Effects of fl-TiO2/Pt NPs amount(A),fl-TiO2/Pt NPs/RuSi NPs modification amount(B)and pH value(C)on ECL reaction system
2.5 工作曲线与检出限
在最佳实验条件下,将传感器用于检测不同浓度的PHE,如图7所示,随着PHE的浓度由0 mol/L逐渐增至8.0×10-5mol/L,传感器的ECL响应信号逐渐减小。在1.0×10-7~8.0×10-5mol/L浓度范围内,ECL响应信号的变化值ΔI(ΔI=I0-IPHE)与PHE浓度的对数(lgCPHE)呈良好的线性关系,线性方程为ΔI(a.u.)=2 652.12lgCPHE(mol/L)+19 008.06,相关系数(r2)为0.998 4,检出限(S/N=3)为2.5×10-8mol/L。与部分文献(表1)报道的PHE检测方法相比,本文所制备的传感器表现出更宽的检测范围和更低的检出限。
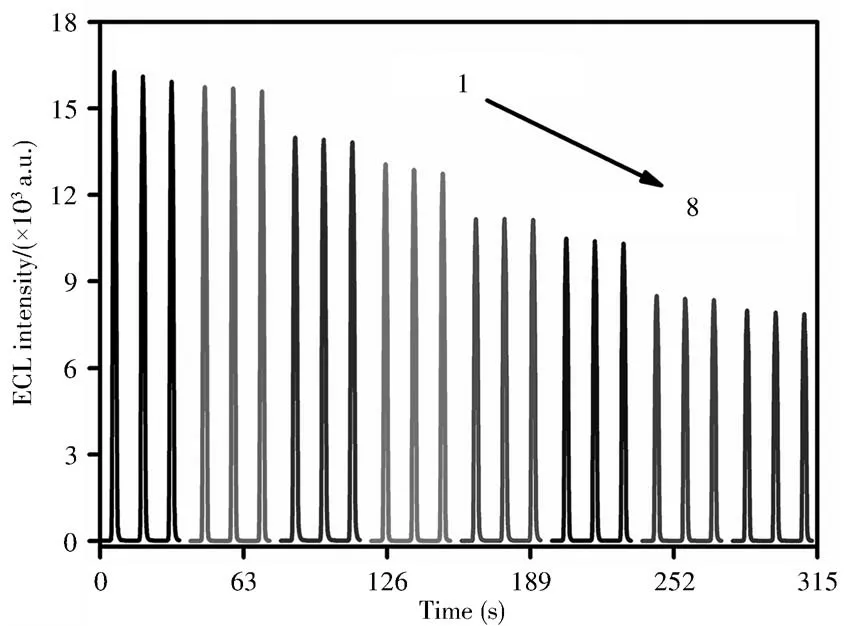
图7 传感器对不同浓度PHE的ECL响应Fig.7 ECL curves of the proposed sensor at different concentrations of PHE concentration of PHE(1-8):0,1.0,5.0,10,50,100,500,800(×10-7 mol/L)
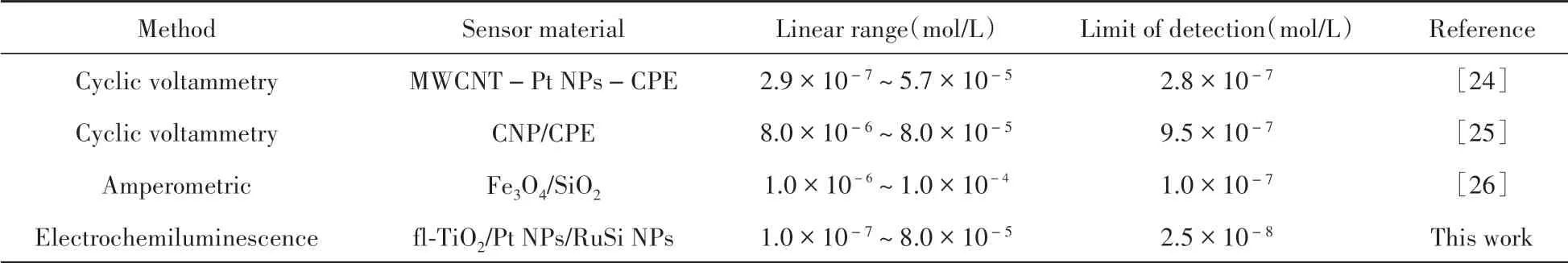
表1 与其他PHE检测方法的对比Table 1 Comparisons of the linear range and detection limit of this work with the other PHE detection methods
2.6 传感器的稳定性、重现性与选择性
考察了单根修饰电极在7天内对1.0×10-6mol/L PHE的检测效果,测得第7天响应的ECL信号仍保持为初始值的96.6%,相对标准偏差(RSD)为1.3%;在相同实验条件下,将平行制备的5根修饰电极用于检测1.0×10-6mol/L PHE,响应信号的RSD为1.0%,表明传感器具有良好的稳定性和重现性。选用几种常见离子、辅料以及具有相似结构的物质作为干扰物,与传感器对1.0×10-6mol/L PHE的检测结果进行对比。结果表明,100倍的Na+、Ca2+、K+、Mg2+、CO2-3、柠檬酸(CA)和葡萄糖(GLU),80倍的对乙酰氨基酚(APAP),45倍的OH-和抗坏血酸(AA),40倍的多巴胺(DA)对PHE的检测结果影响较小(误差在±5%以内),表明传感器具有良好的选择性。
2.7 实际样品的检测
在优化条件下,对PHE注射液中的PHE浓度进行测定,测得其浓度为3.3×10-7mol/L。采用标准加入法对注射液分别进行3个不同浓度水平的加标,测得回收率为99.2%~108%,且RSD均低于5%(见表2)。说明该传感器在实际样品的检测中具有良好的可行性。

表2 盐酸去氧肾上腺素注射液中PHE含量的测定及回收率结果Table 2 Determination of PHE in phenylephrine hydrochloride injection and its recoveried results
3 结 论
本文成功构建了基于fl-Ti O2/Pt NPs/RuSi NPs的新型固态ECL传感器,并用于药物中PHE的检测。fl-TiO2/Pt NPs显著提高了RuSi NPs的ECL发射效率,实验结果表明该传感器具有较宽的检测范围和较低的检出限,并表现出良好的稳定性和重现性。本研究为ECL传感平台的构建提供了一种新的ECL信号放大策略,并拓宽了ECL传感器在药物分析中的应用。

