转基因作物中CaMV 35S序列信号双重放大的电化学基因传感方法
郑海松,谢晶琦,孙娟娟,叶永康,操小栋*
(1.合肥海关技术中心,安徽 合肥 230022;2.合肥工业大学 食品与生物工程学院,安徽 合肥 230009)
转基因作物在全球种植面积逐年增加,越来越多的转基因作物被批准用于食品、饲料和其它工业品(如纺织品、药品及塑料制品等)的加工。同时,转基因产品因对人类或动物可能带来潜在的健康威胁及对环境和生态带来风险而在全球范围内引起广泛的争议。为了应对转基因技术存在的潜在风险,回应公众的关注,保证国际贸易顺利进行,我国2017年最新修订的《农业转基因生物标识管理办法》对目录上所列的转基因生物采取强制标注,以加强对转基因生物的监管,保证消费者的基本权利。其中,转基因成分的检测和识别是其中的重要组成部分[1]。转基因植物中普遍含有外源基因如花椰菜花叶病毒35S(CaMV 35S)启动子、根癌农杆菌终止子(Terminator nopaline synthase,tNOS)或其他特定目标基因序列等。针对这些特定序列,聚合酶链反应(PCR)方法具有高灵敏度和高稳定性,是转基因生物检测的首选方法[2],但该方法较为复杂,检测成本偏高和耗时长[3]。其他常用方法有酶联免疫吸附测定[4]、新一代测序[5]、基因芯片[6]和电化学分析[7]等。其中,电化学基因传感器因其成本低廉,配套仪器易于小型化、微型化,是快速检测转基因生物较为理想的选择。
为提高灵敏度和选择性,电化学传感器表面修饰的纳米材料如非金属纳米材料[8-10]和金属/金属氧化物纳米材料[11-13],因其比表面积大、电子传输效率高而受到青睐。其中,石墨烯材料因具有良好的导电性和巨大的比表面积,在电化学传感器中有着广泛的应用前景。为了克服溶剂中石墨烯纳米片层在范德华力作用下重新聚集从而限制了其有效表面积[14],研究人员利用血红素(Hemin)与石墨烯片层通过π-π非共价结合形成具有氧化还原活性兼备石墨烯固有性质的纳米复合材料[15-16]。此外,金属纳米粒子如金纳米粒子(AuNP)因具有较大的比表面积,且可方便地利用Au―S键固定巯基化核酸探针等生物材料[17],常作为信号标签或信号标签载体[18-19]。硫堇(Thi)是电活性小分子,可通过静电吸附在电性相反的AuNP表面[20],从而导致电流响应的显著增大。
本研究首先制备了AuNP/Hemin-rGO修饰玻碳电极,然后通过巯基化捕获序列在修饰电极表面AuNP上自组装后,再与目标序列杂交。随后,以5'-SH标记的第三条辅助序列与目标序列杂交形成“三明治”结构,通过Au―S键共价结合AuNP并预富集Thi以放大电流响应,实现了电化学双重信号放大,以用于转基因植物中CaMV 35S启动子目标序列的超灵敏检测(见图1)。
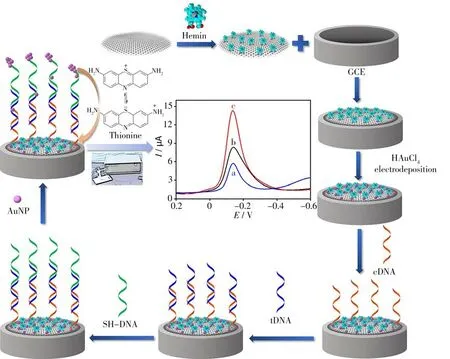
图1 双重放大基因传感器检测转基因CaMV 35S序列的示意图Fig.1 Schematic diagram of duo-amplification genosensor for detection of transgenic CaMV 35S sequence
1 实验部分
1.1 试剂与材料
氧化石墨(GO,南京济仓纳米科技有限公司);Thi(85%)、Hemin(95%),购自美国Sigma-Aldrich公司;NH2NH2·H2O、HAuCl4·4H2O(分析纯,国药集团化学试剂公司);三(羟甲基)氨基甲烷(Tris,99%)、十二烷基硫酸钠(SDS,95%)、乙二胺四乙酸二钠盐(EDTA,99%),购自北京Solarbio科技有限公司;Invitrogen TRIzol分离试剂(美国ThermoFisher公司)。用TE缓冲溶液(10 mmol/L Tris-HCl,1.0 mmol/L EDTA,pH 8.0)制备浓度为1.0×10-4mol/L的所有寡核苷酸储备溶液保存至冰箱。实验所用缓冲液如下:电化学测试溶液(0.1 mol/L磷酸盐缓冲液,pH 7.4),杂交缓冲溶液(10 mmol/L Tris-HCl,1.0 mmol/L EDTA,50 mmol/L NaCl,pH 7.4)。其他化学品均为分析级,实验用水均为超纯水。
CaMV 35S启动子基因作为DNA靶序列。寡核苷酸序列由上海生工合成,其序列如下:
捕获序列(pDNA,S1):5'-SH-TAC GTT ATC AGA CTG ATG ATG A-3'。
互补序列(cDNA,S2):5'-ATG CAA TAG TCT GAC TAC TAC T-3'。
单碱基错配序列(Mis-1):5'-ATGTAA TAG TCT GAC TAC TAC T-3'。
三碱基错配序列(Mis-3):5'-ATGTAA TGG TCT GTC TAC TAC T-3'。
1.2 仪器与方法
用JEM-2100F(JEOL)在200 kV加速电压下获得场发射透射电子显微镜(TEM)图像;在ESCALAB250 X射线光电子能谱仪(ThermoFisher)上完成X射线光电子能谱(XPS)分析;以修饰玻碳电极(GCE,φ3 mm)为工作电极,Ag/AgCl电极为参比电极,铂丝电极为辅助电极的三电极体系在CHI832D电化学工作站(上海辰华仪器有限公司)上进行循环伏安法(CV)和示差脉冲伏安法(DPV)实验。
1.3 Hemin-rGO、AuNP纳米复合物的制备
1.3.1 AuNP的制备 根据先前报道的方法制备AuNP[21]:将10.0 mL的38.8 mmol/L柠檬酸钠加入沸腾的100 mL 0.01%的HAuCl4溶液,剧烈搅拌至酒红色。继续搅拌溶液直至室温。
1.3.2 Hemin-rGO和rGO的制备 rGO通过改进的Hummers方法合成[22]。通过超声波剥离氧化石墨(1.0 mg/mL)24 h后,将得到的棕色分散体离心(3 000 r/min,30 min)从而制得GO纳米片,随后透析1周以除去小分子。Hemin-rGO的制备[23]:将GO分散体(10 mL,0.5 mg/mL)与Hemin水溶液(10 mL,用0.1 mol/L NaOH溶解至0.5 mg/mL)和氨溶液(100μL,28%)混合,接着加入水合肼(20μL,25%),剧烈搅拌30 min后,置于60℃水浴中24 h。多次洗涤离心得到黑色的Hemin-rGO纳米复合材料。除了加入Hemin之外,rGO的制备与Hemin-rGO的步骤相同。
1.4 DNA传感界面的构建
将5μL Hemin-rGO溶液(0.5 mg/mL)均匀滴涂在处理光滑的GCE上,干燥后得到Hemin-rGO/GCE。通过在含有0.1 mol/L KNO3的3 mmol/L HAuCl4溶液中电沉积(-0.2 V,100 s)得到AuNP/Hemin-rGO/GCE[24]。随后,浸入5μL 10μmol/L巯基化S1,室温下温育过夜后,用0.1%SDS溶液、Tris-HCl溶液和水依次洗涤电极以除去未自组装的S1,得到S1/AuNP/Hemin-rGO/GCE。
1.5 核酸序列杂交和电化学信号的放大
将S1/AuNP/Hemin-rGO/GCE置于不同浓度S2的杂交缓冲液中,37℃温育90 min后,淋洗以去除未杂交的S2(如“1.4”所述),得到S2/S1/AuNP/Hemin-rGO/GCE。然后,将5μL巯基化的S3滴加到电极表面并温育2 h,淋洗后得到S3/S2/S1/AuNP/Hemin-rGO/GCE。再将该电极避光浸泡在AuNP溶液中40 min,得到AuNP/S3/S2/S1/AuNP/Hemin-rGO/GCE,经水冲洗后,插入0.5 mmol/L Thi溶液避光放置15 min,使Thi与AuNP结合。最后用水淋洗电极后待用。
1.6 样品的制备和PCR对照
转基因拟南芥样品用TRIzol试剂提取总RNA后,应用逆转录方法获得cDNA。在含有1μL cDNA,0.4μL 10μmol/L每种引物,0.2μL Premix Taq和17.2μL水,且终体积为20μL的溶液中进行PCR扩增。tDNA首先在94℃预变性5 min,然后是94℃、30 s(变性),51℃、30 s(退火),72℃、40 s(延伸)和最后5 min延伸的40个循环。取10μL PCR产物进行1%琼脂糖凝胶电泳(电泳条件为80 V,30 min)。另外,将得到的PCR产物在100℃水浴中加热7 min后立即冰水浴5 min以获得解旋的ssDNA,最后利用已制备好的电化学基因传感器,在最优的杂交及检测条件下进行电化学检测。
2 结果与讨论
2.1 Hemin-rGO和AuNP纳米复合材料的表征
采用TEM对rGO、Hemin-rGO和AuNP纳米复合材料进行表征。可观察到,rGO为轻微皱纹的片状(图2A),Hemin-rGO纳米片与rGO相比无显著差异(图2B),表明Hemin-rGO保持了rGO原有的片层结构。所制备的AuNP呈颗粒状(图2C)。

图2 rGO(A)、Hemin-rGO(B)及AuNP(C)的TEM图像Fig.2 TEM images of rGO(A),Hemin-rGO(B)and AuNP(C)
采用XPS谱图对GO、rGO、Hemin-rGO复合材料进行考察,计算出GO、rGO、Hemin-rGO中C与O原子比(C/O)分别为0.759、1.814、2.06,推测可能由于化学还原反应导致rGO中C/O值增加,而Hemin的加入进一步增加了复合材料的还原能力。Hemin-rGO在711.88 eV(Fe2p3/2)和725.63 eV(Fe2p1/2)处的Fe2p带也证明Hemin已成功修饰,与文献[25]报道的Hemin结合能712.5 eV(Fe2p3/2)和726.3 eV(Fe2p1/2)相比,有0.7 eV的转移,表明Hemin与rGO纳米片之间存在相互作用。
2.2 修饰电极的电化学行为
采用CV和DPV法表征了电极在0.1 mol/L pH 7.4的磷酸盐缓冲溶液中的修饰过程,如图3所示。裸GCE无氧化还原峰(曲线a);Hemin-rGO修饰后充电电流显著增加并可观察到明显的氧化还原峰(曲线b);当AuNP电沉积在Hemin-rGO修饰电极上时,由于AuNP促进了电子传输(曲线c),峰电流进一步增加;巯基化捕获探针自组装到AuNP/Hemin-rGO表面后阻碍了电子转移,峰电流下降(曲线d);当S1/AuNP/Hemin-rGO/GCE与tDNA(S2,1×10-15mol/L)杂交后(曲线e),电流稍有增加,可能是杂交减少了S1的空间位阻;当S2/S1/AuNP/Hemin-rGO/GCE与辅助DNA序列(S3)杂交后,峰电流减少(曲线f);当S3/S2/S1/AuNP/Hemin-rGO/GCE富集AuNP时,电流无明显变化(曲线g),这可能由于空间位阻和转移电子能力的综合影响;但当硫堇分子负载在AuNP后,可导致氧化、还原电流显著增加,且峰电位向平衡电位移动(曲线h)。DPV的实验结果和CV一致。可见,传感器组装并通过DNA杂交链吸附AuNP后可负载硫堇分子,且电流响应显著增加,达到放大该基因传感器检测CaMV 35S目标序列电化学信号的目的。
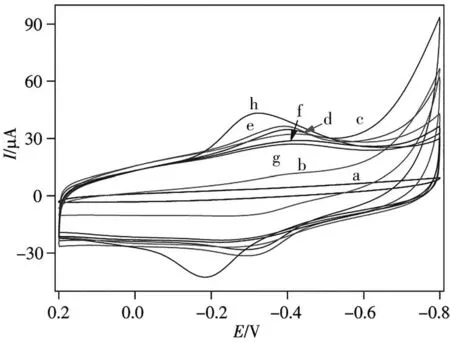
图3 CaMV 35S基因传感器组装过程的CV图Fig.3 CV curves of step by step preparation of CaMV 35S genosensora.bare GCE;b.Hemin-rGO/GCE;c.AuNP/Hemin-rGO/GCE;d.S1/AuNP/Hemin-rGO/GCE;e.S2/S1/AuNP/He⁃min-rGO/GCE;f.S3/S2/S1/AuNP/Hemin-rGO/GCE;g.AuNP/S3/S2/S1/AuNP/Hemin-rGO/GCE;h.Thi/AuNP/S3/S2/S1/AuNP/Hemin-rGO/GCE;phosphate buffer:0.1 mol/L,pH 7.4;concentration of S2:1×10-15 mol/L
2.3 CaMV 35S基因传感器的电化学信号放大
在0.1 mol/L pH 7.4的磷酸盐缓冲溶液中,采用DPV方法考察了不同传感器各组成部分对其分析性能的影响。从图4A可以看出,如果在组装阶段略过Hemin-rGO修饰,那么在预富集AuNP后的S3/S2/S1/AuNP/GCE上核酸杂交的电化学信号很小,电流响应仅约4.948μA(cDNA为1.0×10-12mol/L)(图4A曲线a)。如果缺少核酸序列顶端巯基AuNP预富集Thi的步骤,虽然在AuNP/S3/S2/S1/AuNP/Hemin-rGO/GCE基因传感器上也观察到Thi的还原峰,但其峰电流增加不明显(约为7.549μA,图4A曲线b)。而同时预富集AuNP以及修饰了Hemin-rGO后,因为杂交后预富集的AuNP可吸附更多的Thi分子,同时Hemin-rGO的优异电子传递能力及较大表面积可进一步有效放大AuNP/S3/S2/S1/AuNP/Hemin-rGO/GCE上杂交的电化学信号(约12.74μA,曲线c),从而达到双重放大的目的。图4B可以看出(曲线a),即使无tDNA时,S1/AuNP/Hemin-rGO/GCE上仍然存在一个较弱的DPV峰(5.168μA),这可能是由于带正电荷的Thi分子吸附在含有AuNP的电极上,导致背景信号产生。与图4A曲线a的峰电流接近,因此推测其也仅为背景电流,而非CaMV 35S目标核酸序列产生的电化学信号。而在组装完全的CaMV 35S基因传感器上可得到一个被双重放大的峰电流信号(图4B曲线b)。
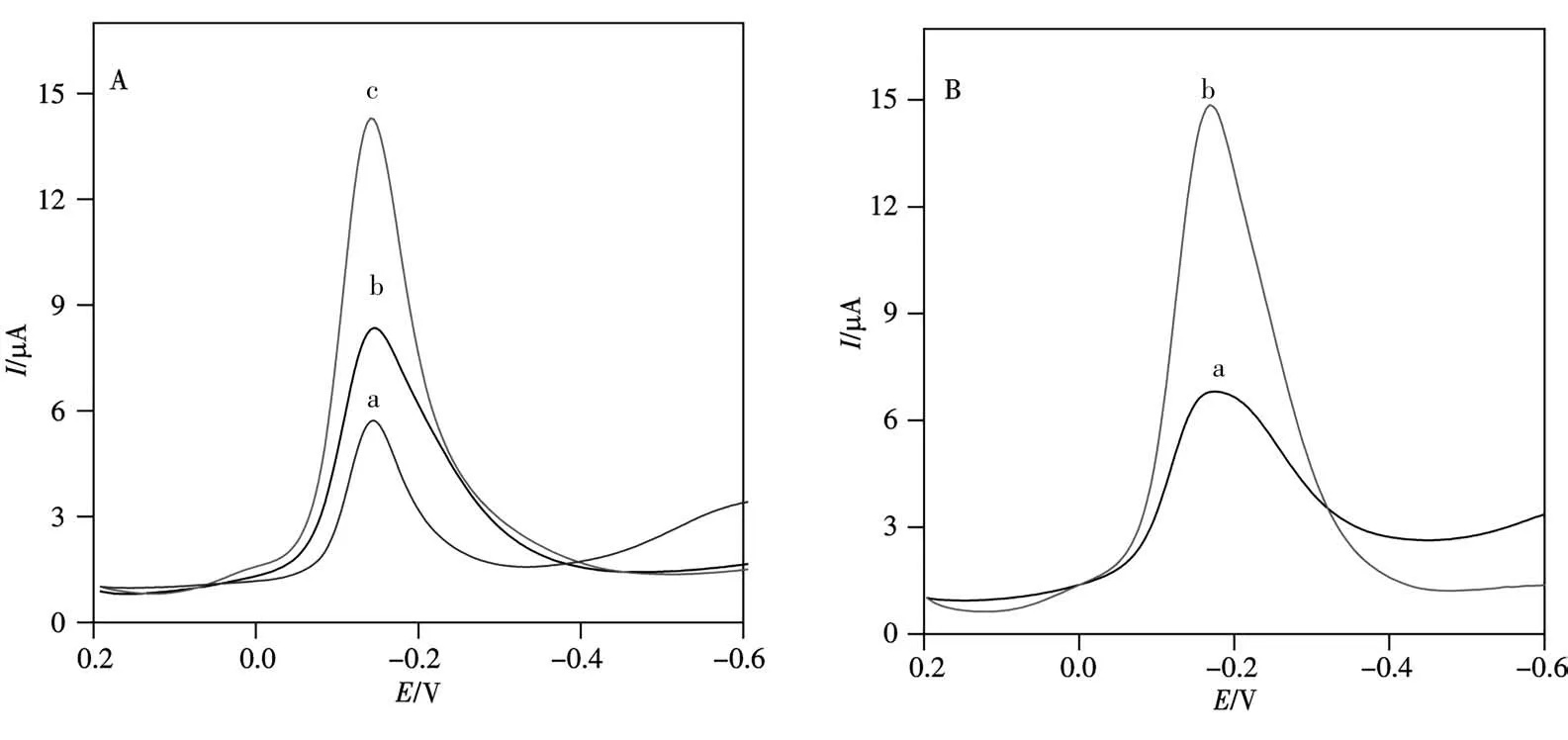
图4 双重信号放大的可行性Fig.4 Feasibility of signal duo-amplificationA.DPV curves of without Hemin-rGO(a),AuNP without Thi(b),with Hemin-rGO and AuNP-thionine(c);B.DPV curves of absence(a)and presence(b)of 1.0×10-12 mol/L target DNA in phosphate buffer(0.1 mol/L,pH 7.4)
2.4 CaMV 35S序列检测条件的优化
为了使该CaMV 35S基因传感器达到最优检测性能,对测试底液pH值、Thi浓度、吸附AuNP的时间以及DNA序列杂交时间进行优化。结果如图5所示,最优测试条件为:pH 7.4(图5A);0.5 mmol/L Thi(图5B);吸附AuNP的时间为40 min(图5C);DNA杂交时间为60 min(图5D)。
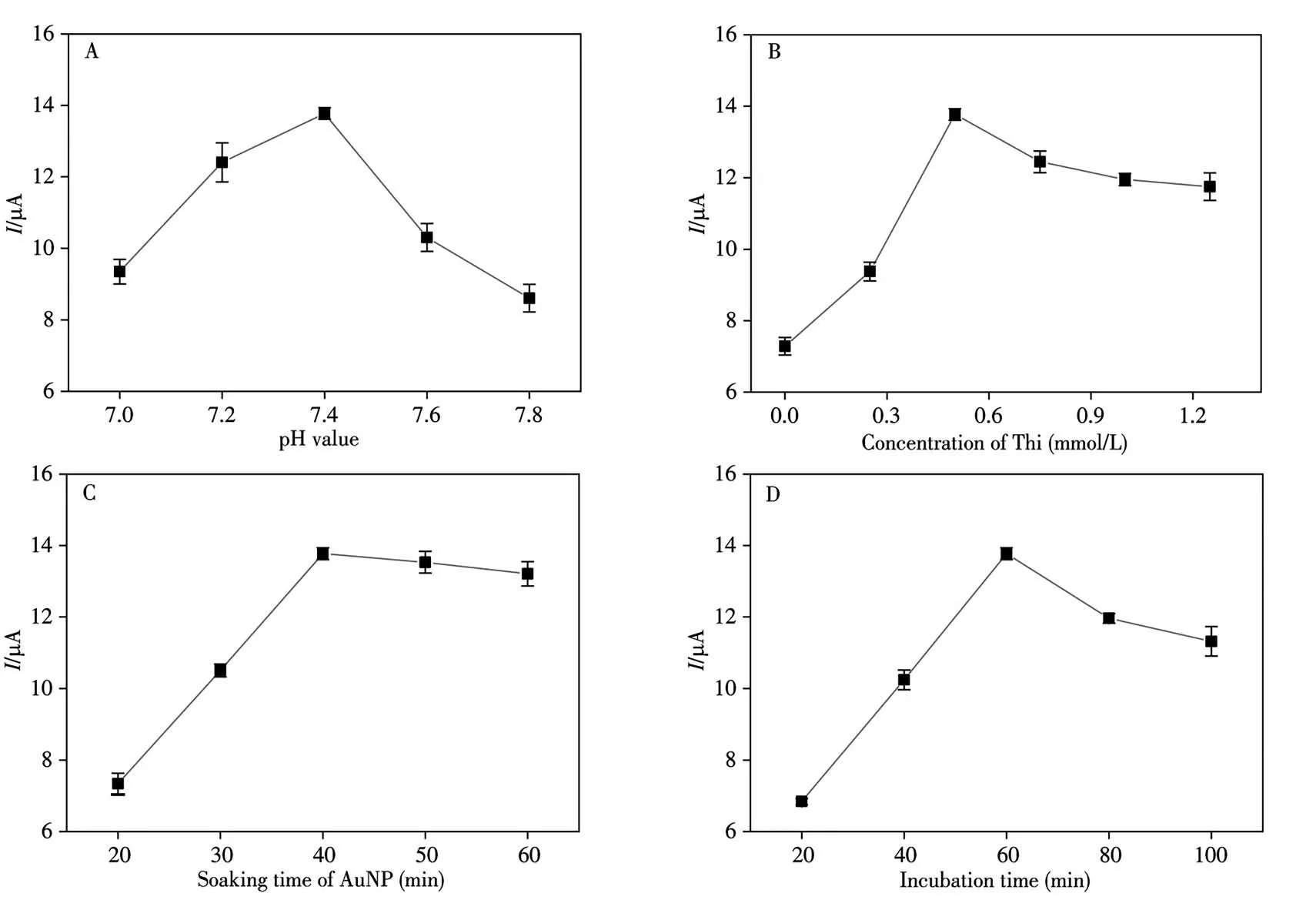
图5 CaMV 35S基因传感器检测的条件优化Fig.5 Parameter optimization for CaMV 35S genosensor performanceA:buffer pH value;B:Thi concentration;C:soaking time of AuNP;D:incubation time of DNA sequences;concentration of S2:1×10-12 mol/L
2.5 CaMV 35S序列的检测
CaMV 35S基因传感器的选择性如图6所示,曲线a为目标空白,曲线b~d分别为与1×10-12mol/L的cDNA、Mis-1和Mis-3杂交后的DPV响应。5次测量平均值中,Mis-1比cDNA的信号约低30.4%,Mis-2和空白的峰值电流值分别比cDNA的信号约低52.7%和64.9%。可见所提出的基因传感方法对特定的DNA序列有较好的选择性。
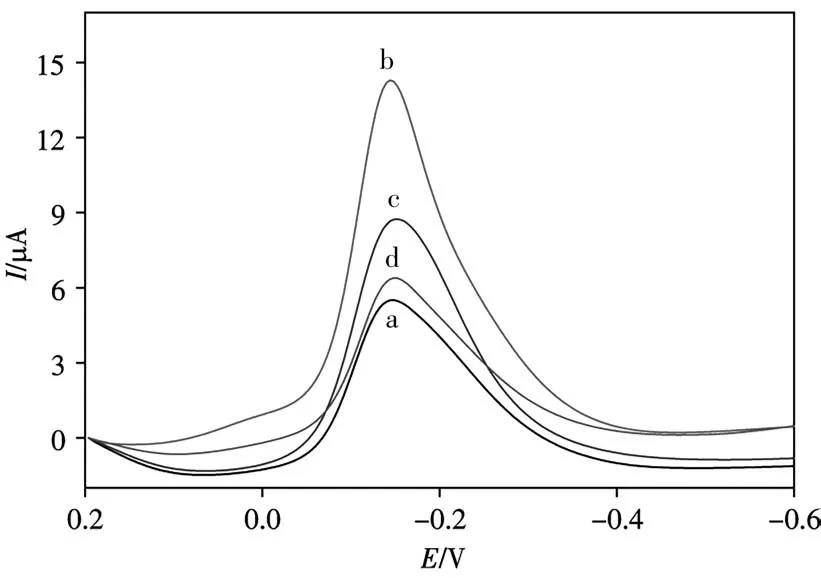
图6 CaMV 35S传感器对3种特定DNA序列的选择性Fig.6 Selectivity of CaMV 35S sensor for three specif⁃ic DNA sequencesa:blank;b:cDNA;c:Mis-1;d:Mis-3;concentration of S2:1×10-12 mol/L
采用DPV进一步考察CaMV 35S基因传感器对不同浓度目标序列的分析性能。结果显示,随着cDNA浓度的增加,DPV信号响应明显增加,且峰电流(I,MA)与cDNA浓度(C,mol/L)的对数在1×10-16~1×10-10mol/L范围内呈线性关系,线性方程为:I=32.001+1.549 lgC,r=0.994,方法检出限(LOD,S/N=3)为9.46×10-17mol/L。
2.6 DNA传感器的重复性与稳定性
取6支CaMV 35S基因传感器同时检测1.0×10-15mol/L cDNA,其组间相对标准偏差为4.6%;在4℃下储存7 d后,该基因传感器仍保留了94.5%的初始伏安响应。因此该传感器具有良好的重复性和稳定性。
2.7 实际样品CaMV 35S序列的PCR产物检测
本研究提取拟南芥总RNA通过逆转录为cDNA后,PCR扩增得到其PCR产物。考察了CaMV 35S基因传感器对不同PCR产物变性后ssDNA的DPV响应(图7),其中阳性样品的PCR产物杂交后的DPV峰电流约为15.198μA和11.185μA(曲线b和c),分别相当于1.420×10-11mol/L和3.645×10-14mol/L ssDNA;而阴性样品的结果与cDNA空白结果基本一致(曲线a)。插图为PCR产物dsDNA的琼脂糖凝胶电泳结果,泳道2为阴性样品,未出现明显条带;泳道3和泳道4为阳性样品,可见其PCR扩增产物条带出现在约500 bp处。利用电化学传感方法检测的结果与凝胶电泳法的结果一致。
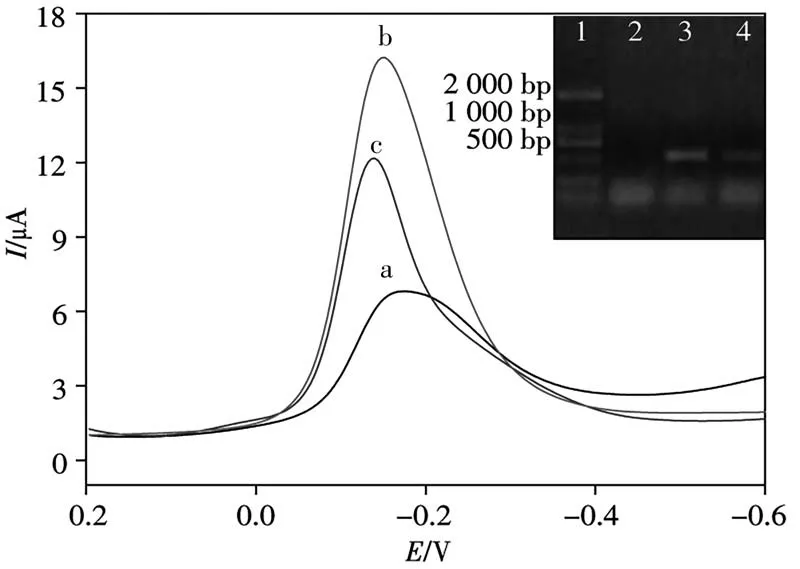
图7 PCR产物的DPV曲线Fig.7 DPV curves for PCR producta.negative real sample;b,c:two positive real samples;inset:gel electrophoresis for DL2000 DNA marker(lane 1),negative sample(lane 2),and positive real samples(lane 3 and 4)
3 结 论
本研究建立了一种基于Hemin-rGO和AuNP负载Thi的双重信号放大的电化学DNA传感方法,可用于转基因作物中花椰菜花叶病毒35S启动子序列的快速检测。在最优分析条件下,该CaMV 35S传感器可用于实际样品的检测,实现了对超低含量目标序列的检测。该传感器制备较为简便、易于保存,具有良好的选择性、稳定性和重复性,可以满足食品、饲料及其他工业品等原料或成品中转基因作物成分快速检测筛查的需求。

