1例误诊尿崩症的Gitelman综合征病例分析
王莉华, 彭 超, 刘维娟, 冉东川, 何 艳, 王 怡
(重庆大学附属三峡医院 内分泌代谢科, 重庆, 404000)
Gitelman综合征(GS)也称家族性低钾-低镁血症,是一种常染色体隐性遗传所致的失盐性肾小管疾病,其特征为低钾性碱中毒、低镁血症、低钙尿症和继发性醛固酮增多症,是低钾血症和代谢性碱中毒的原因之一[1]。以往观点认为GS是一种罕见病,发病率约为1/50 000, 但随着基因检测技术的发展,目前有报道[2]称日本杂合体携带者占比高达6.4%, 显著高于欧美人群,但尚未检索到关于中国GS患病率的相关报道。本研究对1例误诊尿崩症的GS患儿进行临床检查和基因检测分析,并对国内外文献进行总结,旨在为GS的临床诊治提供一定的参考依据。
1 资料与方法
1.1 病例资料
患儿男,年龄12岁4个月,因“发作性四肢乏力3年余”入院。3年余前,患儿无明显诱因出现四肢乏力,伴口干、多饮(每日饮水量较以往增加3 000 mL)、多尿(夜尿次数增多, 3~5次/晚),无肌肉震颤、麻木,无怕热、易饥、消瘦、易怒,无腹痛、腹泻,无精神异常等,于外院被诊断为“尿崩症”,但患儿未用药治疗。3年来上述症状反复发作,“感冒”后或运动后明显,外院多次检查结果示“血钾低”,均予以补钾治疗后好转。1 d前患儿至本科就诊,电解质检测结果示血钾2.51 mmol/L, 以“低钾血症”收住入院。自患病以来,患儿精神、睡眠、食欲正常,小便次数及尿量增多,大便正常,体质量增长情况符合其年龄。
① 既往史: 患儿平素健康状况良好,否认“肝炎、结核”等传染病史,否认食物、药物过敏史,否认重大外伤及手术史,预防接种均按规定执行。② 个人史: 患儿于原籍出生并居住,否认疫区居住及生活史,生长发育与同龄儿童无明显差异。③ 家族史: 父母体健,家族无类似疾病及其他遗传性疾病史。④ 体格检查: 体温36.3 ℃, 脉搏105次/min, 呼吸20次/min, 收缩压97 mmHg、舒张压73 mmHg, 身高142 cm, 体质量42 kg。患儿发育正常,精神及智力粗测结果正常,心、肺、腹正常,四肢肌力及肌张力正常。⑤ 血尿检测结果: 血钾2.51 mmol/L(正常值参考范围3.50~5.50 mmol/L), 血钠139.00 mmol/L(正常值参考范围135.00~155.00 mmol/L), 血氯96.00 mmol/L(正常值参考范围99.00~110.00 mmol/L), 血钙2.51 mmol/L(正常值参考范围2.11~2.52 mmol/L), 血镁0.81 mmol/L(正常值参考范围0.75~1.02 mmol/L), 尿pH值8.00。⑥ 动脉血气分析结果: pH值7.52, 剩余碱(BE)8.90 mmol/l。⑦ 24 h尿电解质结果: 尿钾58.21 mmol/24 h, 尿氯218.00 mmol/24 h, 尿钙0.04 mmol/24 h, 尿镁0.77 mmol/24 h, 尿磷10.10 mmol/24 h。⑧ 辅助检查结果: 肾素浓度192.84 pg/mL, 醛固酮251.92 pg/mL, 空腹葡萄糖5.48 mmol/L, 空腹胰岛素21.36 μIU/mL(正常值参考范围3.50~16.00 μIU/mL), C肽5.32 ng/mL(正常值参考范围1.44~2.34 ng/mL)。皮质醇值、促肾上腺皮质激素(ACTH)值及昼夜节律、抗核抗体未见明显异常。心电图、胸片、心脏及腹部彩超未见明显异常。
1.2 方法
获取知情同意后,抽取患儿母亲、姐姐、侄女(姐姐之女)的血液样本进行检测(患儿父亲在外地,未能取样检测)。首先对患儿进行高通量测序,再对患儿母亲、姐姐、侄女进行Sanger验证。参考的基因组版本为GRCh37/hg19, 根据美国医学遗传学与基因组学会(ACMG)发布的变异解读指南进行致病性分析,分为致病性变异、疑似致病性变异、临床意义未明变异、疑似良性变异和良性变异。
2 结 果
该患儿血液样本分析结果显示,SLC12A3基因有1个纯合突变,即在1456号核苷酸由鸟嘌呤G变为腺嘌呤A(c. 1456G>A)的纯合突变,导致第486号氨基酸由天冬氨酸变为天冬酰胺(p.D486N), 该变异已被相关研究[3]指出与GS相关。依据ACMG发布的变异解读指南,初步判定该变异为疑似致病性变异。家系验证分析结果显示,患儿母亲该位点杂合变异,患儿侄女该位点杂合变异,患儿姐姐该位点纯合变异。见图1。
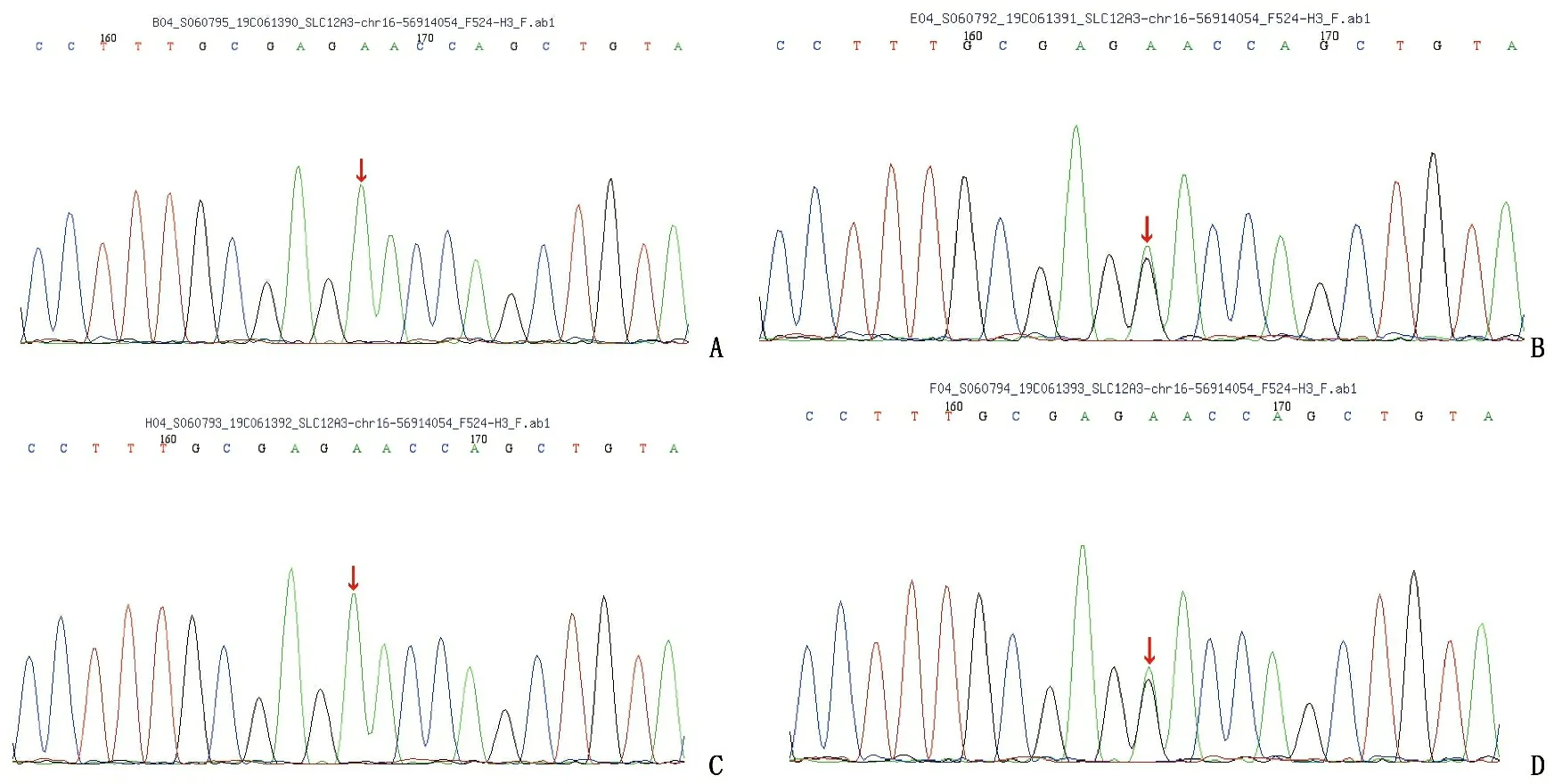
A: 患儿-纯合变异; B: 患儿母亲-杂合变异; C: 患儿姐姐-纯合变异; D: 患儿侄女-杂合变异。
基因结果回示后患儿被诊断为GS, 门诊随访时调整治疗方案为氯化钾缓释片1 g, 4次/d, 厄贝沙坦片150 mg/d。1个月后再次门诊随访,血钾3.20 mmol/L, 血镁0.83 mmol/L, 患儿自觉乏力、口干、多饮、多尿症状明显缓解。
3 讨 论
GS是一种遗传性的肾小管病变,由远曲小管(DCT)的噻嗪类利尿剂敏感的 Na+-Cl-共转运体(NCCT)功能缺陷引起[4]。GS主要在6岁以上人群中发病,但也可能在新生儿中出现。GS患者的主要临床表现包括口渴、多饮、嗜盐、夜尿多、肌肉无力、疲劳、运动耐力差、手足抽搐、感觉异常、生长迟缓、腹痛发作。正常情况下, DCT占肾脏钠吸收的5%~10%[5]。GS患者中,由于NCCT缺陷使得DCT中重吸收的钠减少,导致DCT及集合管增加了Na+-K+交换及Na+-H+交换,造成钾、氢排泄增加,因此呈现低血钾症和代谢性碱中毒的生化特征[6]。该患儿血镁水平正常,但低镁血症(血镁<1.2 mEq/L)与不适当的镁尿(微量镁排泄率>4%)是GS患者的典型特征之一[7]。目前,低血镁的具体机制尚未明确,但已有研究[8]指出低镁血症与上皮镁通道瞬时受体电位阳离子通道亚家族M成员6(TRMP6)的下调有关,该家族成员沿DCT的顶膜表达,并负责镁的主动跨细胞转运。GS患者低尿钙的机制也未明确,有研究[9]猜测是因为氯化钠的重吸收减少,影响电化学梯度从而导致钙的重吸收增加。肾性失盐及水丢失使得血容量减少,导致血压偏低,患者会有明显的口干、多饮症状,并因此激活肾素-血管紧张素-醛固酮系统[10]。
GS的诊断标准目前尚未统一,但若患者出现下列异常生化结果则需考虑将其诊断为GS: ① 低血钾合并尿钾增加(即随机尿中尿钾/尿肌酐>2.0); ② 代谢性碱中毒; ③ 低镁血症(血镁<0.7 mmol/L)伴肾脏排镁增加(镁排泄分数>4%); ④低尿钙(成人随机尿中尿钙/尿肌酐<0.2); ⑤ 高肾素活性或水平提升; ⑥ 氯离子排泄分数>0.5%; ⑦ 血压正常或偏低; ⑧ 正常的肾脏超声表现,无肾钙化病或肾脏异常[11]。聂冬英等[12]报道,部分GS患者有糖耐量异常、肥胖、高血脂、高尿酸等代谢综合征的相关表现。GS最常见的鉴别诊断疾病为滥用利尿剂所致的低钾血症,而神经性厌食症等造成的大量、频繁呕吐也会导致低钾血症、血容量减少和代谢性碱中毒[13]; 原发性醛固酮增多症也会引起低钾血症和代谢性碱中毒,但此类患者由于醛固酮水平明显增高,多表现为高血压且低肾素水平。CLCNKB基因突变所致的Bartter综合征3型,其临床表型与GS高度一致,在未进行基因检测的情况下,很难与GS相区别,因此需重点关注[14]。HNF1B的杂合突变也会导致低镁血症和低尿钙,需要与GS相鉴别,但该病临床上多会出现早期肾损伤及以常染色体显性遗传的方式遗传糖尿病、肾囊肿[15]。鉴于GS的鉴别诊断较为复杂,且同一家庭的成员之间的临床表型也不完全相同[16], 故目前确诊GS多依赖于基因检测结果,即SLC12A3基因中发现双等位基因突变。目前已被报道的GS突变位点中,错义突变类型最常见,占60%以上[17]。在中国一项较大样本量的研究[18]中,错义突变占83.3%。目前,临床尚未发现明显的热点基因,但相关研究[19-20]提示Thr60Met和Arg913Gln可能是中国GS患者的常见突变。GS为常染色体隐性遗传,因此子代有1/4概率患病,即便目前无明显临床表现,但在未进行基因检测的情况下并不能绝对排除GS, 其临床症状将有可能在成年后出现。早期基因检测可帮助患者了解并接受自身病情,同时对可能受影响的家庭成员开展进一步筛查。尽管技术上可行,但由于大多数患者预后良好,因此并无必要进行产前诊断。
目前, GS的治疗以维持电解质平衡为主,但若同时存在低钾血症和低镁血症,建议优先进行补镁治疗,因为镁的补充会促进钾的吸收,并降低手足抽搐和其他并发症发生风险[21-22]。GS的推荐治疗目标是血钾>3.0 mmol/L, 血镁>0.6 mmol/L, 治疗首选为富含电解质的水果等食物。氯化钾的补充剂型可以为水剂、糖浆或缓释制剂。因为各种镁制剂的生物利用度不同,临床建议补充镁剂时优先选择氯化镁、乳酸镁和天冬氨酸镁[23]。值得注意的是,大剂量补充钾和镁可能导致严重的副作用,包括胃溃疡、呕吐或腹泻以及其他异常生化表现,因此临床应提倡个体化治疗,需要在血生化达标与自觉症状可耐受之间找到平衡点。因此,每次随访时,医生应评估GS患者与低钾血症(疲劳、肌肉无力、便秘、心律不齐)、低镁血症(手足抽搐、痉挛、感觉异常、关节和肌肉疼痛)有关的主诉。当患者持续存在低钾血症并伴有相关症状,补钾治疗效果不好或不能耐受副作用时,可考虑使用醛固酮受体拮抗剂(螺内酯可拮抗醛固酮活性,减少尿钾排泄从而升高血钾)治疗,选择性醛固酮拮抗剂依普利酮副反应则相对较少[24]。但相关研究[25]提出,螺内酯的补钾效果可能优于依普利酮,且口服补钾联合螺内酯可更有效地提高血钾水平。因前列腺素E2(PGE2)水平高, Bartter综合征可采用前列腺素合酶抑制剂(NASIDs)进行治疗,但GS患者的PGE2水平通常是正常的。在一项随机对照试验(RCT)[26]中,低钾血症的获益校正被胃肠道副反应、肾损伤等副作用抵消。目前也有研究[27]采用肾素-血管紧张素系统抑制剂(血管紧张素转换酶抑制剂和血管紧张素受体阻滞剂)治疗GS, 但GS患者通常血压不高且多处于低血容量状态,故药物应用受限,患者如果出现严重呕吐或腹泻,应停止用药。
一般情况下, GS患者的长期预后较好,但疲劳程度可能会影响某些患者的日常活动,长期慢性低钾血症和低镁血症也会导致机体代谢紊乱、心律不齐甚至慢性肾脏病。因此,临床建议GS患者每年应接受1~2次专科随访,并根据临床症状监测血生化指标。

