嵌合型13环状染色体综合征的产前诊断
周世豪,杨梦月,李红玉,卜秀芬,王卫红,胡兰萍,贺 骏,吴敏泉
环状染色体是一种罕见的染色体畸形,可发生在22 对常染色体以及性染色体。环状染色体通常是由于染色体长、短臂分别发生断裂,含有着丝粒的染色体片段两端重新融合而成[1-2]。13 号环状染色体[r(13)]最早在1968 年被Lejeune 等[3]报道,后续研究显示13 号环状染色体在活产儿中的发病率约为1/58000[4]。国内外目前已有多例13 号环状染色体病例的报道,患者临床表现各异,主要包括生长发育迟缓,智力低下,多发畸形等[5-7]。
环状染色体的形成通常伴有遗传物质的丢失,患者的临床表型理论上与丢失的染色体片段所包含的基因密切相关。常规的细胞遗传学技术受限于检测精度,可能无法检测到染色体的微小重复/缺失。随着实验室技术的不断革新,染色体微阵列(Chromosome Microarray,CMA),低深度全基因组测序(Low-Pass Whole Genome Sequencing,Low-Pass WGS)等分子遗传学技术的出现,使精确诊断染色体水平的拷贝数变异成为可能,并为传统细胞遗传学技术做出了有力补充,更好的服务于临床工作。
本研究应用常规细胞遗传学分析,CMA 技术对一例B 超异常的13 号环状染色体胎儿羊水进行检测分析,旨在为产前诊断,遗传咨询和优生优育提供依据。
1 对象与方法
1.1 对象孕17 周胎儿,B 超发现胎儿室间隔缺损,主动脉与肺动脉内径接近,单脐动脉,孕12 周时NT 值4.7 mm(正常值<3 mm)。孕妇夫妻双方表型正常,孕1产0。孕期无毒物放射线接触史,夫妻双方否认家族遗传病史。
1.2 方法
1.2.1 胎儿羊水细胞染色体核型分析 在签署知情同意书后,超声引导下穿刺抽取羊水20 mL,分2瓶接种于羊水细胞培养基中(杭州博圣),置于37℃含5%CO2的培养箱中静置培养6 d 换液一次,11 d收获、制片、G显带,两瓶羊水分别计数40 个细胞,共80 个细胞,均进行了电脑终端核型分析。染色体核型描述参照人类细胞遗传学国际命名体制(ISCN2016)。
1.2.2 胎儿羊水细胞染色体微阵列技术检测 超声引导下穿刺抽取羊水10 mL,离心后采用tiangen 微量DNA 提取试剂盒提取羊水细胞全基因组DNA,之后使用Human CytoScan 750K_Array(Affymetrix,US)进行扫描,Chromosome Analysis Suite(ChAS)3.2软件(Thermo Fisher Scientific,US)对结果进行分析。芯片结果依据原发性拷贝数变异解读和报告的技术标准:美国医学遗传学与基因组学学院(ACMG)和临床基因组资源(ClinGen)的共同共识建议进行判读。
2 结果
2.1 胎儿超声结果
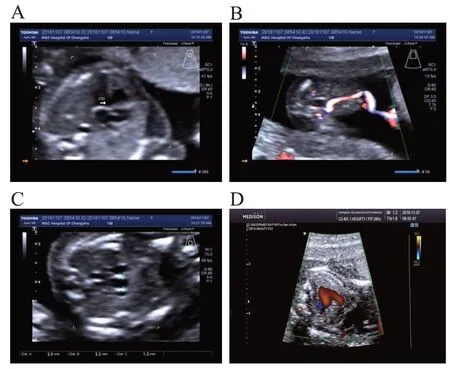
图1 胎儿超声图谱
2.2 羊水细胞染色体核型分析 胎儿羊水细胞核型分析计数80 个细胞,45,XY,-13[45]/46,XY,r(13)(p11q34)[35](图2A,2B),断裂重接点可能在p11 和q34 处。其父母外周血核型验证均为正常,考虑胎儿环状染色体为新发(de novo)变异。

图2 胎儿羊水细胞染色体核型结果
2.3 羊水细胞染色体微阵列技术检测 胎儿羊水CMA 结果显示:13 号染色体长臂q32.3q34 存在13.6Mb 缺 失 arr[hg19]13q32.3q34(101468153 -115107733)×1,13 号染色体长臂q31.3q32.3 存在7.2Mb 重 复 arr[hg19]13q31.3q32.3(94228968 -101463451)×3(图3A,3B)。
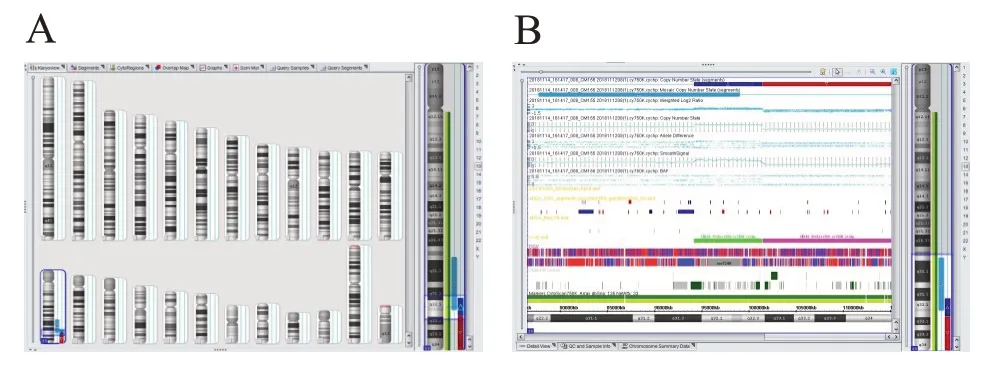
图3 胎儿羊水细胞CMA检测结果
2.3 缺失区域内基因情况 通过检索UCSC人类基因组数据库(https://genome.ucsc.edu/),CMA检测到的胎儿染色体缺失区域arr[hg19]13q32.3q34(101468153-115107733)×1 共包含75 个基因,其中OMIM 基因43 个。查询ClinGen CNVs、DECIPHER等数据库有众多致病性报道,临床表现为宫内发育迟缓、早产、羊水过少、生长发育迟缓、小头畸形、室间隔缺损、面部结构异常、智力障碍、生殖器畸形等。
2.4 重复区域内基因情况 通过检索UCSC人类基因组(https://genome.ucsc.edu/),CMA 检测到的胎儿染色体重复区域 arr[hg19]13q31.3q32.3(94228968-101463451)×3 共包含41 个基因,其中OMIM 基因25 个。DECIPHER 及ISCA 数据库有 数例致病未明报道,临床表型为宫内发育迟缓、小头畸形、身材矮小、骨骼系统发育异常、智力障碍、肌张力低等。正常人DGV数据库均未见报道。
根据以上检测结果,13 号染色体13q32.3q34区域13.6Mb 缺失为致病性CNVs,13q32.3q34 区域7.2Mb重复为致病性未明CNVs。
3 讨论
13 号环状染色体案例在国内外已有多篇文献报道,多为新发变异,患者表型及严重程度各异:胎儿期表现为宫内发育迟缓,颅脑发育异常(双侧侧脑室相通),NT增厚,室间隔缺损,心包积液等[9],出生后通常表现为生长发育迟缓,智力低下,多发畸形等[5-7、9-10]。
本案例中胎儿羊水CMA 提示13q32.3q34 区域缺失,包含43个OMIM基因,其中CHAMP1(616327)为单倍计量敏感基因,编码一种锌指蛋白,参与着丝粒微管附着,在有丝分裂中期调节染色体的正确排列,已有多篇文献报道其突变可能影响细胞分裂,从而影响大脑发育和功能,导致发育迟缓和智力障碍[11]。Toshiyuki Itai等[12]报道了COL4A1,COL4A2变异的胎儿产前表现为脑孔、脑裂和生长受限等,出生后该突变通常表现为严重的神经系统疾病[13-14]。Wang等[9]早前报道了一名13q31-qter缺失的先天性心脏病患者,患者染色体缺失区段覆盖的COL4A1,COLA42基因,被认为是引起心脏发育异常的候选基因;之前的动物模型实验也证实EFNB2基因剂量不足可能是导致心血管异常的重要因素[10];除上述基因外,胎儿染色体缺失区域还包含了与其他系统相关基因如神经发育及运动、糖尿病以及凝血因子及凝血相关基因等。本案例中由于胎儿处于宫内发育阶段,且终止妊娠时间较早,所以在临床检测中只发现了明显的心血管发育异常,但不排除胎儿同时合并其他系统异常。
胎儿羊水CMA 同时提示13q31.3-q32.3q 区域发生重复,该片段包含25个OMIM基因。Atack 等[16]2013 年报道了一例13q31.3q32.3 重复的患者,患者临床表现为面部畸形,发育迟缓以及自闭症等,作者认为该区域包含的GPC6以及ZIC2基因可能与神经发育相关,IPO5基因可能与眼部发育相关。
早前国内外针对13 号环状染色体报道多为出生后患儿,而本案例在胎儿期经超声发现胎儿明显结构异常,行产前诊断羊水核型和CMA 明确染色体重排方式,最终孕妇及家属决定提前终止妊娠,避免了患儿的出生。zhao 等[17]2017 年曾经报道了一例产前诊断过程中发现的罕见的13 号环状染色体案例,胎儿超声提示多发畸形包括宫内发育迟缓,颅脑发育异常,室间隔缺损等。脐血穿刺培养核型结果提示46,XY,r(13)[114]/45,XY,-13[3],未经培养羊水细胞aCGH结果显示13q31.3q34区域存在23.46M 缺失,13q12.11q31.3 区域存在72.08M 重复,最终孕妇决定提前终止妊娠,与本次研究相似。
本病例核型分析计数80个细胞,其中45,XY,-13占56.2%,46,XY,r(13)(p11q34)占43.8%,而CMA 的结果为13q32.3q34 存在13.6Mb 缺失,13q31.3q32.3存在7.2Mb 重复。两项检查的结果明显不相符合,可能与以下因素有关。①两项检测的标本有差异性,CMA 检测的标本是未经培养的羊水,核型分析是用传统方法培养11 d 后收获、制片得出的结果,培养前羊水中的45,XY,-13 细胞可能比例低,芯片技术的局限性之一是不能检测小于30%的低比例嵌合,培养后细胞增殖过程中13 环状染色体可能因不稳定性丢失又引起13 单体嵌合比例增高。芯片结果提示的13 号染色体长臂微缺失微重复有可能在培养过程中形成环状染色体。具体机制尚需其他方法如对培养前后的羊水细胞荧光原位杂交技术(FISH)进行验证。②核型分析13 环状染色体的断裂位点定位是p11q34,而CMA 的结果为13q32.3q34 存在13.6Mb 缺失,13 q31.3q32.3 存在7.2Mb重复。主要原因是普通G带320条带阶段分辨率低,主要针对染色体的数目和大片段的结构异常进行识别,而对13 环状的q32.3q34 和q31.3q32.3的缺失、重复分辨不清。
产前诊断病例的诊断要求尽可能精确,检测结果直接影响父母对腹中胎儿取舍的决定。CMA 的突出特征是对检测样本中DNA 拷贝数变异准确性高,而对染色体结构异常的直观表现和低比例嵌合体的检出存在局限性。一些染色体病的确诊仍需结合FISH 等技术来进一步明确。多项遗传学技术的联合应用能提高产前诊断结果的准确性,减少漏诊误诊。本病例已经引产,孕妇未同意再次抽羊水,最终未明确两个结果不一致的真实原因,有待今后继续探索。

