驱动蛋白家族成员2A与结直肠癌临床特征/预后的关联及其对癌细胞增殖/侵袭的调控作用
吴 炜,李延宏
结直肠癌是最常见的消化道肿瘤之一,近年来随着人们生活方式和饮食习惯的改变,其发病率在我国呈逐渐上升趋势[1]。目前,结直肠癌根治性治疗方法仍首选外科切除,然而由于大部分患者发病早期一般无明显症状,超过75%的患者在确诊时错过了根治性手术切除的最佳时机,导致预后不良[2-4]。因此研究结直肠癌的恶性生物学机制,寻找结直肠癌患者预后潜在生物标志物,可为结直肠癌患者预后评估、监测提供一定科学依据[5-7]。驱动蛋白家族成员2A(Kinesin family 2A,KIF2A)是驱动蛋白-13 家族成员之一,作为一种非动能微管解聚酶,参与了双极纺锤体的组装,染色体分离,以及细胞有丝分裂的过程[8-9]。近年来,有研究发现,KIF2A 参与包括卵巢癌、肺腺癌、胃癌、乳腺癌等一系列恶性肿瘤的发生与进展,并与抗肿瘤药物耐药的风险存在着重要关联[10-14]。然而目前有关KIF2A 在结直肠癌中的作用罕见研究报道。因此,本研究通过检测KIF2A在结直肠癌组织、癌旁组织中的表达情况,旨在探究KIF2A与结直肠癌患者的临床病理特征及其生存预后的相关性,此外,并探讨敲降KIF2A对结直肠癌细胞增殖、迁移、侵袭,以及其下游磷脂酰肌醇激酶/蛋白激酶B(Phospha‐tidylinositol 3-kinase/Protein Kinase B,PI3K/AKT)信号通路的影响,希望为临床治疗结直肠癌提供新思路。
1 对象与方法
1.1 研究对象 本研究回顾性分析98 例于2016 年1 月至2019 年12 月在西安国际医学中心医院进行手术切除的结直肠癌患者。患者纳入标准:①经组织病理学确诊为原发性结直肠癌;②年龄18~80岁;③接受手术切除;④术中留存的癌组织和癌旁组织保存完好且可用于免疫组织化学(Immuno‐histochemistry,IHC)检验;⑤术前肿瘤特征和术后生存随访数据记录完整。排除标准:①复发或者继发性结直肠癌;②出现远端转移;③有其他肿瘤史或有新辅助治疗史的结直肠癌患者。纳入患者的平均年龄为(66.3±10.4)岁,其中男性患者64 例(65.3%)、女性患者34 例(34.7%)。病理分级G1患者16 例(16.3%)、G2 患者69 例(70.4%)、G3 患者13例(13.3%);平均肿瘤直径(4.5±1.2)cm;淋巴结转移阴性患者69例(70.4%)、阳性患者29例(29.6%);T1 期患者3 例(3.1%)、T2 期患者11 例(11.2%)、T3 期患者82 例(83.7%),T4 期患者2 例(2.0%);N0 期患者67 例(68.4%),N1 期患者19 例(19.4%),N2期患者12例(12.2%);TNM I期患者14例(14.3%),TNM II期患者53例(54.1%),TNM III期患者31 例(31.6%)。本研究经我院伦理审查委员会批准,且所有患者或其家属均已签署知情同意书。
1.2 数据及样本收集 从电子病历中收集患者年龄,性别和术前肿瘤特征(病理分级、肿瘤直径、淋巴结转移情况、T 分期、N 分期及TNM 分期)。从生存随访数据中获取患者的生存状态,并根据患者的生存状态计算总体生存率(Overall Survival,OS)。所有患者开始随访日期为2016年2月,最后随访日期为2020年2月29日。OS定义为从患者接受手术至患者死亡的时间。从病理科获取患者术中切除的癌组织和癌旁组织,且所有组织均采用福尔马林固定石蜡包埋的方式进行保存。
1.3 主要试剂 人结直肠癌HCT116细胞购自美国模式培养物集存库;二氨基联苯胺试剂购自美国安捷伦公司;基质胶购自美国碧迪公司;HlilyMax 试剂盒购自日本同仁化学科技有限公司;苏木精试剂、Cell counting kit-8(CCK-8)试剂盒购自美国西格玛奥德里齐公司;逆转录试剂盒、SYBR®Green 荧光定量试剂盒均购自日本东洋纺公司;TRIzol 试剂盒、Annexin V-FITC 细胞凋亡检测试剂盒、蛋白裂解液和提取缓冲液、Pierce™BCA 蛋白定量试剂盒、NuPAGE Bis-Tris 预制胶均购自美国赛默飞公司;PVDF 膜购自德国默克公司。一抗包括:KIF2A 兔多克隆抗体、PI3K 兔单克隆抗体、AKT 兔多克隆抗体、pAKT 兔多克隆抗体、内参GAPDH 兔多克隆抗体购自美国艾博抗公司;二抗山羊抗兔IgG(重链和轻链)抗体购自美国CST公司。
1.4 KIF2A 水平评估 患者癌组织及癌旁组织中KIF2A 的表达水平采用IHC 测定。所有操作均按照标准程序进行,首先将癌组织和癌旁组织标本切成厚度为4 μm 薄片;对组织切片进行脱蜡,复水和表位抗原修复后,采用过氧化氢阻断内源性过氧化物酶活性;随后用0.025%Triton X-100 TBS 溶液透膜以降低组织切片表面张力,加入10%正常血清室温封闭2 h 以减少非特异性抗原结合;然后加入稀释倍数为1:200 的兔抗人KIF2A 抗体4℃条件下孵育过夜;次日加入稀释倍数为1:5000的辣根过氧化物酶标记的山羊抗兔IgG 抗体,室温下孵育1 h;最后加入二氨基联苯胺显色10 min,水洗后再加入苏木精复染,再次水洗后封片。在显微镜下观察IHC 染色结果,并采用半定量评分法对KIF2A 的表达水平进行评估。半定量评分法包括染色强度评分和染色密度评分,其中染色强度评分如下:无染色=0 分,轻度染色=1 分,中度染色=2 分,高度染色=3分;染色密度评分如下:0%=0分,1%-25%=1分,26%~50%=2 分,51%~75%=3 分,76%~100%=4 分;IHC 总分=染色强度评分×染色密度评分(0~12分)[15]。根据IHC染色评分,KIF2A表达水平划分为高表达(IHC评分>3)和低表达(IHC评分≤3)[15]。
1.5 细胞培养及转染 人结直肠癌HCT116细胞用含10%胎牛血清McCoy’s 5A 培养基液于37˚C、含5%的CO2的细胞培养箱中培养。构建3 种KIF2A短发夹RNA(Short haircut,shRNA)(抑制KIF2A 表达的小分子化合物)和阴性对照(Negative Control,NC)shRNA质粒,选择抑制KIF2A表达作用最显著的一种shRNA,进行之后的研究。当HCT116 培养至融合达到50%~60%时,使用HlilyMax,按照说明书将KIF2A ShRNA 质粒和NC ShRNA 质粒转染入细胞,并将不做任何处理的细胞、转染NC ShRNA质粒的细胞以及转染KIF2A ShRNA 的细胞分别定义为正常对照组(Normal)、阴性对照组(Sh-NC)和KIF2A敲降组(Sh-KIF2A)。
1.6 测定细胞增殖、凋亡能力 用CCK-8增殖试剂盒检测细胞增殖能力。细胞转染后,分别在0、24、48、72 h 后加入CCK-8,孵育2 h 后使用酶标仪上机检测光密度(Optical Density,OD)值,评估细胞增殖能力与细胞凋亡,使用Annexin V-FITC细胞凋亡检测试剂盒,在细胞转染48 h后按照说明书进行检测。
1.7 测定细胞迁移和侵袭能力 细胞迁移能力用细胞划痕实验检测,将HCT116 细胞以每孔2×105个细胞的密度接种在六孔板中,细胞转染24 h并生长至80%~90%汇合后,用移液管尖端垂直孔板并刮擦细胞层划线。划线后,用PBS 缓冲液洗涤3次,在不含胎牛血清的培养基中培养24 h 后,使用倒置显微镜捕获划痕区域的图像。
细胞侵袭能力用Transwell 实验检测,在转染24 h后,收集细胞,加入不含胎牛血清的培养基,接种于基质胶铺底的上层小室中,下室加入正常培养基,孵育24 h。将小室上层的贴壁细胞去除,随后用PBS 洗涤,再用4%甲醛15 min 固定,之后使用结晶紫溶液染色,再用PBS 洗涤,最后显微镜下观察并对下层细胞计数。
1.8 Real-time PCR检测mRNA表达量 收集转染48 h 后的细胞,用TRIzol 试剂提取总RNA,然后使用逆转录试剂盒ReverTra Ace®qPCR RT Master Mix,以总RNA 为模板逆转录合成cDNA,再使用SYBR® Green Realtime PCR Master Mix 试剂盒,按照其说明书进行PCR 反应。KIF2A 前端引物:5’GCCGAATACATCAAGCAAT 3’,后端引物:5’CTCTCCAGGTCAATCTCTT 3’;GAPDH,前端引物5’GACCACAGTCCATGCCATCAC 3’;后端引物:5’ACGCCTGCTTCACCACCTT 3’。
1.9 Western blotting 检测 使用蛋白裂解液和提取缓冲液提取总蛋白后,使用Pierce™BCA 蛋白定量试剂盒测定总蛋白含量。以(4%~12%)Nu‐PAGE Bis-Tris 预制胶进行电泳后,使用PVDF 膜进行转膜。与以一定稀释比例的一抗在4 ˚C 条件下孵育过夜后,将PVDF 膜在室温下与稀释后的二抗孵育1 h,之后使用Pierce™ECL 发光液在暗室中对膜PVDF 进行曝光并拍照。所用一抗包括:KIF2A兔多克隆抗体(1:1000)、PI3K 兔单克隆抗体(1:1000)、AKT兔多克隆抗体(1:1000)、pAkt兔多克隆抗体(1:1000)、GAPDH 兔多克隆抗体(1:1000)。二抗:山羊抗兔IgG(重链和轻链)抗体(1:3000)。
1.10 统计学处理 采用SPSS 24.0 和GraphPad Prism 7.00 进行统计学分析和图片制作。连续变量以均值±标准差()表示;分类变量以频次(百分比)表示。配对样本组间比较采用McNe‐mar's 检验。关联分析采用Chi-square 检验或者Spearman 秩相关分析。OS 采 用Kaplan-Meier 曲 线描述,组间OS 差异采用Log-rank 检验比较。OS 的独立影响因素采用向后逐步多因素Cox 比例风险回归模型分析。所有检验均为双侧检验。P<0.05有统计学意义。
2 结果
2.1 KIF2A 表达水平在结直肠癌患者癌组织和癌旁组织的比较 癌组织KIF2A 高表达及癌旁组织KIF2A 低表达IHC 染色样例(图1)。KIF2A 高表达比例在癌组织中(58.2%)较癌旁组织(33.7%)更高;而KIF2A 低表达比例在癌组织中(41.8%)较癌旁组织(66.3%)更低(χ2=21.925,P<0.001,表1),提示KIF2A 的表达水平在结直肠癌组织中较癌旁组织更高。
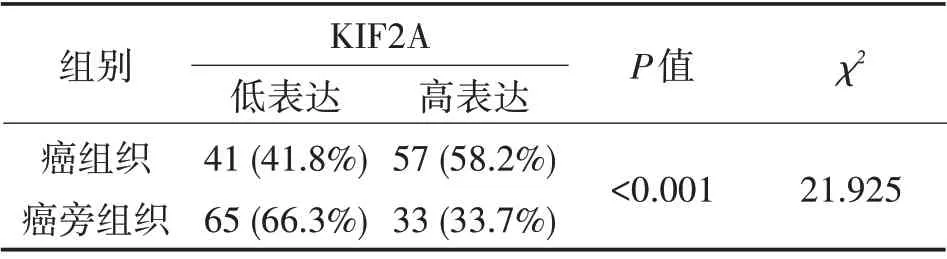
表1 癌组织和癌旁组织中KIF2A表达水平的比较
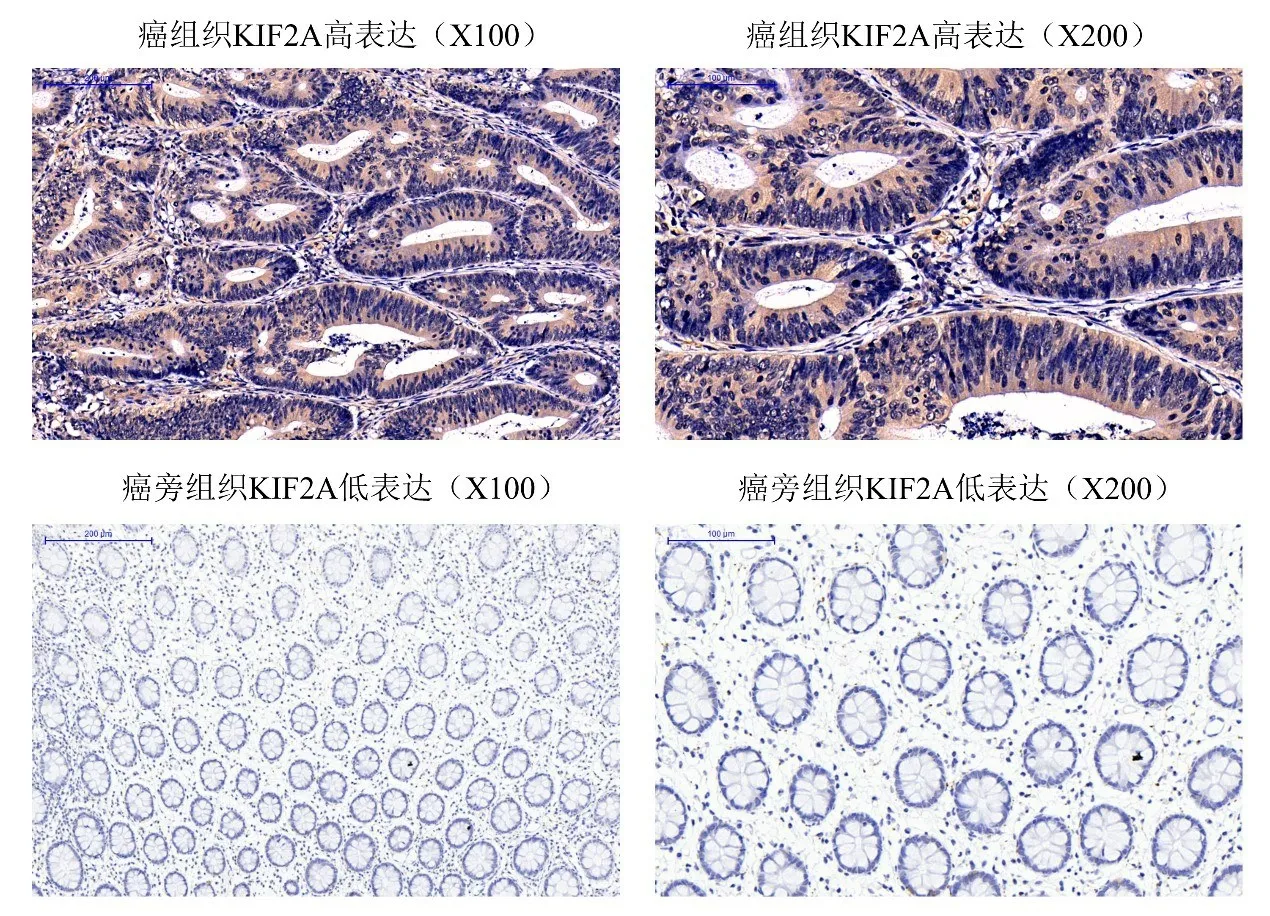
图1 癌组织和癌旁组织KIF2A表达IHC结果样例
2.2 癌组织KIF2A 表达水平与结直肠癌患者临床病理特征的关联分析 癌组织KIF2A 的表达水平与结直肠癌患者临床病理特征参数关联分析显示,癌组织KIF2A 高表达与较大的肿瘤直径(r=5.756,P=0.016),淋巴结转移阳性(r=7.492,P=0.006),较高的N 分期(r=0.246,P=0.014)和TNM 分期(r=0.228,P=0.024)相关(表2),提示在结直肠癌患者中,癌组织中KIF2A高表达与较差的结直肠癌的临床病理特征相关。
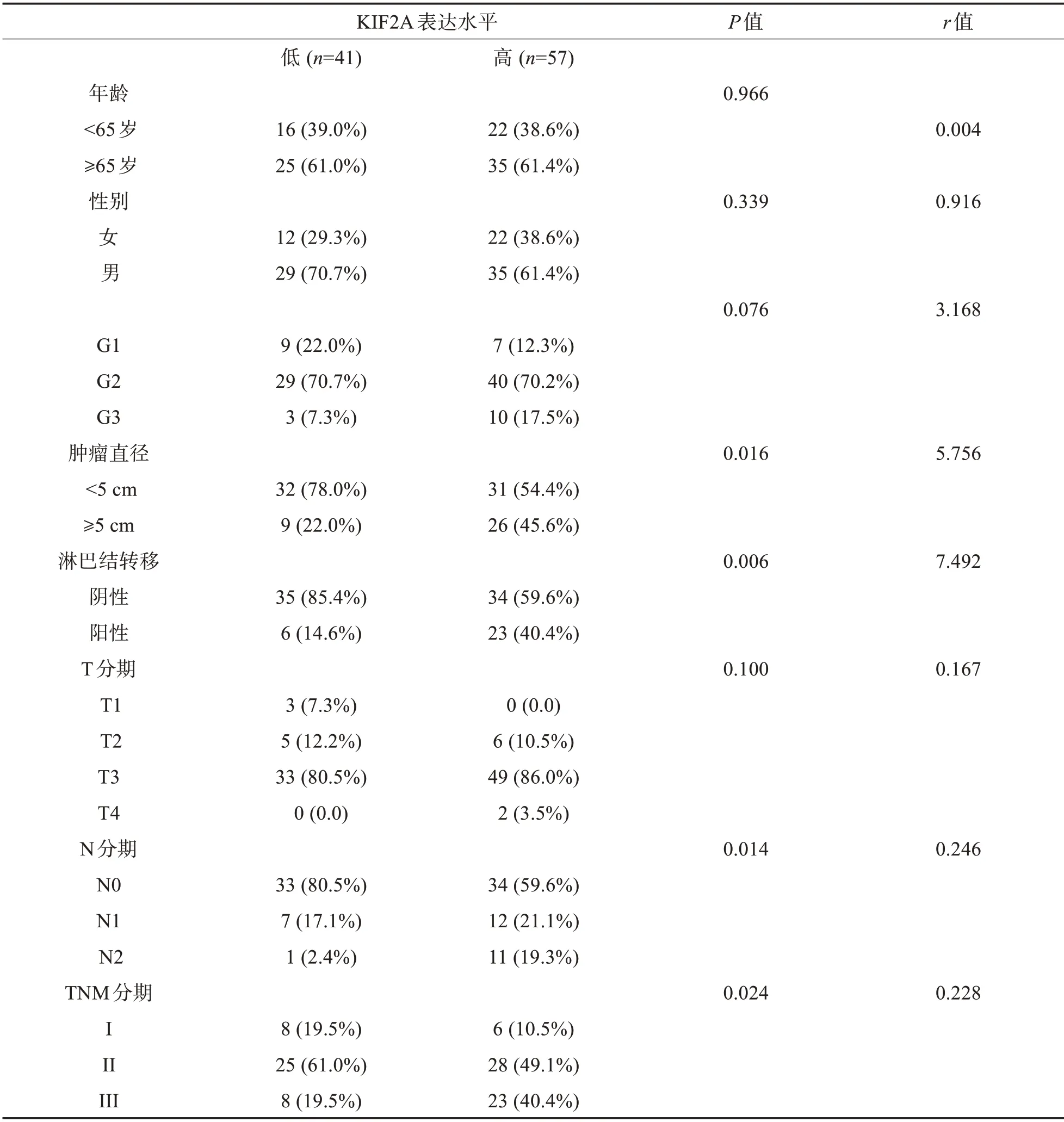
表2 癌组织中KIF2A表达水平与临床特征的关联
2.3 癌组织中KIF2A 表达水平与结直肠癌患者预后的关联分析 KIF2A 高表达的结直肠癌患者OS(平均OS 31.6 月,95%CI:26.3~36.9 月)较KIF2A 低表达的结直肠癌患者OS(平均OS 43.0 月,95%CI:38.6~47.5 月)更短(χ2=7.509,P=0.006,图2),提示在结直肠癌患者中,癌组织中的KIF2A高表达与较差的预后相关。
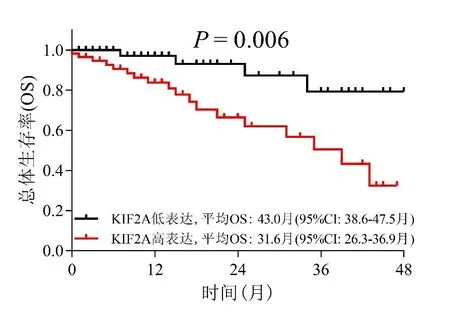
图2 癌组织KIF2A表达水平与OS的关联(Log-rank 检验)
2.4 结直肠癌患者OS 的独立影响因素分析 进一步采用向后逐步多因素Cox 比例风险回归模型分析结直肠癌患者中的OS 独立影响因素分析,结果显示KIF2A 高表达(HR=3.732,P=0.018)和较高的病理分级(HR=2.601,P=0.020)是较差OS 的独立影响因素(表3)。
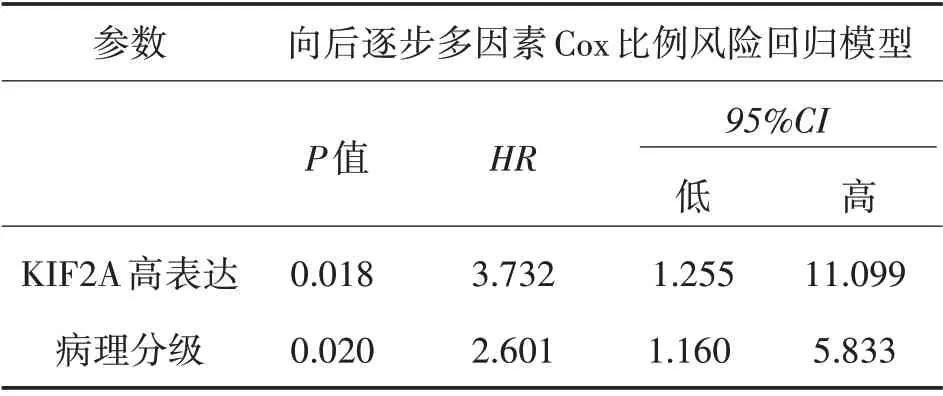
表3 OS的独立影响因素分析
2.5 转染后KIF2A 在HCT116 细胞中的表达量水平 KIF2A 敲降组对比阴性对照组,KIF2A mRNA(图3A)和蛋白(图3B)表达水平明显降低(P<0.001),而阴性对照组对比正常对照组,KIF2A mRNA 和蛋白表达水平无差异(P>0.05)。
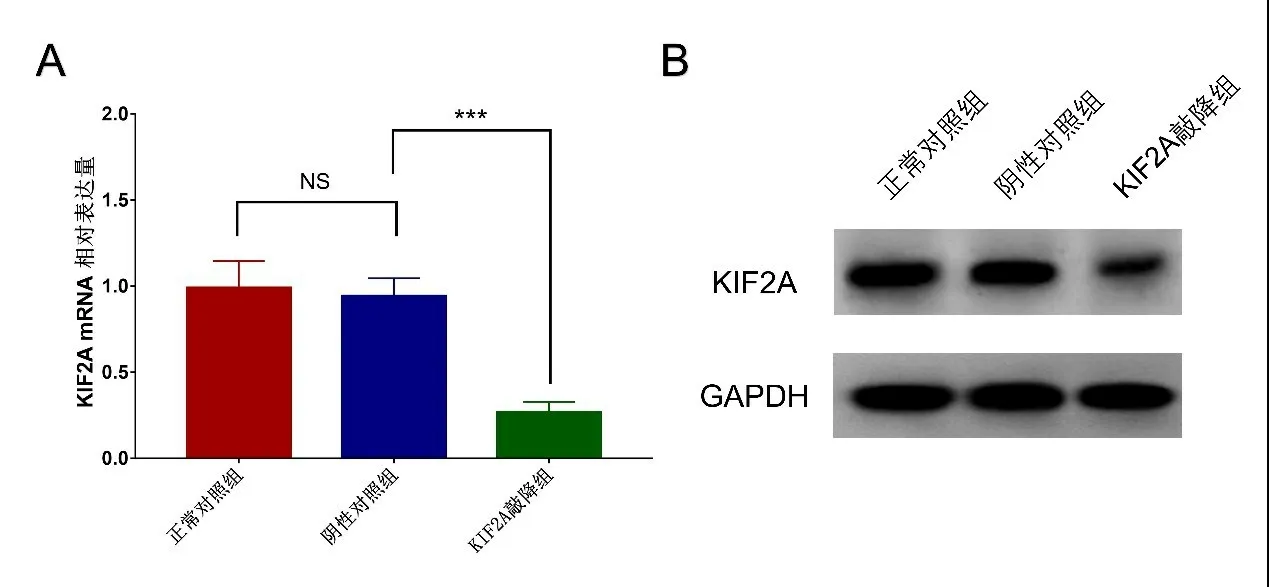
图3 转染后KIF2A的表达量水平
2.6 敲降KIF2A 对HCT116 细胞增殖和凋亡的影响 转染48 h 以及72 h 后,KIF2A 敲降组相较于阴性对照组,细胞增殖能力均明显降低(P<0.05),而阴性对照组对比正常对照组细胞增殖能力无差异(P>0.05,图4A)。流式细胞术检测结果显示,KIF2A 敲降组相较于阴性对照组,细胞凋亡明显升高(P<0.01),而阴性对照组对比正常对照组细胞凋亡无差异(P>0.05,图4B,4C)。
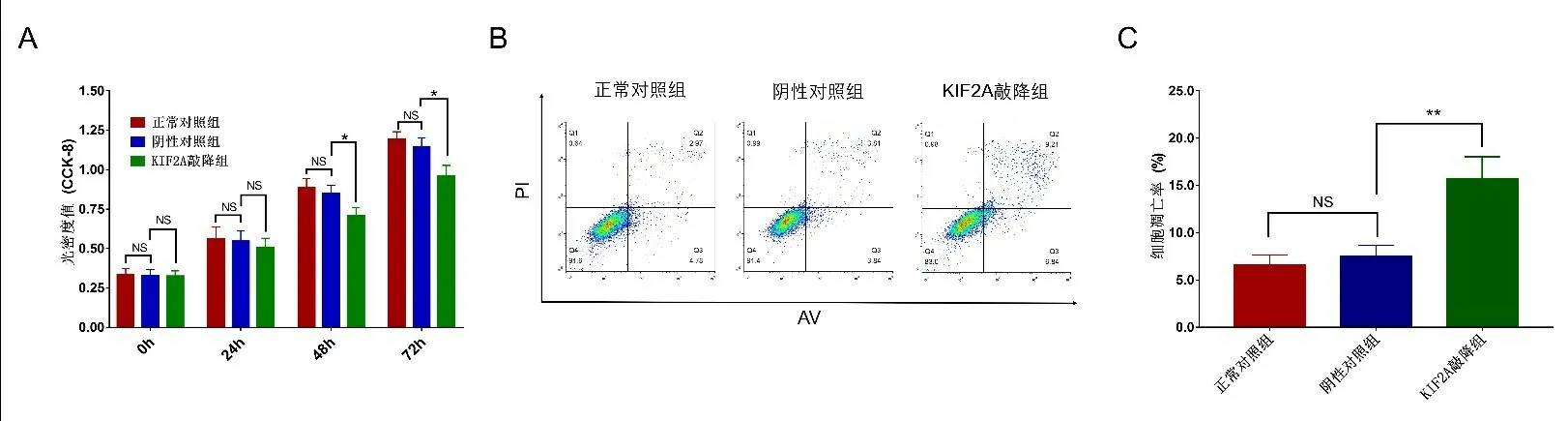
图4 敲降KIF2A对细胞增殖和凋亡的影响
2.7 敲降KIF2A 对HCT116 细胞迁移和侵袭的影响 KIF2A 敲降组对比阴性对照组,以及阴性对照组对比正常对照组的细胞迁移能力均无差异(P>0.05,图5A,5B)。Transwell 实验检测结果显示,KIF2A 敲降组对比阴性对照组的细胞侵袭能力更弱(P<0.01),而阴性对照组对比正常对照组的细胞侵袭能力无差异(P>0.05)(图5C,5D)。
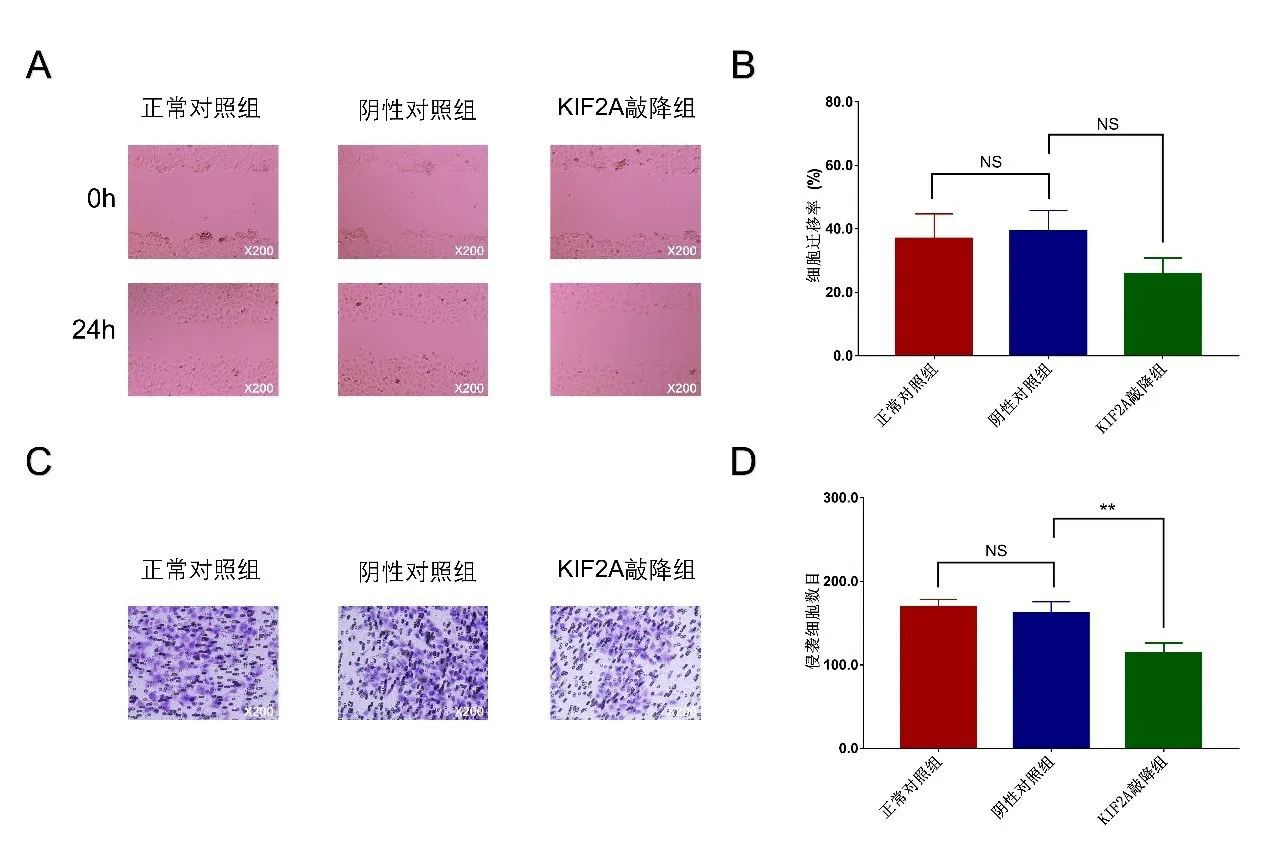
图5 敲降KIF2A对细胞迁移和侵袭的影响
2.8 敲降KIF2A 对下游PI3K/AKT 通路蛋白表达水平的影响 KIF2A 敲降组相较于阴性对照组,PI3K、p-AKT 的蛋白表达量更低,而阴性对照组对比正常对照组的PI3K、p-AKT的蛋白表达量无差异(图6)。
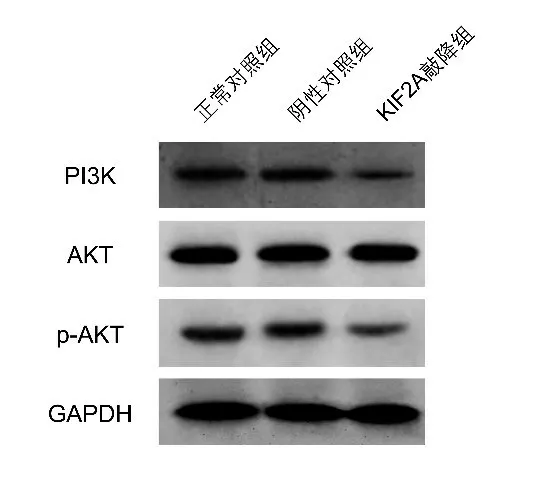
图6 下游PI3K/AKT通路蛋白表达水平
3 讨论
本研究通过分析KIF2A 在结直肠癌患者癌/癌旁组织中的表达,发现在结直肠癌患者中,①KIF2A 的表达水平在癌组织中较癌旁组织更高;②癌组织KIF2A高表达与较差的临床病理特征相关,并且癌组织KIF2A 高表达是较差生存预后的独立影响因素;③敲降KIF2A可抑制结直肠癌细胞的增殖、侵袭,促进细胞的凋亡,并抑制PI3K/AKT 信号通路的激活。
驱动蛋白是一类分子马达超家族蛋白,参与包括:神经元的生长发育、有丝分裂中纺锤体的形成、膜性细胞器的传输、微管的动力学控制、信号传导等一系列微观生命活动,为各种生命活动所需的物质运输提供动力[8-9,16]。近年来,有研究发现,驱动蛋白家族与癌症的发生、进展、侵袭和转移有着密切的关联[17-21]。例如,膀胱癌机制研究发现,驱动蛋白家族成员KIF2A 的敲除作用可以有效抑制膀胱癌细胞的增殖和转移,另外,进一步的临床研究分析发现,高表达KIF2A的膀胱癌患者显示癌组织低分化,且预后情况不良[18]。此外,有研究表明,驱动蛋白家族另一成员KIF4 可以通过调控微管结合蛋白(Mitotic Centromere-associated Kinesis,MCAK)促进癌细胞抗药性的产生,而敲除KIF4 基因可以抑制癌细胞的增殖、迁移和侵袭,且进一步的动物模型研究证实了KIF4 基因敲除可以减慢肿瘤的发展速度[19]。作为KIF 家族成员之一,有研究表明,KIF2A 可以作为促癌基因,参与一些恶性癌症的发生与进展过程[10-12]。而有关KIF2A与结直肠癌患者肿瘤特征、预后关联,以及KIF2A 敲降对于结直肠癌细胞作用的相关研究尚少。
本研究通过IHC 检测结直肠癌患者癌组织及癌旁组织中KIF2A的表达水平,发现KIF2A在癌组织中的表达水平较癌旁组织更高。猜测可能的原因是:①有研究表明,KIF2A 可以调控染色体的运动、双极纺锤体、细胞有丝分裂等细胞核内活动[22],因而KIF2A的高表达可能导致染色体的突变、阻止DNA 的修复,从而导致结肠癌的形成。因此结直肠癌患者癌组织切片显示KIF2A 高表达。②KIF2A 基因可以通过激活PI3K/AKT/mTOR 通路[23],增强PI3K 内在激酶活性的突变,导致AKT 信号传导失调,影响PI3K/AKT 信号通路中关键编码基因如:AKT 的结构改变,导致细胞的癌变和肿瘤的发生,因此KIF2A在结直肠癌患者中显示高表达。
有证据表明,在一些癌症中,癌组织KIF2A 高表达与较差的肿瘤临床特征相关[12-13,24]。例如,癌组织KIF2A 表达与肺腺癌患者的TNM 分期和淋巴结转移征相关[13]。此外,在乳腺癌患者中,癌组织KIF2A 与淋巴结转移、乳腺癌远端转移、HER2阳性呈正相关[14,24]。本研究发现,KIF2A 与较大的肿瘤直径、淋巴结转移、以及较高的TNM 分期正相关。可能的原因包括:①根据既往报道,KIF2A 在卵巢癌中可通过靶向抑制抑癌基因微小RNA(miRNA)-206,促进癌细胞的增殖、迁移和侵袭,而miR-206在结直肠癌细胞中低表达,可抑制结直肠癌细胞增殖、迁移和侵袭。综合以上证据,我们猜测KIF2A可能通过与miR-206 的相互作用,促进结直肠癌细胞增殖、迁移和侵袭,进而与更差的肿瘤特征相关[12,24]。②此外,有研究表明,KIF2A可通过异常激活PI3K/AKT 通路,同时PI3K 表达量的升高可促使AKT 蛋白的磷酸化,导致AKT 的活化,进而启动其下游靶蛋白以及通路下游的级联反应,促进肿瘤细胞的异常增殖、存活、迁徙,造成患者较差的肿瘤特征[10,25]。除此之外,异常激活的PI3K/AKT 信号通路,可造成PIK3CA 蛋白表达量的异常升高,而PIK3CA 蛋白表达量的升高与结直肠肿瘤病人的不良临床特征相关,因此KIF2A与结直肠癌患者更差的肿瘤特征相关。此外,我们进一步探究了KIF2A在结直肠癌患者中作为预后标记物的潜能并发现,KIF2A 高表达是结直肠癌患者较差生存的独立预测因素。可能的原因包括:①KIF2A 可能通过异常激活PI3K 通路,导致PIK3CA 的突变和抑癌基因PTEN 表达的丢失,引起患者对于抗肿瘤药物的耐药性,使患者治疗应答变差,进而导致较差的预后[23,26]。②根据本研究结果,KIF2A 高表达与较差的肿瘤特征相关,因此KIF2A高表达的患者病情可能较为严重,导致预后情况较差。
进一步研究KIF2A 对于结直肠癌细胞影响的实验结果表明,在结直肠癌细胞中,敲降KIF2A 可抑制细胞增殖、侵袭,并促进细胞凋亡,但对细胞的迁移的促进作用并不显著。可能的原因包括:①敲降KIF2A 可能通过PI3K/AKT 信号通路,抑制结直肠癌细胞增殖和侵袭,促进凋亡。随后,本研究通过检测敲降KIF2A 对PI3K/AKT 信号通路上的PI3K和p-AKT蛋白水平的影响,验证了敲降KIF2A对于PI3K/AKT信号通路的抑制作用;②此外,敲降KIF2A 可能抑制上皮间质转化,从而抑制结直肠癌细胞的干性以及相关的PI3K/AKT 信号通路,削弱肿瘤细胞的恶性增殖和侵袭能力[25,27]。
本研究尚有一些局限性:①本研究是单中心、回顾性研究,结直肠癌患者来源较为单一,可能存在患者选择性偏移和地区限制。②本研究已排除包括:复发或者继发性结直肠癌、出现远端转移、有其他肿瘤史或有新辅助治疗史的结直肠癌患者,因而KIF2A 在这些患者中的预后作用需要进一步的研究。③由于患者大多是从外地到本院就医,因此他们的肿瘤复发时间很难准确计算,因此KIF2A与结直肠癌患者的无病发展期需要进一步的研究。④KIF2A 在结直肠癌中的作用需要选取更多的细胞株以及进一步动物模型进行验证。
综上所述,KIF2A 与结直肠癌的肿瘤特征以及不良预后相关,且敲降KIF2A 可抑制PI3K/AKT 信号通路的激活,从而抑制结直肠癌细胞恶性增殖、侵袭能力,表明其有成为结直肠癌标志物的潜能。

