PD-L1单克隆抗体联合双歧杆菌对小鼠胃癌的疗效观察
牛威,宋扬,信红月,张蕊,沈健,郭莲怡,杜霞霞
(1.锦州医科大学附属第一医院;2.锦州医科大学附属第三医院,辽宁 锦州 121000)
在消化系统的恶性肿瘤当中,胃癌是最常见的一种,近年来,我国的胃癌患者数量逐年上升,呈显著上升趋势,死亡率也极高[1-2]。当前在对实体肿瘤的治疗过程中,免疫治疗取得了突破性的成果,其中最有代表性的就是PD-1/PD-L1抑制剂单克隆抗体药物[3]。目前,美国食品药品监督局已经批准将PD-L1单克隆抗体药物阿特珠单抗(atezolizumab)用于治疗泌尿系统肿瘤[4]。尽管已经有研究证明PD-1/PD-L1单克隆抗体在肿瘤治疗中具有一定的有效率,但效率略低。因此寻求一种能够与其联合治疗肿瘤的方法是非常必要的。而目前已有研究表明,肠道菌群平衡在维持机体正常的免疫调节和粘膜屏障等功能方面均发挥着非常重要的作用,益生菌是维持肠道菌群平衡的重要组成细菌,双歧杆菌作为非常经典的益生菌,在促进人体的消化吸收和免疫应答的调节当中发挥着非常重要的作用[5]。已经有多项研究证实,双歧杆菌不但可以帮助缓解溃疡性结肠炎、抑制结肠癌的发生发展[6-7],还可以调节胃癌术后患者的肠道菌群平衡,在预防化疗副作用中也有一定的效果。本文旨在于进一步探究PD-1/PD-L1单克隆抗体与双歧杆菌联合后治疗胃癌患者的疗效,为临床对于胃癌的治疗和相关药物的研究提供理论依据。
1 资料与方法
1.1 材料
1.1.1 细胞株
人中分化胃腺癌细胞株SGC-7901购自中国科学院上海细胞库。
1.1.2 主要试剂
PBS缓冲液(北京索莱宝公司)、HE染色试剂盒(北京索莱宝公司)、免疫组化试剂盒(福州迈新生物技术有限公司)、PrimeScript TM RT reagent Kit with g DNA Eraser(TaKaRa)、RNA提取试剂盒(北京天根生物技术有限公司)、PD-1/CD279 Antibody(武汉三鹰生物技术有限公司)、PD-L1/CD274 Antibody(武汉三鹰生物技术有限公司)、CD8Antibody(武汉三鹰生物技术有限公司)、IgG抗体-HRP(武汉三鹰生物技术有限公司)、DMEM高糖培养基(Thermo)、1640培养基(Thermo)、优质胎牛血清(Thermo)、PVDF 膜(Thermo)、BCA 蛋白定量试剂盒(Thermo)、SDS-PAGE凝胶配制试剂盒(Thermo)、ECL发光检测试剂盒(Thermo)。
1.1.3 主要实验仪器与耗材
酶标仪(美国EXL800)、凝胶成像系统(美国Bio-Rad公司)、转膜仪(美国Thermo公司)、垂直板电泳仪(美国Thermo公司)、电泳电源(美国Thermo公司)、高速离心机(上海一恒)、ABI7000荧光定量PCR仪(美国Applied Biosystems公司)、光学显微镜(日本Olympus公司)、磁力搅拌器(德国IKA公司)、恒温培养箱(上海精宏实验设备有限公司)、制冰机(意大利Scotsman公司)、超净工作台(美国BioX科技有限公司)、CO2培养箱(美国Thermo)、水浴锅(上海一恒)。
1.2 方法
1.2.1 Western Blot
(1)蛋白质的提取:将裂解液置于室温融化并加体积1%的 PMSF,加入相应体积的样本,然后置于冰上继续静置 5 min,冷冻低温离心机,4 ℃,12 000 rpm,离心10 min,取上清于新1.5 EP管中,上清液为蛋白质抽提物;(2)蛋白质定量:将 0.5 μg/μL的BSA 蛋白标准液按照操作说明每孔分别为 0、1、2、4、8、12、16、20 μL,每孔用磷酸盐缓冲液补至体积为20 μL,制备蛋白质样本:取待测蛋白样本1 μL,用磷酸盐缓冲液补至体积为20 μL,实验每孔BCA 工作液体积为 200 μL,按照A∶B 液体积比 50∶1,每孔中加入配制好工作液,37 ℃反应 20 min,提前启动预热15 min酶标仪,读取波长 570 nm 处结果,记录数据,绘制标准曲线,通过回归方程计算,按标准蛋白浓度及对应吸光值然后乘以稀释倍数,得到样本的蛋白浓度;(3)SDS-PAGE:按照说明书配胶范围和目的蛋白分子量大小,选取 5%的浓缩胶,9%、15%的分离胶进行配制。首先配制分离胶,加入10%过硫酸钠、TEMED 混匀后,沿一侧玻璃板灌入并用水封闭上层,分离胶凝聚稳定后,弃掉上层液体,加入10%过硫酸钠、TEMED,沿一侧玻璃板灌入配制好的浓缩胶,插入梳子,等待 30 min 左右,即可使用,用PBS将样品稀释后,加入5×Loading Buffer 并用EP管密封,煮沸8 min。其中上样体积为20 μL,蛋白上样量为40 μg,将配好的电泳液倒入电泳槽,应每孔上样20 μL,Marker蛋白第1孔加5 μL,连通电极,注意正负极一一相对,电压60~80 V,恒定2.5 h;(4)转膜:将配置好的转膜液放入4 ℃冰箱预冷,在电泳结束前,用预冷的先配制好的转膜液充分浸润转膜用的滤纸、海绵等,PVDF膜用无水甲醇激活后,用DDW清洗5 min 浸入转膜液中,充分浸润,电泳结束后取出玻璃板,小心注意保证胶的完整性,切掉全部浓缩胶以及分离胶的底部,将剩余胶在转膜液中浸泡 10 min,开始转膜,80 V,1.5 h;(5)封闭:配置1×TBST缓冲液和5%脱脂奶粉(TBST稀释);取出PVDF膜,用TBST缓冲液摇床清洗5 min,一共3次,将PVDF膜浸入5%脱脂奶粉溶液中,摇床孵育1 h;(6)孵育一抗:将抗体按照1∶1000稀释,稀释液为1×TBST 缓冲液,将PVDF膜放入小盒中,加入稀释抗体工作液,置4 ℃孵育过夜;(7)孵育二抗:用无菌镊子取出孵育的 PVDF 膜,用 1×TBST 摇床清洗 5 min,一共清洗 3次;二抗稀释倍数为1∶5000,1×TBST 稀释;将PVDF膜放入小盒中,加入二抗稀释抗体工作液,37 ℃孵育1 h;(8)ECL 底物发光:取出 PVDF 膜,TBST 清洗 5 min,一共 6次,ECL 发光试剂盒显色,Image J软件分析灰度值,进行统计分析。
1.2.2 荧光定量PCR
1.2.2.1 提取总RNA
2.5 健康指导 向患者阐述与疾病相关的知识,提高对曼氏裂头蚴感染危害性的认识,说明食物除应具备的营养要素外,还应保证其卫生安全,防止有害因素引起的食源性疾病。首先,养成良好的个人卫生习惯,做到饭前便后要洗手,注意手的卫生是饮食安全的第一步。其次,养成良好的饮食卫生习惯,不吃不洁食物,不饮用生水等,防止病从口入。生、熟食要分开处理,烹调食物时,要充分煮熟,保持餐具清洁卫生。
(1)首先对操作台和相应设备进行无菌无酶处理,将等质量组织块的放入研钵中,快速充分研磨到组织充分变为粉末状,将上述充分研磨过后的、粉末状的肿瘤组织转移至装 EP 管中,EP管中已经装好Buffer RL裂解液,随后吹打至完全溶解;(2)将EP管放入4 ℃离心机中内,10 000 rpm离心10 min。移上清液到容积为1.5 mL的RNase Tube中;(3)将gDNA 去除核酸纯化柱在4 ℃的状态下进行12 000 rpm离心60 s,之后弃去gDNA 去除核酸纯化柱,保留滤液;(4)向收集管中加入相同体积的70%乙醇,混匀后,立即将混合液全部转移到RNA核酸纯化柱中;(5)同时将RNA梳酸纯化柱和收集管进行4 ℃、12 000 rpm离心1 min,弃掉滤液,吸取500 μL的缓冲液RWA(buffer RWA)于RNA核酸纯化柱中,4 ℃下12 000 rpm离心35 s,弃滤液;(6)吸取600 μL的缓冲液RWB至RNA核酸纯化柱中,4 ℃下12 000 rpm离心30 s,弃掉滤液,此步骤需重复2次;(7)将RNA核酸纯化物放在收集管中,4 ℃下12 000 rpm离心2 min,弃掉滤液,将RNA核酸纯化柱放在核糖核酸酶空白收集管(RNase free collection tube)上,向内滴加50 μL的无酶水,室温下反应5 min;(8)应用紫外线分光光度计测量RNA的浓度和OD值。
1.2.2.2 DNA逆转录反应
去c除基因组DNA反应:配制反应液,加入适量浓度的mRNA。依据所加RNA浓度推算出要加入的无酶水的体积,确保反应总体积是10.0 μL。将反应液放入42 ℃下反应2 min,见表1。
逆转录反应:配制混合液,吸取10.0 uL工作液至EP管内,EP管中已装有上步反应所制得的反应液,两者混合后,最终得到反应体系的混合液总体积应为20.0 μL 。将上述混合液均匀混合后,放置于普通PCR仪上,保证反应条件为:37 ℃、15 min,85 ℃、5 s,进行逆转录反应。待cDNA的成功合成后,进行下一步实验,见表2。

表2 逆转录反应混合液
1.2.2.3 设计与合成引物
在美国国家生物技术信息中心上检索到人PD-1、PD-L1和内参甘油醛-3-磷酸脱氢酶的基因序列后,由北京华大生物公司设计合成,见表3。
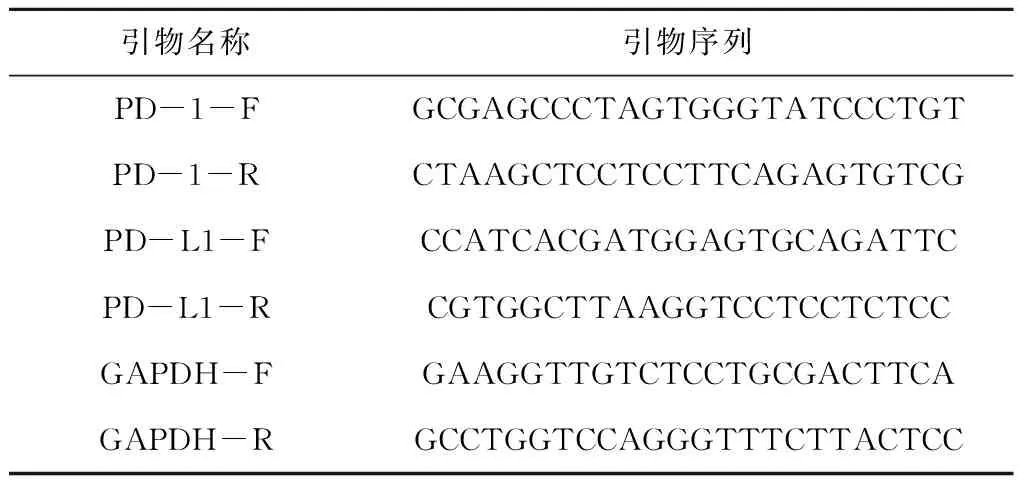
表3 引物序列
配置反应液:配制反应液,根据预实验确定引物浓度,通过调整无酶水的用量来保证反应体系的总体积为20.0 μL,见表4。

表4 PCR反应混合液
进行反应:(1)预变性:95 ℃、30 s、1 cycle;(2)PCR反应:95 ℃、5 s,60 ℃、30 s、35 cycles;(3)熔解反应:95 ℃、5 s,60 ℃、1 min、95 ℃、1 cycle;(4)降温:50 ℃、30 s、1 cycle。
1.2.3 成瘤实验
选取4周龄白变种实验室(BALB/C)裸鼠20只,体重为18~20 g,饲养级别为SPF级,自由饮水饮食。分为 SGC7901胃癌细胞皮下成瘤模型组、PD-L1单克隆抗体干预胃癌模型组、双歧杆菌灌服胃癌模型组、PD-L1单克隆抗体联合双歧杆菌干预及灌服胃癌模型组。
SGC7901胃癌细胞皮下成瘤模型组:将人胃癌细胞株SGC7901消化后,调整细胞浓度为2×107个/毫升;采用皮下注射的方式给模型组小鼠注射0.2 mL细胞悬液;PD-L1单克隆抗体干预胃癌模型组:分别在皮下成瘤后0、2、4、6天为该组小鼠腹腔注射抗PD-L1 200微克/只;双歧杆菌灌服胃癌模型组:在皮下注射成瘤10 d前,为每只鼠进行双歧杆菌菌液灌胃处理,剂量为1×109CFU/d;建模成功后继续每天进行灌胃处理;PD-L1单克隆抗体联合双歧杆菌干预及灌服胃癌模型组:分别于皮下成瘤后0、2、4、6天为小鼠行腹腔注射抗PD-L1 200微克/只。同时为该组小鼠每天进行双歧杆菌菌液1×109CFU/d灌胃处理。
各组小鼠于第21天时脱颈处死,取出肿瘤组织,称重、计算肿瘤体积。
1.3 统计学方法

2 结 果
2.1 PD-1和 PD-L1在各组小鼠中蛋白水平的检测
使用免疫印迹法对上述各组鼠肿瘤组织中PD-1和PD-L1蛋白质的表达水平进行检测,与皮下成瘤模型组比较,3个治疗组鼠肿瘤组织中PD-1和PD-L1的蛋白质的表达均降低(P<0.05)。其中PD-L1单克隆抗体联合双歧杆菌组肿瘤组织中的 PD-1和PD-L1的表达量降低最明显,具有统计学差异(P<0.05)。而两个单独治疗组的肿瘤组织中PD-1和PD-L1的表达水平不存在明显差异,见图1。
2.2 PD-1和PD-L1在各组小鼠中基因水平的检测
对3个治疗组鼠肿瘤组织中PD-1mRNA和 PD-L1mRNA的表达量进行检测,发现:与模型组对比,3个不同治疗组肿瘤组织PD-1mRNA和PD-L1mRNA的表达水平均低于模型组(P<0.05)。其中PD-L1单克隆抗体联合双歧杆菌组肿瘤组织中PD-1mRNA和PD-L1mRNA的表达量最低,统计学差异明显(P<0.05)。而两个单独治疗组的肿瘤组织中PD-1mRNA和 PD-L1mRNA的表达量无明显差异,见图2。
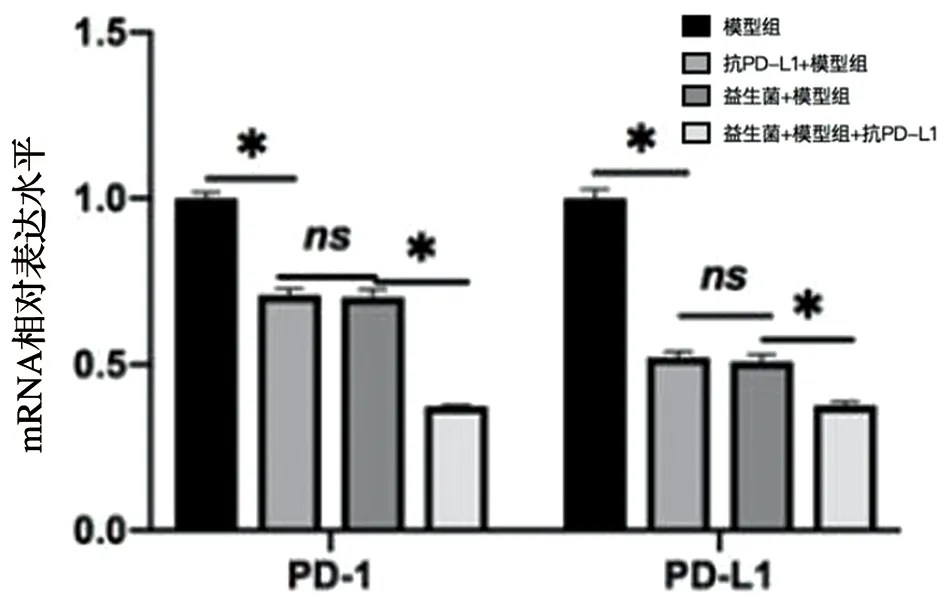
*代表与PD-L1单克隆抗体+双歧杆菌+模型组进行比较;ns代表单独给药组组间比较;*P<0.05
2.3 PD-L1单克隆抗体联合双歧杆菌对小鼠肿瘤增殖的影响
PD-L1单克隆抗体联合双歧杆菌组中小鼠成瘤的体积最小、重量最轻(P<0.05);二者单独应用,也同样在一定程度上抑制了肿瘤的增殖,但没有联合应用的抑制效果明显,见图3。

图3 PD-L1 单抗联合双歧杆菌对小鼠肿瘤增殖的影响
3 讨 论
癌是临床上高发的恶性肿瘤之一,具有持续的扩散和侵袭能力。全世界每年大约有几十万人死于胃癌[8]。近年来,胃癌在我国的发病率呈现逐年上升趋势,对胃癌患者进行统计分析发现,PD-L1在Ⅱ期和Ⅲ期的胃癌患者中均呈现高表达现象[9-10]。在肿瘤浸润性树突细胞、淋巴细胞、巨噬细胞中均呈现高表达现象,而与肿瘤相关的微环境也可诱导肿瘤细胞表达PD-L1[11-13]。PD-L1与肿瘤的免疫与发生关系非常密切,因此阻断PD-L1/PD-L1 对胃癌的发生发展至关重要[14-16]。双歧杆菌的细胞壁中含有完整肽聚糖(whole peptidoglycan,WPG)具有一定的抗肿瘤的作用[17]。有研究结果表明,WPG通过上调结肠癌HT-29细胞中促凋亡基因,下调抗凋亡基因,发挥细胞毒作用[18]。WPG具有促进肿瘤杀伤性效应分子分泌,增强巨噬细胞的活力和吞噬能力、促进B细胞分泌抗体等功能。
综上所述,本实验采用体内实验,首先应用胃癌细胞株进行鼠皮下成瘤实验,然后应用PD-L1单克隆抗体和双歧杆菌分别及共同干预及灌服成瘤小鼠,试验后发现:单独应用PD-L1单克隆抗体可以对胃癌产生一定的疗效,联合双歧杆菌后能够显著降低成瘤率、肿瘤体积和肿瘤重量,并在蛋白质和基因水平降低了肿瘤组织中PD-1和PD-L1的表达,效果更明显。
胃癌的免疫治疗已成为继手术、化疗后新的治疗手段,本研究通过PD-L1单克隆抗体和双歧杆菌联合应用于小鼠胃癌模型,发现可以增加小鼠胃癌的治疗效果,以后会逐步过渡到临床实验,为胃癌临床治疗提供理论依据,为延长胃癌患者的生命提供新的视角。

