尿促皮质素同源肽诱导乳大鼠心肌细胞肥大作用的比较
梁春光,黄雷,佟彤
(1.锦州医科大学护理学院;2.锦州市药品检验检测中心,辽宁 锦州 121000)
促尿皮质素(UCN)是在1995年新发现的一个神经肽,与UCNⅡ和UCNⅢ是促肾上腺皮质激素释放激素(corticotropin releasing factor,CRF)的家族成员,通过与CRF受体结合而发挥其生理作用。UCN能够与CRF受体1和2结合,而UCNⅡ和UCNⅢ与CRF受体2具有更高的结合能力。研究发现,UCN对心脏具有保护作用,是一个很重要的心血管活性肽[1]。UCN对心脏具有正性肌力作用、缺血再灌心肌的保护作用及促进心肌肥厚作用。而且大量实验也表明,UCN的心血管作用与细胞内Ca2+机制有关[2-3],而且Ca2+信号在心肌肥厚和基因表达发挥着重要作用[4-5]。有研究发现,L-型Ca2+通道阻滞剂维拉帕米能够抑制异丙肾上腺素(ISO)诱导的心肌肥厚[6]。本实验室曾经多次报道了不同药物对心肌细胞的肥大作用的作用机制[7-9]。而UCN同源肽诱导心肌细胞肥大与钙离子之间的关系鲜有报道。
心肌肥厚是高血压、心衰后心肌的一种代偿性表现,是心脏病人猝死的一种重要的危险因素,所以心肌肥厚的相关研究受到了学者的重视。本研究将进一步探讨尿皮质素同源肽诱导心肌肥厚可能的作用机制,通过比较尿皮质素同源肽诱导心肌细胞肥大,观察尿皮质素同源肽诱导心肌肥大与心肌细胞[Ca2+]i的关系。
1 实验材料与方法
1.1 药品与试剂
UCN,UCNⅡ,UCNⅢ及异丙肾上腺素(ISO)均为美国Sigma公司;十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、小牛血清、DMEM培养基、胰蛋白酶为杭州四季青生物工程材料有限公司;ANP一抗:Millipore公司;[3H]亮氨酸为上海原子核研究所产品;其他试剂均为分析纯。
1.2 实验动物
本实验由锦州医科大学实验动物中心提供的出生2~4 d的SD大鼠的乳鼠完成,实验动物雌雄不受限制。
1.3 心肌细胞培养
无菌环境下,将刚出生2~4 d的乳鼠心脏取出,然后放在Hanks液里面,反复冲洗3次,使用灭菌小剪刀迅速将心脏剪成小碎块,再使用胰酶(0.8 g/L)在磁力搅拌下消化分散细胞,将分散后得的心肌细胞加入含84%DMEM培养基和15%小牛血清的培养基中,培养基含有100 mg/L链霉素和1×100 Ku/L青霉素双抗。将细胞悬液经过反复吹打,吹打均匀后将细胞以1×109/L的接种密度接种于24孔培养板上,放入通以95%空气及5%CO2的孵箱中进行细胞培养。
1.4 分组及给药方法
心肌细胞常规培养2 d后,进行细胞换液,换液降低血清浓度是为了减少血清成分对实验结果的影响,更换的液体为含0.04% 小牛血清的培养基,培养基中按照实验分组加入各种浓度的试剂。实验分成正常对照组、ISO组(10 μmol/L)、UCN组(0.1 μmol/L)、UCNⅡ组(0.1 μmol/L)、UCNⅢ组(0.1 μmol/L)。各项指标的测定时间为给药后48 h。
1.5 培养心肌细胞体积的测量
通过测量细胞直径获得培养的心肌细胞体积。取出培养板,将长满心肌细胞的培养孔用D-Hanks液快速冲洗3次,然后每个培养孔中加入0.3 mL胰酶(1 g/L),将培养板再次放入37 ℃恒温箱中消化30 min,取出培养板终止消化,方法是在每个培养孔中加入0.2 mL含有0.1体积分数血清的培养基;将消化下来的细胞完全收集,注入底部放置一个经硅化的盖玻片的细胞室内,硅化的盖玻片可以防止心肌细胞贴壁;于倒置显微镜下观察细胞,显微镜放大400倍,心肌细胞均呈圆球形。测量单个细胞的直径,按照文献方法计算出单个细胞的体积,每组检测的细胞数见文献[9]65-68。
1.6 测定心肌细胞蛋白质的合成
将培养48 h 后已经成活的心肌细胞,更换培养基。培养基中含有37 TBq/L [3H]亮氨酸及不同浓度UCN等试剂。加药后再培养48 h 。弃去培养液,冷Hank液冲洗细胞3 遍。使用1 mL SDS(10 g/L)溶解细胞,使用三氯醋酸(50 g/L)沉淀蛋白。应用GF/C过滤,烘干滤膜,放置在含有体积分数为4×10-3PPO的二甲苯溶液的闪烁杯中。用液闪仪测量[3H] 亮氨酸的结合,分析蛋白的合成。每个孔的细胞计数及实验结果的表示见文献[10]。
1.7 测定心肌细胞蛋白质的含量
弃掉培养板各孔中的培养液,用D-Hanks液快速冲洗3次后,加入0.5 mL SDS(10 g/L)溶解细胞。每孔细胞计数约为5×105个,使用Lowry方法测定每孔心肌细胞的蛋白含量。
1.8 Western蛋白印迹法测定心肌细胞ANP的表达
细胞加药培养48 h后,取样备用。取出样品加入PMSF(10 g/L),超声裂解离心后取上清。应用BCA法测定蛋白浓度。上样缓冲液并煮沸。10 μL样品以及蛋白质标准物点样。垂直电泳3~5 h,转膜8~12 h;封闭,洗膜,稀释后的兔抗大鼠ANP(1∶200)室温反应2 h,二抗(1∶1500)反应1 h,显影剂显影。显影条带处理方式及实验结果表示方式见文献[9,11]65-68。
1.9 培养心肌细胞钙离子瞬间变化([Ca2+]i)的测定
将生长有自发性搏动的心肌细胞的盖玻片置于含有Fura-2/AM(3 μmol/L)的DMEM培养基中,在37 ℃水浴中避光孵育30 min后,取出盖玻片,用HEPES缓冲液冲洗。将盖玻片放于荧光显微镜下的灌流槽中,用恒温37 ℃灌流速度为1 mL/min 的HEPES缓冲液灌流,并按照指定时间于灌流液中加入实验用药。TiLL阳离子测定系统为测定仪器。激发光波长分别为340 nm及380 nm,300 ms为采样间隙。计算心肌细胞[Ca2+]i的方法见文献[12]。
1.10 统计学分析

2 结 果
2.1 UCN同源肽对心肌细胞体积的影响
与正常对照组相比,ISO、UCN、UCNⅡ及UCN Ⅲ组心肌细胞体积分别增加了56.6%、32.9%、57.8%和31.4%,与ISO的肥大作用相比,UCNⅡ心肌细胞体积增加的程度更大,增加了57.8%。UCN及UCN Ⅲ组心肌细胞体积增加的程度相似,都比ISO组弱一些。UCN同源肽中UCNⅡ作用最强,见图1。
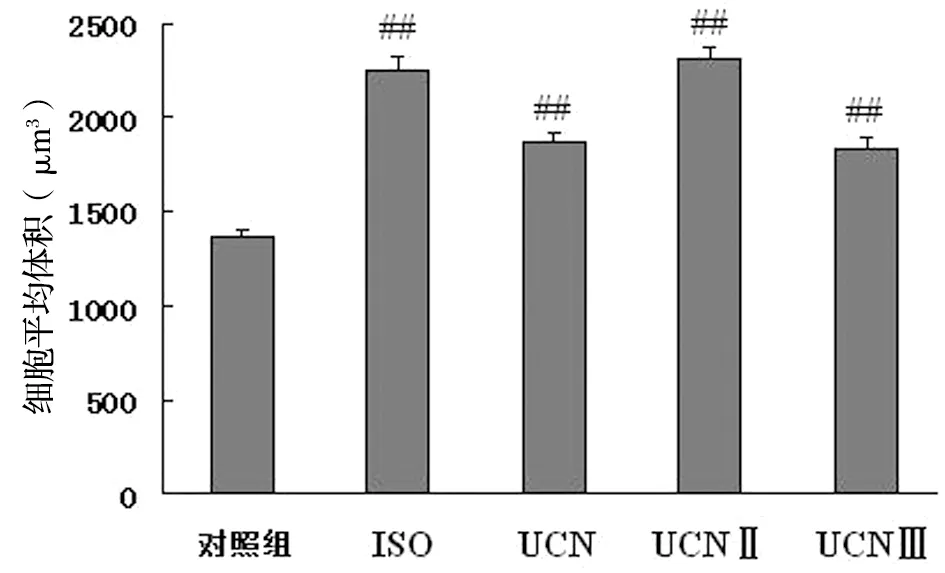
药物同时分别加入不同组别培养液中培养细胞个细胞;与对照组比较,##P<0.01
2.2 UCN同源肽对心肌细胞蛋白质合成的影响
与正常对照组相比,ISO、UCN、UCNⅡ及UCN Ⅲ组心肌细胞蛋白质合成分别增加了77.02%、39.8%、47.3%和38.4%。与ISO的肥大作用相比,UCN、UCNⅡ及UCN Ⅲ组心肌细胞蛋白质合成增加的程度相似,都比ISO组弱一些。UCN同源肽中UCNⅡ作用最强,见图2。
2.3 UCN同源肽对心肌细胞蛋白质含量的影响
与正常对照组相比,ISO、UCN、UCNⅡ及UCN Ⅲ组心肌细胞蛋白质合成分别增加了56.2%、33.3%、17.6%和30.3%。与ISO的肥大作用相比,UCN、UCNⅡ及UCN Ⅲ组心肌细胞蛋白质含量增加的程度相似,都比ISO组弱一些。UCN同源肽中UCNⅡ作用最强,见图3。
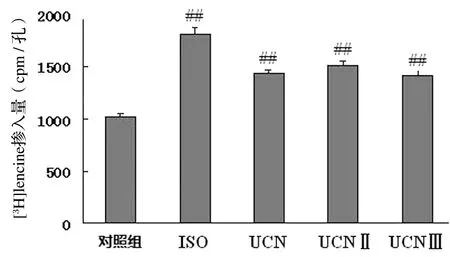
与对照组比较,##P<0.01
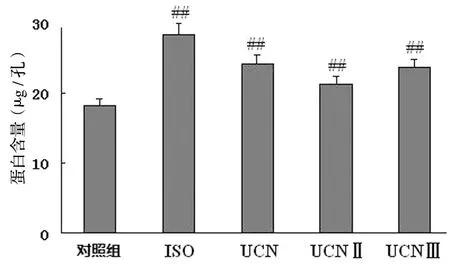
与对照组比较,##P<0.01
2.4 UCN同源肽对心肌细胞ANP表达含量的影响
与正常对照组相比,ISO、UCN、UCNⅡ及UCN Ⅲ组心肌细胞ANP表达含量明显增加了。与ISO的肥大作用相比,UCN、UCNⅡ及UCN Ⅲ组心肌细胞ANP表达含量增加的程度相似,都比ISO组弱一些。UCN同源肽中UCNⅡ作用最强,见图4。
2.5 UCN同源肽对心肌细胞[Ca2+]i瞬间变化的影响
ISO及UCN同源肽均未明显改变正常心肌细胞[Ca2+]i瞬间变化。ISO及UCN同源肽能够增高心肌细胞内钙离子瞬间变化的幅度,但是基线水平没有变化,增快了心肌细胞自发频率,对心肌细胞内静息钙的负荷均无影响,其中ISO的作用最强,见图5。
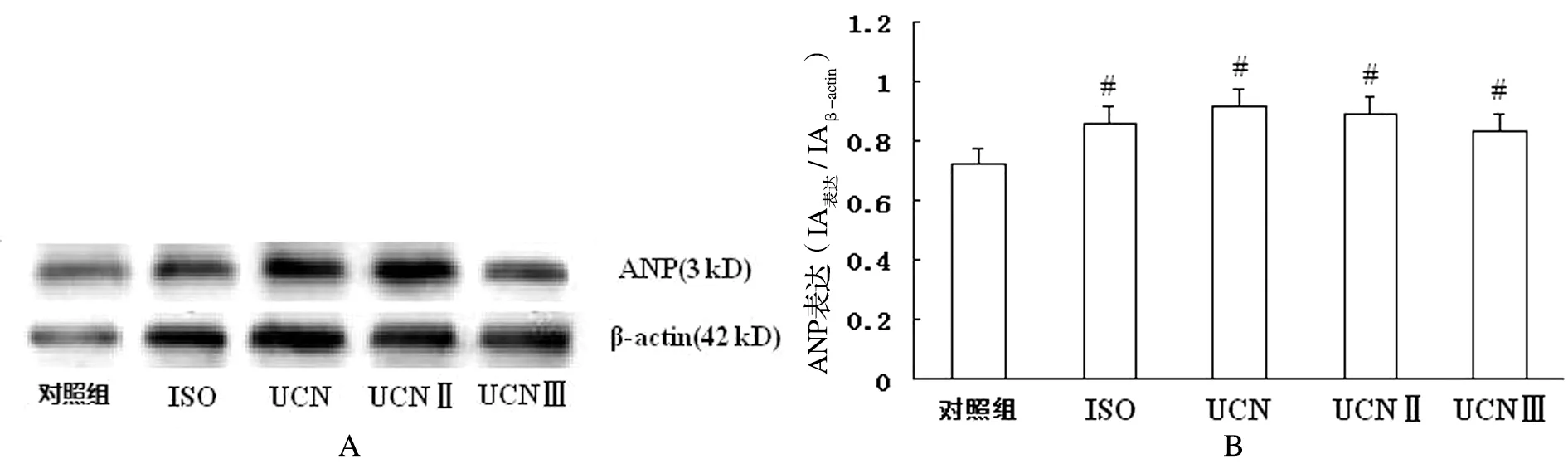
A:ANP蛋白表达和β-actin 蛋白表达;B:ANP/β-actin 半定量结果;与对照组比较,#P<0.05
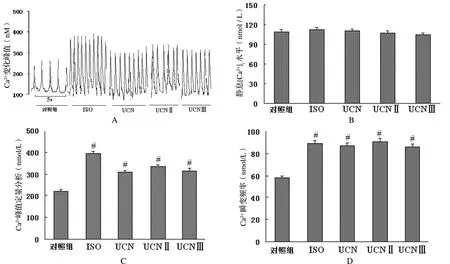
A:心肌细胞内代表性Ca2+变化曲线,UCN同源肽对静息[Ca2+]i 水平;B:Ca2+ 变化幅度;C:Ca2+的定量分析;D:频率,与正常对照组比较,#P<0.05
3 讨 论
心肌肥厚作用是心脏的一种很重要的调整机制,是心脏负荷过重时一种代偿表现,是心肌细胞对高血压、瓣膜病、急性心肌梗死等常见临床疾病的一种基本反应。以上心脏疾病的初始阶段,心脏通过平衡应激的增加改善心脏的功能使心肌肥厚,但是长时间的压力会导致心肌持续性增厚,最终心脏功能会严重失衡从而发生心力衰竭,因此成为心血管病患者死亡的重要原因之一。因此研究心肌肥厚发生发展过程中的信号转导机制和确定此作用中的调节因子非常重要。
许多研究已经表明,UCN同源肽是很重要的心血管活性肽。有研究说明UCN正性肌力作用的分子机制主要通过cAMP-PKA信号途径介导[13]。许多研究表明,UCN具有心肌的保护作用,这种保护作用可以通过MAPK p42/44[2]568-571、PI3K-Akt[14]、PKCε[15]等信号途径介导。许多研究已经表明,[Ca2+]i变化是心肌肥大的一个信号。多种钙调节酶传导不同的作用信号从而出现[Ca2+]i的改变,其中Ca2+/CaMK家族中的钙调素依赖蛋白激酶就是最重要的一种酶,在此过程中发挥重要作用[4,9]1314-1321,65-68。PKC是一种依赖Ca2+、磷脂的蛋白激酶,可以与Ca2+相互调节而达到基因表达和细胞增殖等长期反应。
异丙肾上腺素是一个公认的诱导心肌细胞肥大的试剂,本实验将UCN同源肽与异丙肾上腺素的致心肌细胞肥大作用进行比较,结果发现,在UCN同源肽中,UCNⅡ的致心肌细胞肥大作用最强,与文献报道[16]结果一致。
综上所述,UCN同源肽与异丙肾上腺素一样能够使心肌细胞内钙离子稳态发生变化。UCN同源肽使心肌细胞内钙离子瞬间变化幅度增高,但不影响基线水平,对心肌细胞内静息钙负荷均无影响,使心肌细胞自发频率加快,说明UCN同源肽致心肌细胞肥大可能通过影响细胞内钙离子稳态起作用。本实验室曾报道UCN可以通过影响蛋白激酶A信号途径,影响L-型钙通道改变心肌细胞内钙离子稳态起到致心肌细胞肥大作用[17]。但是对于UCNⅡ及UCNⅢ引起钙离子改变是首次研究。细胞内钙离子发生改变,可能由于细胞内钙释放还能是细胞外钙离子内流,但是UCN同源肽引起心肌细胞内钙离子改变的具体机制尚未明了,还需要具体研究。UCN同源肽致心肌细胞肥大的作用机制研究曾发现它们是通过不同的信号通路完成的,那么它们引起细胞内钙离子改变是否通过不同的机制尚需要研究。

