桥本甲状腺炎对甲状腺乳头状癌的影响
高嘉良,袁方均,武伦,高云龙,苟志敏
(1.锦州医科大学国药东风总医院研究生培养基地;2.湖北医药学院附属东风医院,湖北 十堰 442000)
甲状腺癌是目前威胁人类健康的重要原因之一,近几十年来甲状腺癌的发病率持续上升。甲状腺乳头状癌(PTC)是甲状腺恶性肿瘤中占比最大的病理学类型,约占整个甲状腺癌的70%[1]。根据一项调查研究显示,美国自1973—2002年甲状腺癌发病率上升了近2.4倍,其中PTC的患病率增加了2.9倍。根据此项数据,大致可认为甲状腺癌患病率上升主要是由于PTC患病率上升所导致。而其他病理类型的甲状腺癌,诸如髓样癌、滤泡状癌以及未分化癌等患病率并无明显上升趋势。
桥本甲状腺炎(HT)是常见的甲状腺良性疾病,经典的观点认为,桥本甲状腺炎多见于青年或者中年女性,患者多数无自觉症状,偶可出现颈部肿胀不适感,多在体检时意外发现。查体时,桥本甲状腺炎多表现为甲状腺双侧对称性肿大呈现为分叶状,质地较硬,无触痛。其病理表现为甲状腺组织中浸润有较多淋巴细胞,出现淋巴滤泡,甲状腺滤泡上皮细胞在病程晚期会出现坏死。早期可表现为一过性甲状腺功能亢进,至病程晚期可形成纤维化,最终引起甲状腺功能减退。本文旨在回顾性分析研究144例PTC手术患者的完整临床资料,进一步研究HT的存在对PTC发展及转移的影响。
1 对象与方法
1.1 对象
回顾性分析研究2017年1月至2019年6月湖北医药学院附属东风医院乳腺甲状腺外科经外科手术治疗的144例PTC患者的临床病理资料,术后的组织学病理报告均符合PTC的诊断标准。且确诊PTC的患者之中,共计46例患者病理报告符合HT诊断标准。
纳入标准:(1)患者病例资料完整清晰,包括详细病程、术前甲状腺彩超检查及术后病理报告;(2)首次确诊年龄18岁以上,术前未进行激素及药物治疗且未行碘131放疗、化疗或者微波、射频消融治疗以及手术治疗等任何治疗;(3)无原发性甲亢以及甲状腺疾患家族史;(4)既往体健,未罹患其他任何系统疾病。
排除标准:(1)年龄<18岁;(2)合并有亚急性甲状腺炎等其他良性甲状腺疾患;(3)病理证实为髓样癌、滤泡状癌或未分化癌等其他病理类型甲状腺癌或其他组织远处转移癌;(4)全身情况差,一年生存率评估较低者;(5)术前曾行甲状腺碘131放疗、化疗、激素治疗者;(6)患有基础性疾病或内分泌系统疾病以及任何全身性疾病。
1.2 方法
两组患者中,男性共31例,女性共113例,年龄为(45±6.35)岁。两组患者均符合本研究纳入标准,并且144例患者甲状腺组织均由病理科两位副主任医师确诊为PTC,46例患者确诊为HT伴有PTC。
1.2.1 手术方式
患者于术中行冰冻病理切片证实为PTC,随后进行全甲状腺切除+颈部Ⅵ区淋巴结清扫术。部分患者术前行超声引导下甲状腺穿刺活检术,经细胞学病理检查明确为甲状腺乳头状癌后,术中直接进行全甲状腺切除+颈部Ⅵ区淋巴结清扫。
1.2.2 研究指标
根据既往手术资料分别统计并分析两组患者性别、首次确诊年龄、最大病灶直径、病灶数量、包膜是否侵犯、颈部Ⅵ区淋巴结转移个数以及超声TI-RADS分级。通过分析对照组及实验组病灶最大病灶直径、个数及颈部Ⅵ区淋巴结转移个数,分析HT的存在对PTC生长,转移以及侵袭性的作用。
HT判定:甲状腺组织中浸润有较多淋巴细胞,出现淋巴滤泡,甲状腺滤泡上皮细胞在病程晚期会出现坏死,见图1。PTC判定:甲状腺病灶组织内出现大量恶性乳头分支,纤维血管组织位于癌性乳头之中,间质中伴有小的钙化灶[2],见图2。HT伴PTC诊断标准:癌细胞排列成乳头状,并以播散样分散于淋巴细胞浸润的甲状腺组织内。乳头状癌组织与淋巴细胞浸润的甲状腺组织中出现移行状态,滤泡上皮细胞过度增生并突变为乳头状癌细胞[3],见图3。PTC侵犯甲状腺包膜诊断标准:在光学显微镜下,甲状腺包膜出现明显的肿瘤侵犯或者肿瘤完全穿透包膜。

图1 桥本氏甲状腺炎(HE,10×)
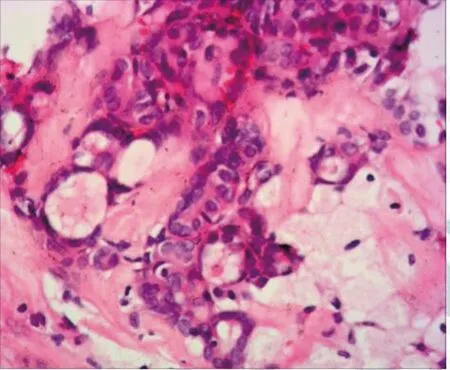
图2 甲状腺乳头状癌(HE,10×)

图3 HT伴PTC(HE,10×)
甲状腺彩色超声多普勒检查TI-RADS分类标准参照相关诊疗规范。其中,甲状腺彩色超声检查恶性结节的表现主要有以下几方面:边缘模糊不清,形态欠规则或者呈球形以及条带状,无声晕,未见血管。结构表现为实性低回声,内部可见微小钙化,结节内血流供应较为丰富。弹性成像表现为低弹性,可见异常淋巴结。
1.3 统计学方法
采用SPSS 23.0软件进行数据分析处理。对于不符合正态分布的计量资料采取中位数(四分位数间距)来进行标识,两组间比较采用t检验。计数资料采用χ2检验。以P<0.05为差异具有统计学意义。
2 结 果
与对照组相比,实验组中患有HT的PTC患者在性别分布以及年龄组成方面差异有统计学意义,见表1。对照组首次确诊年龄大于实验组(P=0.014),女性患病率显著高于男性(P=0.003)。与对照组相比,实验组患者甲状腺包膜被肿瘤侵犯几率更低(P=0.003)。实验组与对照组相比,超声诊断分级、最大肿瘤直径并无显著区别(P=0.058,P=0.069)。与实验组相比,对照组更容易出现颈部Ⅵ区淋巴结转移以及多中心病灶发展(P=0.040,P=0.031),见表2~3。

表1 对照组与实验组患者临床特征的比较[n(%)]
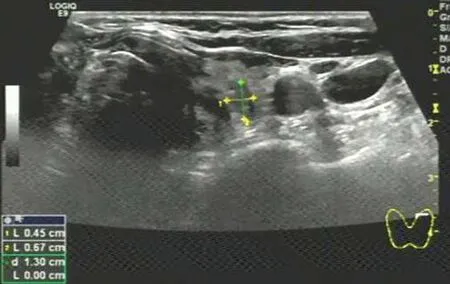
图4 Ⅳb类甲状腺结节超声

表2 两组患者颈部Ⅵ区淋巴结转移个数分布比较[n(%)]

表3 两组患者病灶个数对比[n(%)]
3 讨 论
Giagourta等[4]研究中,不曾发现HT的存在对甲状腺恶性肿瘤有任何影响。但其他专家的研究结论并不相同。其中Lee等[5]进行的Meta分析中,纳入的10 648例患者中,组织学研究表明PTC患者中伴有的HT共2471例。该研究显示HT与PTC之间存在某种联系。有研究[6]证明,相较于其他甲状腺良性疾病,HT更易并发PTC,这意味着HT的存在可能具有促进PTC生长的作用。既往曾有研究发现,基因的重组是影响PTC病程进展的重要因素之一。通常情况下,RET基因不表达,但在一定状态下RET基因与异体基因发生融合。融合后会被激活从而发生点突变,导致滤泡细胞RETTK的表达上调,引起致癌蛋白的高表达[7]。Ehlers等[8]实验表明,全部HT患者中均存在发生RET/PTC1和RET/PTC3重排现象。证明了RET基因重组通过特定的生物学调控路径调控HT与PTC。但目前国内外相关研究对HT伴发PTC是否影响患者的生长及预后尚存在争议。
本研究结果表明:PTC合并HT其侵袭性可能要低于单纯性PTC。对照组包膜侵犯以及患侧颈部Ⅵ区淋巴结转移明显高于实验组(P=0.040);对照组甲状腺包膜被肿瘤侵犯的机会明显大于实验组(P=0.003),因此推测PTC伴HT出现侵犯包膜现象可能更低。甲状腺恶性肿瘤包膜出现被肿瘤侵犯一般被认为是恶性肿瘤远处转移的重要标志,因此考虑实验组侵袭性可能更低。通过对照组与实验组颈部Ⅵ区淋巴结转移个数对比证实,与实验组相比,对照组更容易发生颈部Ⅵ区淋巴结转移(P=0.040),这可能预示着伴有HT的PTC患者颈部Ⅵ区淋巴结转移发生的几率低于单纯性PTC患者。颈部Ⅵ区淋巴结多为甲状腺恶性肿瘤发生转移的第一站淋巴组织。这一结果表明在PTC病程中,HT存在不仅没有促进肿瘤侵袭,相反可能起到了抑制肿瘤转移的作用。Ahn等[9]研究表明伴有HT对于PTC的临床生物学行为以及预后起到了保护作用。有研究认为HT合并PTC的患者淋巴结转移发生的概率会更低,TNM分期也会更早,从而获得较好的预后[10]。上述两项研究结果均与本研究结果相同。众所周知,恶性肿瘤发生淋巴结转移多为预后不佳的重要指标。有研究表明[11],单纯性PTC患者颈部Ⅵ区淋巴结发生转移的概率高于伴有HT的PTC患者,而预后以及五年生存率均明显低于伴有HT的PTC患者。有研究发现,Fas与Fas配体可以在HT中的卵泡细胞中一起表达[12-13]。所以,PTC并发HT可能是通过HT激活Fas通路来加速肿瘤细胞的凋亡,从而抑制病灶生长。另一原因可能为PTC合并HT有大量淋巴细胞浸润。而细胞毒性T细胞可分泌白细胞介素等细胞因子,这些细胞因子同时具有自然杀伤力或淋巴因子相关杀伤力,可直接或间接的限制肿瘤细胞的生长[14]。以上分析可能为实验组患者颈部淋巴结转移率较低以及TNM分期较早的原因,从而可以使患者获得较好的预后,揭示了HT可能对PTC患者起到了保护作用。Ahn等[9]1228-1234研究还证明:HT伴PTC患者比不伴PTC不伴HT的患者年龄小2~5岁,且存在明显的性别差异性。HT的病程中女性患者较男性患者更多并发PTC。可能为自身免疫性疾病与性别的关系更为密切,女性患者常见[15]。
综上所述,在PTC病程中,HT可以起到阻止淋巴结转移以及包膜侵犯的作用,从而影响了PTC正常进程,使患者获得较为理想的预后。但本实验存在不足之处,对照组与实验组最大肿瘤直径无统计学意义,与既往相关研究具有差异性,考虑为体检更加重视以及频繁,超声诊断较为精细,患者病程时间较短,多在疾病早期已进行干预。因此,接下来仍有必要从病理学、免疫学以及超声影像等方面进行进一步研究与探讨。

