miR-146a-5p在不明原因复发性流产蜕膜组织中的表达及其意义
冯玉婷,罗姝红,李兰,苏琴,程惊秋,叶红霞
自然流产(spontaneousabortion,SA)是指妊娠不 足28周、胎儿体质量不足1 000 g而发生的妊娠失败,而复发性流产(recurrent spontaneous abortion,RSA)是指与同一性伴侣发生连续2次或2次以上的自然流产,其发病率约1%~5%,临床上处理相对困难[1-3]。RSA病因复杂,除了目前已明确提出的染色体异常、自身免疫性疾病、生殖道解剖异常或感染、内分泌功能异常和血栓形成倾向等病因外,仍有约50%的病例病因不明,即不明原因复发性流产(unexplained recurrent spontaneous abortion,URSA)[4-5]。正常妊娠类似于成功的同种异体移植,母胎界面通过复杂而精细的调控机制维持局部微环境平衡;当各种因素导致母胎界面微环境失衡时,母体对胎儿产生攻击并触发分娩启动,如不及时阻止和修复,将增加流产风险[6]。因此,母胎界面微环境是探索URSA发病机制和治疗靶点的重要切入点。
微小RNA(microRNA,miRNA)是一类高度保守、长约22个核苷酸、能在胞质内以完全或部分互补形式与靶基因(mRNA)结合引起mRNA降解或翻译抑制、在转录后水平调控基因表达的非编码小RNA,调控人类基因组约1/3的基因,参与多种疾病的发生发展[7]。近年有研究报道,miR-146a-5p在树突状细胞(DC)、自然杀伤(NK)细胞、巨噬细胞等多种细胞中均有表达,参与多种生理病理过程[8-9]。母胎界面主要由蜕膜、绒毛等结构组成,富含丰富的滋养层细胞、蜕膜细胞及免疫细胞(包括NK细胞、巨噬细胞、DC等),但目前很少有研究报道miR-146a-5p在URSA母胎界面的作用及机制。因此,本研究旨在探索miR-146a-5p在URSA蜕膜组织中的表达并分析和验证其潜在作用机制,以期为后续探索基于miRNA的URSA防治策略研究提供新的思路和干预靶点。
1 对象与方法
1.1 研究对象选取2019年1—12月在成都西囡妇科医院(我院)因URSA行清宫术患者(URSA组)及因无生育计划行人工流产术的正常妊娠者(正常妊娠组)各10例。URSA组纳入标准:①年龄<35岁,与同一性伴侣发生连续≥2次的自然流产,本次流产孕周6~12周;②无足月分娩史,本次妊娠期间未接受免疫调节剂、抗凝药物等保胎治疗;③排除夫妻双方外周血染色体异常,清宫术后绒毛染色体检查无异常;④女方无生殖道发育异常或感染、无高凝倾向、无内分泌检查异常、自身免疫抗体阴性、TORCH检查阴性;⑤男方精液检查无异常。正常妊娠组纳入标准:①年龄<35岁,妊娠孕周6~12周,B超提示宫内胚胎发育正常;②既往无自然流产、早产、妊娠期高血压疾病、胎盘早剥、生育异常胎儿等不良孕产史;③无内分泌疾病、心血管疾病等病史;④本次妊娠无生育计划,自愿行人工流产术终止妊娠。本研究已通过我院伦理委员会审核[批件号:(2019)生殖伦审(016)号],所有研究对象均知情并签订知情同意书。
1.2 方法
1.2.1 蜕膜组织收集及处理利用无菌负压吸引瓶收集流产组织并用磷酸盐缓冲液(PBS)洗去表面血污,分离出蜕膜组织。将蜕膜组织一部分迅速放入液氮中速冻并保存在-80℃用于后续基因和蛋白检测;剩余部分浸泡于10%中性福尔马林固定液中固定4~6 h,然后常规梯度乙醇脱水、二甲苯透明、浸蜡和包埋,用于后续免疫组织化学分析。
1.2.2 实时荧光定量聚合酶链反应(qRT-PCR)取人正常妊娠及URSA组蜕膜组织,Trizol法提取RNA,取0.2μL RNA溶液加入核酸蛋白定量仪中检测浓度及纯度,取1μg RNA使用Vazyme HiScriptⅡQRTSuperMix for qPCR试剂盒按说明书逆转录为cDNA。引物序列由上海生工生物工程有限公司设计并合成(见表1),用25μL体系在RT-PCR仪上进行反应,反应条件为95℃、5min,40个循环(95℃10s,60℃30s,72℃30s),95℃15 s,使用Bio-Rad CFX96荧光定量PCR仪进行检测,以β-actin为内参基因,采用2-△△Ct相对定量法计算基因相对表达量。检测miR-146a-5p表达时,使用MicroRNA纯化试剂盒(Norgen)按照说明书提取总miRNA,逆转录后取10 ng(5μL)进行qRT-PCR反应,以小核RNA(snRNA)U6为内参基因,采用2-△△Ct相对定量法计算miR-146a-5p相对表达量。

表1 PCR引物序列
1.2.3 miR-146a-5p靶基因及分子调控网络分析
1.2.3.1 同源性分析利用USCS(http://genome.ucsc.edu/index.html)和NCB(Ihttps://www.ncbi.nlm.nih.gov/pubmed)基因组在线浏览工具检索miR-146a-5p在人类基因组中的位置并进行同源性分析。
1.2.3.2 潜在靶基因预测利用miRDB(Cut-off值设定为90)、miRmap(Cut-off值 设 定 为90)、PicTar、TargetScan和DIANA microT-CDS(阈值设定为0.9)5个在线数据库预测miR-146a-5p的潜在靶基因。为保证结果的可靠性,仅取在至少3个数据库中同时预测到的靶基因进入后续分析。
1.2.3.3 Gene Ontology(GO)基因功能富集分析以上一步得到的靶基因为研究对象,通过物种和基因信息,利用GO数据库查找靶基因的GO注释信息,并据此选择智人种(Homo sapiens)所在基因作为背景基因,以P<0.05为显著性阈值得到相对于背景具有统计学意义的GO高频率注释,包括细胞组件(cellularcomponent,CC)、分子功能(molecular function,MF)和生物过程(biological process,BP)3个部分。
1.2.3.4 Kyoto Encyclopedia of Genes and Genomes(KEGG)基因通路富集分析利用生物学通路数据库(http://www.genome.jp/kegg)在线预测这些靶基因所富集的信号通路,利用DAVID数据库中Fisher Exact Test计算KEGG通路的P值,以P<0.05为显著性阈值得到相对于背景具有统计学意义的基因富集信号通路。
1.2.3.5 基因编码功能蛋白之间相互作用(protein-protein interaction,PPI)分析利用STRING在线数据库分析并绘制miR-146a-5p预测靶基因编码蛋白质之间的PPI,选取设定物种为智人种(Homo sapiens),组合得分(combined score)>0.9(highest confidence)的相互作用被认为是显著的。
1.2.4 免疫组织化学染色将石蜡包埋的蜕膜组织做6μm切片,常规脱蜡,3%过氧化氢溶液封闭15 min、5%胎牛血清封闭20 min。EDTA抗原修复液微波加热处理后,一抗工作液IRAK1(Abcam,1∶50)、CD80(Abcam,1∶50)37℃孵育1 h。滴加二抗工作液37℃孵育30 min,滴加DAB工作液显色,待显色至棕黄色终止。苏木素复染,氨水返蓝,梯度乙醇脱水,树胶封片。使用Zeiss正置显微镜观察并拍照,计算每200×视野下阳性染色细胞百分比(DAB染色阳性细胞数/每视野下细胞总数×100%),每张切片选取5个200×随机显微视野计算平均值。
1.2.5 蛋白质印迹(Western blotting)将各组蜕膜组织剪碎,RIPA细胞裂解液(碧云天)提取总蛋白,BCA蛋白含量检测试剂盒(Pierce)测定总蛋白浓度。各组取等量蛋白样品,SDS-PAGE电泳对蛋白进行分离,然后转膜、封闭,加对应的TRAF6(Abcam,稀释比例为1∶1 000)、SORT1(Bimake,稀释比例1∶500)和β-actin(ABclonal,稀释比例为1∶2 000)一抗溶液,4℃孵育过夜。洗涤后加入辣根过氧化物酶标记的二抗(北京康为世纪生物科技有限公司),37℃孵育1 h。充分洗涤后,采用高敏化学发光试剂盒进行显影后胶片曝光。利用ImageJ软件对条带进行灰度值分析并以β-actin为内参计算蛋白相对表达量。
1.3 统计学方法利用SPSS22.0软件进行统计学分析,定量资料以均数±标准差或M(P25,P75)表示,采用Kolmogorov-Smirnov和Shapiro-Wilk检验其正态性,2组间比较采用两独立样本均数的t检验或Mann-Whitney U检验;定性资料以例数表示,组间比较采用χ2检验;相关性分析采用Spearman检验。P<0.05为差异有统计学意义。
2 结果
2.1 2 组一般情况及蜕膜组织miR-146a-5p表达水平比较除流产次数外,2组一般情况差异无统计学意义(P>0.05),具有可比性。URSA组蜕膜组织中miR-146a-5p表达水平低于正常妊娠组(P<0.001),见表2。
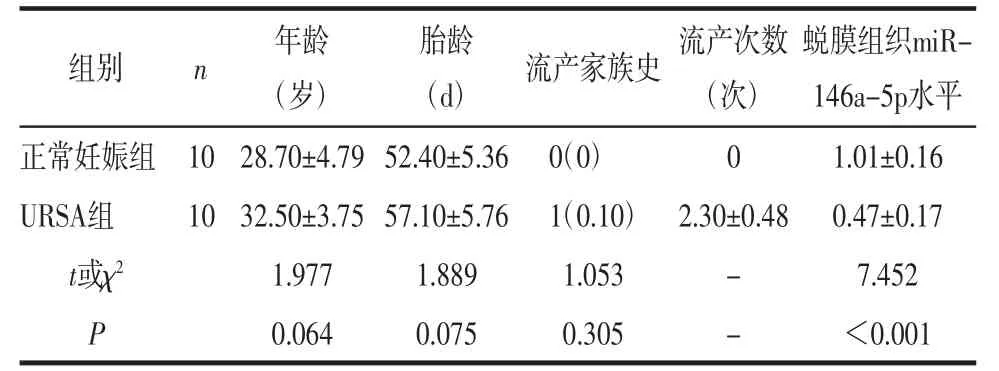
表2 2组基本情况及蜕膜组织miR-146a-5p表达水平比较
2.2 miR-146a-5p靶基因预测结果人miR-146a-5p的基因ID为MIMAT0000449,成熟链序列为UGAGAACUGAAUUCCAUGGGUU,在各物种中高度保守(见表3)。在miRDB、miRmap、PicTar、TargetScan和DIANA microT-CDS数据库中预测的miR-146a-5p靶基因数分别为122、705、130、283和415个,见图1。为保证靶基因的可靠性,筛选出至少3个数据库均预测的靶基因共35个(见表4),用于后续分析。
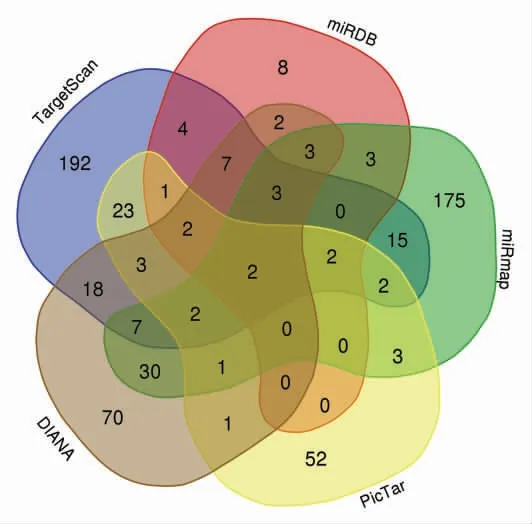
图1 各数据库预测到的miR-146a-5p靶基因数量及交集示意图

表3 不同物种miR-146a-5p基因ID及成熟序列
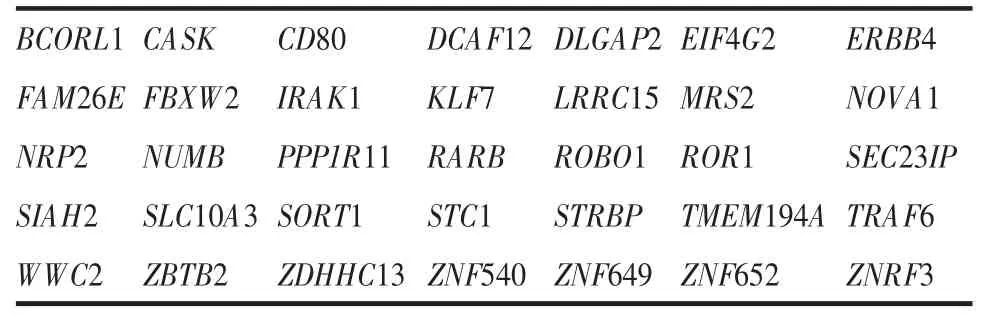
表4 至少3个数据库均预测到的miR-146a-5p靶基因
2.3 miR-146a-5p预测靶基因功能富集分析结果GO基因功能富集分析发现,miR-146a-5p预测靶基因主要位于细胞质、基底外侧质膜、内体膜等细胞结构中,发挥泛素蛋白转移酶活性、镁离子跨膜转运蛋白活性、连接酶活性等分子功能,参与轴突导向、凋亡过程负调控、白细胞介素1(IL-1)介导的信号通路等生物过程,见图2。KEGG通路富集分析结果见表5,miR-146a-5p预测靶基因主要富集于Toll样受体(toll-like receptor,TLR) 和神经营养素(neurotrophin,NT)信号通路。富集于TLR信号通路的预测靶基因包括IRAK1、CD80和TRAF6,富集于NT信号通路的预测靶基因包括IRAK1、SORT1和TRAF6,相关信号通路分子网络见图3和图4。利用STRING数据库分析发现,miR-146a-5p预测靶基因编码的功能蛋白之间存在3对PPI关系(见图5)。
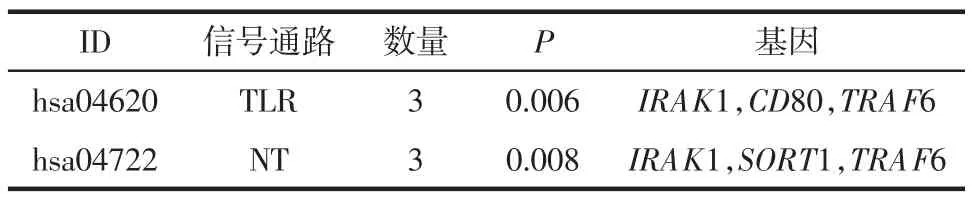
表5 miR-146a-5p预测靶基因KEGG通路富集分析结果
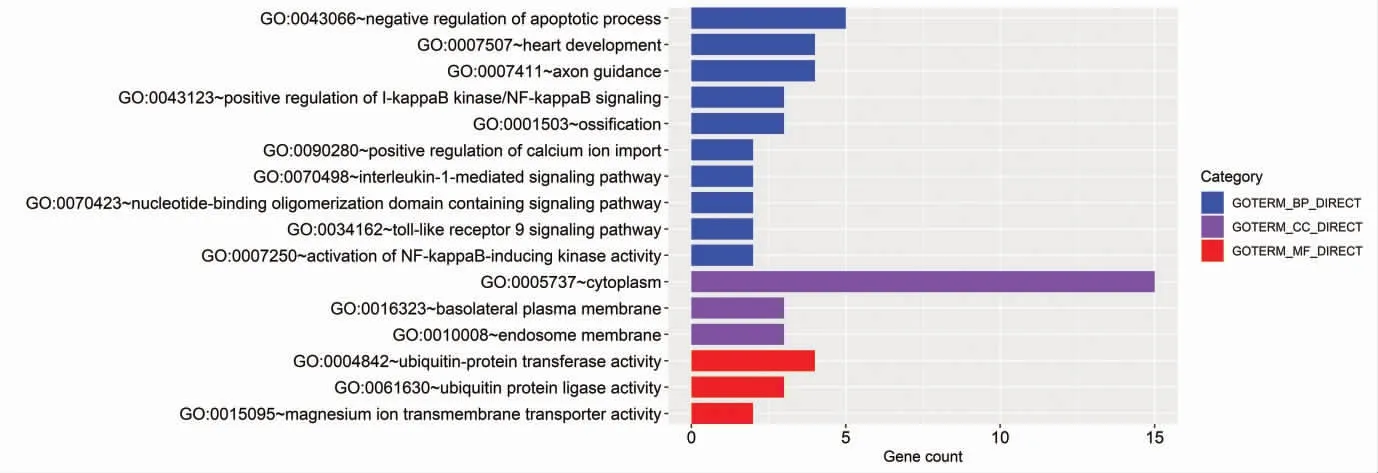
图2 miR-146a-5p预测靶基因GO功能富集分析结果

图3 TLR信号通路示意图

图4 NT信号通路示意图

图5 miR-146a-5p预测靶基因编码蛋白之间相互作用关系
2.4 miR-146a-5p预测靶基因在2组蜕膜组织中的表达水平及相关性URSA组蜕膜组织中IRAK1、CD80、TRAF6和SORT1基因表达水平均高于正常妊娠组(P<0.05),见表6;URSA组蜕膜组织IRAK1和CD80免疫组织化学染色阳性率、TRAF6和SORT1蛋白相对表达量也高于正常妊娠组,差异均有统计学意义(P<0.05),见表7、图6A和6B。进一步相关性分析发现,蜕膜组织中miR-146a-5p水平与IRAK1、CD80、TRAF6和SORT1的基因和蛋白水平均呈负相关(P<0.05),见图6C。

表6 2组蜕膜组织IRAK1、CD80、TRAF6和SORT1基因表达水平比较
表7 2组蜕膜组织IRAK1、CD80、TRAF6和SORT1蛋白表达水平比较 (±s)

表7 2组蜕膜组织IRAK1、CD80、TRAF6和SORT1蛋白表达水平比较 (±s)
SORT1蛋白相对表达量正常妊娠组 10 5.61±2.06 5.93±1.62 0.10±0.04 0.11±0.03 URSA组 10 61.88±11.44 47.38±6.36 0.48±0.08 0.39±0.07 t 15.314 19.962 13.981 12.550 P<0.001 <0.001 <0.001 <0.001组别 n IRAK1阳性率CD80阳性率TRAF6蛋白相对表达量
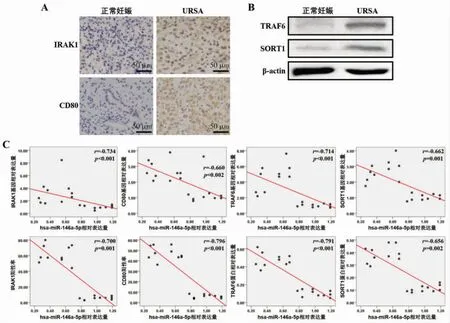
图6 miR-146a-5p预测靶基因在正常妊娠及URSA蜕膜组织中的表达水平比较及相关性分析
3 讨论
URSA的病因和发病机制目前仍无法解释,现有治疗策略存在争议且疗效不满意,近年来miRNA在母胎界面的表观遗传调控作用受到越来越多的关注[10-11]。表观遗传(epigenetics)是不涉及DNA序列改变的可遗传基因表达变化,其三大机制包括DNA甲基化修饰、组蛋白修饰及miRNA调控[12]。据估计,人类基因组约1/3的基因受miRNA调控,而miRNA表达及功能异常参与多种疾病的发生发展,近年研究报道多种miRNA参与异常妊娠的病理过程[13],如miR-184在RSA患者蜕膜中高表达并通过促进滋养层细胞凋亡诱导流产[14];miR-103通过抑制M1巨噬细胞极化阻止RSA发生[15];miR-30e有助于构建母胎界面免疫耐受微环境等[16]。miR-146a-5p是第一个被发现具有免疫调节作用的miRNA,作为一种炎症抑制因子参与多种生理和病理免疫调节过程,与风湿性关节炎/心脏病、系统性红斑狼疮、微生物感染等多种疾病相关,同时还在细胞增殖、分化、迁移和凋亡过程中起重要作用[17-18]。本研究发现miR-146a-5p在URSA蜕膜组织中的表达低于正常妊娠蜕膜组织,这与Zhao等[10]研究结果一致,表明miR-146a-5p降低与URSA发病密切相关。然而,蜕膜组织中miR-146a-5p在URSA发病机制中的作用及分子调控网络目前很少有研究报道。
先天免疫细胞表达各种模式识别受体,其中TLR家族是最具代表性的类型,并且高度保守[19]。既往研究报道TLR在母胎界面的蜕膜免疫细胞中也有表达,从而参与胎儿着床和分娩过程中的免疫和炎症活动,比如TLR4可通过调节性T细胞引起URSA;TLR1~9可诱导先天免疫应答和细胞因子产生[20];巨噬细胞分泌的细胞因子(如IL-12、IL-18)可通过TLR信号通路激活NK细胞;Th1细胞可被TLR2信号激活并释放γ干扰素(IFN-γ)[21];激活DC中TLR1、TLR2、TLR6等活性可促进促炎性细胞因子[如IL-6、IL-10、IL-12和肿瘤坏死因子α(TNF-α)]分泌[22]。据报道,TLR信号通路的异常激活可通过多个下游分子调控多种疾病发生发展,而该通路中多个关键分子均受miRNA调节[10]。既往研究报道,miR-146-5p可通过调节TLR信号通路对基于单核细胞的内毒素诱导的交叉耐受发挥重要的调控作用[23]。然而,目前很少有研究报道URSA发病机制中miR-146a-5p与TLR信号通路调控的关系。
IRAK和TRAF是TLR的下游调节分子,在TLR信号通路中发挥重要作用,而既往研究在口腔癌中发现IRAK1和TRAF6均为miR-146a-5p的靶基因,过表达miR-146a-5p可下调两者的蛋白表达[24]。同时,miR-146a可以通过靶向TRAF6和IRAK1来调节DC凋亡和细胞因子合成[25]。本研究利用生物信息学方法筛选出35个miR-146a-5p的潜在靶基因,其中IRAK1、CD80和TRAF6富集于TLR信号通路,调控下游多种炎性因子(如IL-1β、IL-6、IL-12、IFN-α等)介导的促炎、趋化和T细胞刺激等作用。本研究结果表明,URSA蜕膜组织中IRAK1、CD80和TRAF6的基因和蛋白水平均低于正常妊娠组,并且与miR-146a-5p的水平呈负相关(P<0.05),这表明蜕膜组织存在miR-146a-5p和TLR信号通路之间的表观调控机制。由于蜕膜组织中含滋养层细胞、蜕膜细胞及免疫细胞等多种细胞,本课题组目前正在进行miR-146a-5p在蜕膜组织中各类细胞中的表达及作用相关实验研究,期待后续能提供更详细的分子机制。
NT是脊椎动物神经系统发育必不可少的蛋白质家族,主要包括神经生长因子(nerve growth factor,NGF)、脑源性神经营养因子(brain-derivedneurotrophic factor,BDNF)、神经营养蛋白3(neurotrophin 3,NT3)和NT4等。近年有研究报道NGF通过黏附分子依赖性途径介导小鼠流产[26]、体外受精-胚胎移植后BDNF循环浓度降低与胚胎植入失败相关[27]、妊娠应急会对母鼠海马的NT系统产生负面影响从而降低海马的可塑性等[28],但少有研究报道miR-146a通过NT信号通路对URSA发生发展的调控作用及机制。本研究发现miR-146a-5p预测靶基因中,IRAK1、SORT1和TRAF6富集于NT信号通路并参与细胞凋亡和细胞生存调控,这3个基因编码蛋白之间也存在相互作用。同时,URSA蜕膜组织中IRAK1、SORT1和TRAF6的基因和蛋白水平均低于正常妊娠组,并且与miR-146a-5p的水平呈负相关(P<0.05)。这些结果初步提示了miR-146a-5p介导的NT信号通路参与URSA发生发展,本课题组后续研究中将进一步在体外和体内通过功能获得(gain of function)和功能缺失(lossof function)相关实验来验证miR-146a-5p通过NT信号通路调控URSA发生发展的具体分子机制。
综上,本研究通过体外实验初步证实了蜕膜组织中miR-146a-5p可能通过其下游TLR信号通路和NT信号通路调控URSA发生发展,进一步丰富了URSA发病机制,并为后续URSA防治策略研究提供了新的思路和靶点。后续研究中本课题组将在体外体内更深入地研究miR-146a-5p对URSA母胎界面微环境的调控作用及其在URSA防治策略中的应用。

