琼脂糖酶产生菌的筛选和培养基优化
李 静, 杨邵岚, 黄 琳, 管政兵, 蔡宇杰, 廖祥儒*
(1.江南大学 生物工程学院,江苏 无锡 214122;2.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122)
琼脂是从红藻加工中获得的多糖,由具有杂合结构的半乳聚糖家族构成,组分为琼脂糖和琼脂胶[1]。琼脂糖是接近中性的多糖,是由1,3糖苷键连接的β-D-半乳糖(G)和由1,4糖苷键连接的3,6-内醚-α-L-半乳糖(LA)残基重复交替连接成的线性多糖分子,因其具有稳定性和凝胶特性而受到广泛应用,例如作为食品添加剂、生物能源的原料、微生物生长培养基、糖果以及琼脂果冻[2]。琼脂胶的半乳聚糖主链上常有硫酸酯基团等其他基团,并结合着钙、镁等无机元素[3]。
琼脂糖酶由琼脂分解细菌产生,帮助琼脂解聚,将其降解成低聚合度的寡糖中间体,再继续通过反应进行能量转化[4-5]。琼脂糖酶是生物研究领域的基本工具,可以从琼脂糖凝胶中回收脱氧核糖核酸(DNA)条带[6],更是制备寡糖和降解红藻细胞壁的重要工具酶,用于提取具有抗氧化等活性的生物质[7-8]。基于裂解模式,琼脂糖酶分为α-琼脂糖酶和β-琼脂糖酶。目前研究的琼脂糖酶多来源于海洋微生 物, 包 括 弧 菌 属 (Vibrio)[9]、 交 替 单 胞 菌 属(Alteromonas)[10]、假单胞菌属(Pseudomonas)[11]、不动杆 菌 属(Acinetobacter)和 链 霉 菌 属(Streptomyces)等[12]。而这些菌株所产琼脂糖酶活性低,降解琼脂或琼脂糖的能力普遍不高,如韩尧跃等[13]2015年分离的产琼脂糖酶弧菌Ag-1,其发酵上清液酶活为7 U/mL;而张静雅等[14]获得的海洋弧菌HN897,酶活仅为0.41 U/mL;2018年,刘婷威等[15]对获得的菌株Agarivorans albus RZW1-1进行发酵优化,得到最高酶活为23.02 U/mL。由于现有琼脂糖酶存在活性、稳定性和生产率低等缺点,使得这些酶在工业生产中很少使用。迄今只有Sigma-Aldrich有限公司的β-琼脂糖酶应用于生产,1 kU费用为1 854.4元,价格十分昂贵,所以目前仅用于科研[16]。
太岁作为一种大型混菌复合体,常以纤维素、几丁素、甲壳质为营养[17-18]。作者从太岁中筛选得到了多株产琼脂糖酶的菌株,开展了菌种鉴定及初步优化发酵条件的实验,为非海洋来源琼脂糖酶的开发,进一步实施琼脂糖酶基因的克隆表达及放大发酵等做了基础研究。
1 材料与方法
1.1 材料
1.1.1 样品 太岁样品由作者所在实验室保藏。
1.1.2 主要试剂和仪器 酵母粉、蛋白胨、碘化钾、碘、D-半乳糖、3-5二硝基水杨酸、NH4SO4、K2HPO4·3H2O、MgSO4·7H2O、琼脂粉:国药集团化学试剂有限公司产品;琼脂糖(BiowestAgarose):无锡特达生物技术有限公司产品;柱式细菌基因提取试剂盒:天恩泽基因科技有限公司产品;2×Taq酶等PCR相关试剂:大连TaKaRa公司产品;pH计:奥豪斯仪器有限公司产品;凝胶成像系统:Biorad公司产品;PCR仪、电泳仪:Biorad公司产品。
1.1.3 培养基与常用储备液
1)筛选 培 养 基(g/L):Agar 15、(NH4)2SO42、K2HPO4·3H2O0.5、NaCl 0.2、MgSO4·7H2O0.02;pH为7。
2)摇瓶发酵培养基(g/L):Agar 2,(NH4)2SO42、K2HPO4·3H2O 0.5、NaCl 0.2、MgSO4·7H2O 0.05、FeSO4·3H2O 0.02、CaCl20.01;pH为7。
3)种子培养基:同摇瓶发酵培养基。
4)种子液的制备:用接种环轻蘸单个菌落,接种至种子培养基,30℃、150 r/min过夜培养即为种子液。
5)DNS试剂:3,5-二硝基水杨酸3.15 g,在500 mL蒸馏水中溶解并搅拌,水浴至45℃,在溶液中按次序加入NaOH 20 g、酒石酸钾91 g、无水亚硫酸钠2.5 g、苯酚2.5 mL,搅匀,降至常温后定容到1 000 mL,放入棕色试剂瓶避光密封,室温下放置7 d后使用,6个月内有效[19]。
6)底物溶液:琼脂糖溶于pH为7的磷酸盐缓冲液,使其终质量浓度为0.5 g/dL,煮沸溶解后放置在40℃保温。
1.2 方法
1.2.1 菌种的筛选 取1 g太岁样品加入10 mL无菌水后于小型料理机中搅碎处理,将处理后的样品稀释后涂布于筛选培养基平板上,30℃培养箱培养2 d,为防止卢氏碘液对细胞造成损伤,先标记筛选培养基上长出的单菌落并于新的平板上划线,后在原平板上倾倒卢氏碘液,挑选原平板中有较大透明圈的菌落,将其对应的新平板放入培养箱继续培养。转接入有50 mL发酵培养基的250 mL锥形瓶中,30℃、150 r/min培养40 h,离心取上清液测酶活,选取540 nm处吸光度最高的细菌保存并鉴定。
1.2.2 菌株的鉴定
1)将菌株在平板上划线至出现单个菌落,观察其形态,革兰氏染色后观察菌体细胞特征。
2)16S rRNA基因序列的PCR扩增和序列比对。利用柱式细菌基因组DNA提取试剂盒,提取全基因组作为PCR模板DNA。扩增引物选用细菌鉴定通用引物:正向引物27F:5′-AGAGTTTGATCC TGGCTCAG-3′,反向引物1492R:5′-GGTTACCTTG TTACGACTT-3′。
PCR反应体系(50μL):2×Taq酶溶液25μL,DNA模板1μL,上下游引物各1μL,ddH2O 22μL。扩增程序:94℃预变性3 min,94℃变性1 min,55℃退火30 s,72℃延伸1 min,30个循环;72℃延伸10 min。取5μL扩增样品进行电泳检测,结果呈阳性(条带大小正确)的样品送至天霖生物科技(无锡)有限公司测序。测得序列结果利用NCBI的BLAST程序做同源性比对,选取比对后一些相似的菌株序列,运用MEGA5.0的Neighbor-Joining(NJ)法构建系统发育树。
1.2.3 酶活的测定 粗酶制备:4℃、8 000 r/min离心10 min取发酵上清液。
实验组为200μL发酵液加入200μL质量浓度0.5 g/dL的琼脂糖底物,对照组在此基础上再加入400μL DNS试剂,对粗酶液进行钝化处理。两组分别混匀后在40℃下反应30 min,实验组加入DNS试剂停止反应,煮沸5 min,冰水降温后定容至5 mL。以对照组作为参照,测定其在540 nm处的吸光度,根据标曲确定反应产生的还原糖质量。
琼脂糖酶的酶活定义:依照上述前提,每分钟产生1μg还原糖所需的酶量作为一个酶活单位U。酶活力以U/mL表示。
1.2.4 菌株的生长曲线和产酶曲线 将体积分数2%的种子液加入发酵培养基,30℃、150 r/min培养,间隔5 h取发酵液,以其在600 nm下的吸光度、发酵上清液的酶活力制作菌株的生长曲线和产酶曲线。
1.2.5 菌株产琼脂糖酶的发酵优化 采用单因素方法依次调整培养基的碳源、氮源及无机盐质量浓度。选取琼脂粉、葡萄糖、可溶性淀粉、乳糖与琼脂糖(均为0.2 g/dL)作为碳源,探究不同碳源对菌株产酶的影响。确定最合适的碳源后,探究菌株产酶与碳源的添加质量浓度之间的关系。优化碳源后,选择牛肉膏、蛋白胨、NH4NO3、(NH4)2SO4及酵母粉(均为0.2 g/dL)作为氮源,进一步探究氮源的不同是否影响菌株产琼脂糖酶。确定最佳氮源后,根据预实验结果,确定K+、Mg2+及Ca2+为3种实验因素(金属离子添加形式分别为:K2HPO4·3H2O、MgSO4·7H2O、CaCl2),以浓度2 mmol/L和5 mmol/L为变量设计了8组实验(见表1),从而确定产琼脂糖酶的最佳发酵培养基。
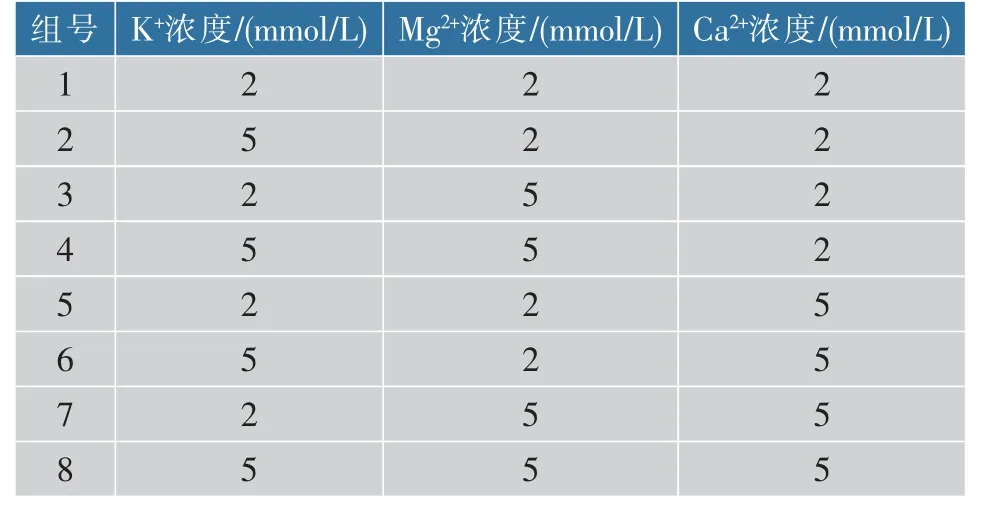
表1 无机盐浓度优化Table 1 Optimization of the concentration of inorganic salts
1.2.6 数据分析及绘图 所有实验采用至少3个重复,在此基础上采用SPPSV13.0软件进行统计分析。使用Origin 8.5软件进行绘图。
2 结果与分析
2.1 菌株的筛选与鉴定
利用琼脂糖酶筛选培养基,从太岁样品得到几株产生明显透明圈的菌株。经过初筛纯化及摇瓶复筛之后,发现编号为P1的细菌产酶能力较强,初始酶活达到10.08 U/mL。将其作为目的菌株进行下一步研究。按照分子生物学的方法得到16SrRNA基因一段长1 425 bp的DNA,将得到的DNA利用NCBI网站的BLAST进行比对,结果显示编号为P1的菌株序列与气味类芽孢杆菌(Paenibacillus odorifer)的一致性超过99%。构建系统进化树显示P1与Paenibacillus odorifer DSM 15391(T)在同一分支的置信度为77%,所以将其鉴定为类芽孢杆菌属(见图1)。

图1 Paenibacillus sp.P1的16Sr RNA进化树分析Fig.1 16S r RNA phylogenetic tree analysis of Paenibacillus sp.P1
单个P1菌落在筛选培养基上是白色半透明圆形、表面平整、边缘规则的短杆状细胞,呈革兰氏阴性。经生理生化鉴定,该菌具有固氮能力,既不能利用明胶,也无法水解纤维素(见表2)。
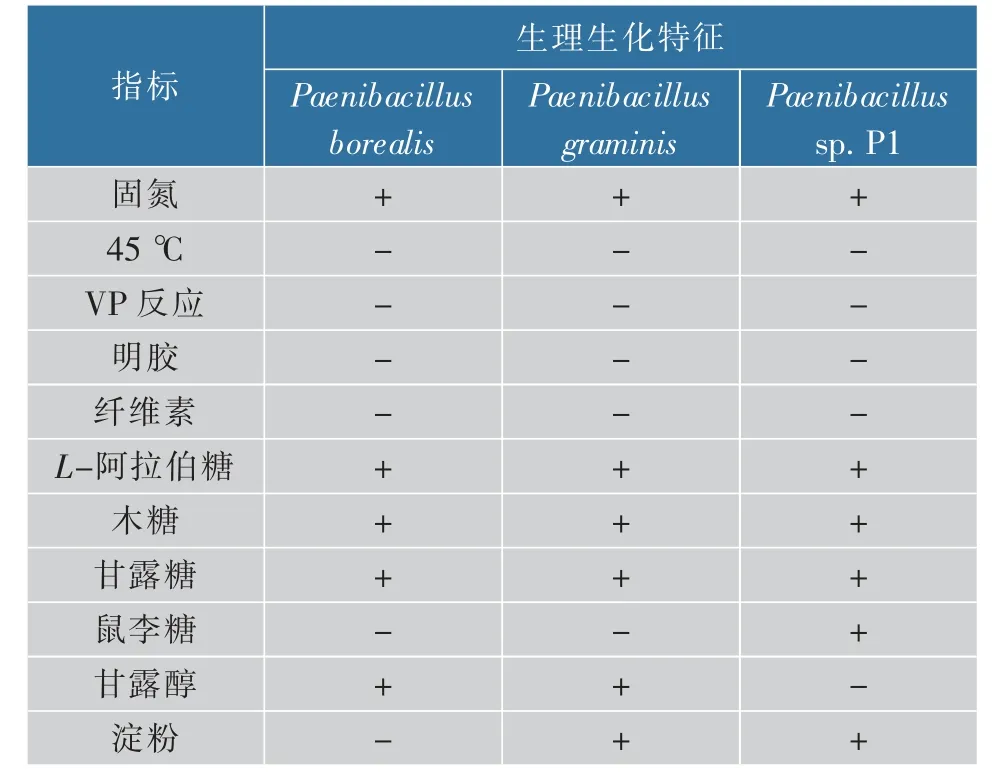
表2 Paenibacillus sp.P1生理生化鉴定Table 2 Physiological and biochemical identification of Paenibacillus sp.P1
2.2 菌株的生长和产酶曲线
利用发酵培养基在30℃培养60 h后,绘制菌株的生长及产酶曲线(见图2),发现菌株在1~10 h时,生长缓慢,此时产酶量非常低。而在10~25 h期间,菌株属于快速生长期,生物量剧增且酶量也逐步上升。之后P1进入生长稳定期,此时生物量增长减缓,在35 h左右生物量有下降趋势,但相应酶活依然在增加,在40 h时达到最高值。之后菌种的生物量得到短暂回升后继续降低,酶量也随之减少。因此可判断P1的最优发酵时长为40 h,此时琼脂糖酶酶活为10.1 U/mL。

图2 Paenibacillus sp.P1的生长曲线和产琼脂糖酶曲线Fig.2 Growth curve and agarase-producing curve of Paenibacillus sp.P1
2.3 碳源对菌株产酶的影响
选取琼脂粉、葡萄糖、可溶性淀粉、乳糖与琼脂糖(均为0.2 g/dL)作为碳源进行实验,其他成分与发酵培养基中一致。30℃培养40 h测酶活(碳源质量浓度的优化与此步操作一致)。如图3(a)所示,在以葡萄糖、可溶性淀粉和乳糖作为碳源时,P1的琼脂糖酶产量较低,而以琼脂粉和琼脂糖作为碳源时,琼脂糖酶的酶活虽相差不大,但琼脂粉更能促进酶活升高。两者的区别在于琼脂粉中琼脂胶占比更高,结合琼脂胶的结构以及后续实验中金属离子的浓度优化结果,猜测是琼脂胶上的基团对酶活提高起了促进作用,所以进一步的碳源优化实验选择琼脂粉作为碳源。图3(b)中当琼脂粉质量浓度不超过0.3 g/dL时,酶活随着培养基中琼脂粉质量浓度的增加而增加,最高可达到16.9 U/mL,而当琼脂粉质量浓度在0.3~0.5 g/dL时,酶活随琼脂粉质量浓度升高而下降,因琼脂粉中的琼脂糖具有凝胶功能,猜测是琼脂粉质量浓度升高,使反应液黏稠,导致菌株生长过缓,酶活下降。

图3 碳源种类及琼脂粉质量浓度对Paenibacillus sp.P1产琼脂糖酶的影响Fig.3 Effects of carbon source species and agarose concentration on agarase production by Paenibacillus sp.P1
2.4 氮源对菌株产酶的影响
选择0.3 g/dL的琼脂粉作为最佳碳源后,以质量浓度均为0.2 g/dL的牛肉膏、蛋白胨、NH4NO3、(NH4)2SO4及酵母粉作氮源,考察氮源种类与琼脂糖酶活力大小的联系。结果如图4所示,在选取的5种氮源下,P1都能产生琼脂糖酶,但考虑到菌株本身的固氮能力,通过实验只能得出的结论是以蛋白胨作为氮源时,菌株产酶最多,此时的酶活达到22.7 U/mL。

图4 氮源种类对Paenibacillus sp.P1产琼脂糖酶的影响Fig.4 Effects of nitrogen source species on agarase production by Paenibacillus sp.P1
2.5 无机盐浓度对菌株产酶的影响
在优化碳源、氮源及一些基础发酵条件后,酶活提升到原始酶活的2倍以上。而产琼脂糖酶的发酵培养基中有不少无机盐成分,所以进一步通过改变组分中的金属离子浓度探究其对菌株产酶的影响。结果见图5,第6组酶活最高,此时K+、Mg2+及Ca2+的浓度分别为5、2、5 mmol/L。当培养基中K2HPO4·3H2O与CaCl2的浓度升高时,P1的酶活有所提高,其中Ca2+对酶活提升有明显促进效果,而Mg2+浓度的增加则导致了酶活的降低。可能随着SO42-添加浓度的增加,与Ca2+发生了结合,导致了Ca2+的减少,使得Ca2+的促进作用被减弱,造成琼脂糖酶活力减弱,Ca2+浓度的高低对琼脂糖酶活的影响明显,可能与琼脂糖酶的结构中有Ca2+结合位点有关。
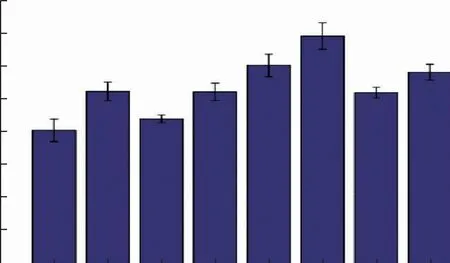
图5 金属离子浓度对Paenibacillus sp.P1产琼脂糖酶的影响Fig.5 Effect of metal ion concentration on agarase production by Paenibacillus sp.P1
3 讨论
我国的藻类资源十分丰富,但目前的开发利用产品多是以生产琼脂作为化工及医药等原料出口,不仅附加值低,对环境也有污染。而通过琼脂糖酶水解琼脂或琼脂糖可以高效获得琼脂寡糖[20],琼脂寡糖具备抗氧化活性[21]、保湿美白、抗炎及抑制淀粉降解[22]的作用。关于琼脂糖酶产生菌的筛选和重组琼脂糖酶的研究虽然很多,但尚没有可以应用于工业的酶产品,且目前国内主要研究海洋来源细菌及其产生的琼脂糖酶。作者从太岁中分离得到3株产琼脂糖酶菌株,其中编号为P1的菌株产酶能力较强。通过生理生化及分子生物学鉴定,确定该菌株为气味类芽孢杆菌(P.odorifer)。国内尚未见有P.odorifer产琼脂糖酶的报道,关于类芽孢杆菌的琼脂糖酶基因的研究也相对较少。国外报道中,Hosoda等从菠菜根际土壤中分离得到几株产琼脂糖酶的Paenibacillussp.,这些菌株优先存在于根部而不是土壤,符合根瘤菌的特性,并且它们都具有多种细胞外琼脂糖[23];Song等筛选到一株产琼脂糖酶的菌Paenibacillussp.SSG-1,并通过菌株的全基因组测序得到琼脂糖酶基因的序列[24]。
4 结 语
作者筛选获得的Paenibacillussp.P1可以利用琼脂作为唯一碳源,属于非海洋来源的类芽孢杆菌属,说明其含有将琼脂糖水解成单糖的琼脂糖水解酶体系,并且可能包含多种琼脂糖酶,因此具有极大的开发潜力。实验测定并绘制了该菌的生长及产酶曲线,其最佳产酶时间为培养40 h。通过对培养基的碳源、氮源及无机盐浓度等因素的初步优化,获得其最适发酵培养基(g/L):Agar 3、蛋白胨2、K2HPO4·3H2O 1.0、NaCl 0.3、MgSO4·7H2O 0.05、FeSO4·3H2O 0.02、CaCl20.04(pH为7)。在最适发酵培养基中发酵40 h测定P1的琼脂糖酶酶活,该菌株的最高酶活达到34.7 U/mL,酶活提高为原来的3.4倍,为菌株放大培养和后续的琼脂糖酶应用提供了基础。为了对类芽孢杆菌的琼脂糖酶进行更深入的研究,将考虑对菌种P1进行全基因组测序,挖掘出菌株中所有与琼脂糖水解相关的酶的基因,进行克隆表达或进一步对基因进行改造,以获得酶活力更高、稳定性更好等性质更优良的琼脂糖酶,从而进行更为全面的研究。后续实验也将以此为方向展开,期望得到关于类芽孢杆菌所产琼脂糖酶的具体生物信息,补充非海洋来源的琼脂糖酶信息,对比类芽孢杆菌所产琼脂糖酶之间的异同。另外可将一种或几种琼脂糖酶联合应用于藻类转化,生产单糖以及琼脂寡糖等,促进藻类资源的有效利用,将资源向高附加值产品转化,为琼脂糖酶的研究及藻类资源转化提供更多方向。

