呕吐毒素降解微生物的研究进展
唐语谦, 刘晨迪, 潘药银, 杨继国*
(1.华南理工大学 食品科学与工程学院,广东 广州 510640;2.华南协同创新研究院,广东 东莞 523808)
呕吐毒素因其可导致猪呕吐拒食而获名,又名脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON),是由镰刀菌属产生的毒性代谢产物,近年在全球谷物、粮食制品及饲料中出现频率最高,具有细胞毒性、神经毒性和免疫毒性等[1],严重威胁人和动物的健康,已成为食品安全的首要衡量指标。DON主要存在于染赤霉病的小麦中,而赤霉病在全国各地的作物中频发,因此DON检出率居高不下。2016年,赤霉病害流行,河南西华和江苏建湖的发病小麦分别达100%和69.96%[2-3]。2017年,国内各地区玉米副产物和全价料中DON检出率高达100%,小麦及麸皮和玉米副产物中DON超标率分别为10.67%和6.67%[4]。2018上半年,小麦赤霉病全国见病面积达37.5%[5],原料及饲料中DON检出率达100%[6-7]。随着科技的发展和人类对于食品安全的日趋重视,如何高效安全地去除DON,从而解决污染问题成为研究的热点。
传统的物理和化学方法虽然都可以在一定程度上去除DON,但是存在能耗高、安全性低和破坏谷物营养特性等缺点,远远不能满足粮食生产与加工的需要。而生物降解法因其具有毒性低、污染小、速度快、特异性强、安全性高、残留少或无残留及对饲料营养物质无损伤等优点更受研究者的青睐。DON虽然可于1 h内,在250℃下被完全降解,但是该温度用于降解粮食中的毒素不切实际[8]。辐照和臭氧处理也可降解DON,饱和臭氧水10 min内对小麦中DON的降解率达74.86%[9],但其降解效率对载体的依赖程度较高且安全性存疑。冯敏等采用5 kGy的60Co-γ射线辐照散装大米(DON质量分数为112.5μg/kg),降解率仅为38.4%[10]。
DON的结构复杂,环氧基团、C3位羟基和C16位甲基是其主要的毒性结构。通过改变DON分子结构,例如C12、C13位脱环氧化,C3位羟基的乙酰化、异构化、糖基化以及氧化和C16位羟基化等[11],可生成不同类型的DON衍生物,进而减弱或去除毒性[12]。DON的C3位羟基乙酰化、异构化、糖基化分别生成3-keto-DON、3-epi-DON(几乎无毒)和DON3G,与DON相比毒性均较低,但口服DON3G后水解为DON可能导致总毒性增强[13]。另外部分基团的转化反而导致毒性升高,它们的体外毒性排序为15ADON≥DON>3ADON>DOM-1[14]。环氧基团通过与核糖体连接影响蛋白质合成[15],DON脱环氧化形成的DOM-1无细胞毒性。
由此可见,DON的降解脱毒是一个复杂过程,仅靠一个或一种酶难以完成,彻底脱毒仍需多种酶共同作用。目前国内外关于DON降解酶基因的文献报道很少,开发降解酶投入市场,还需要对其进行分离纯化,并对酶的蛋白质序列进行空间结构分析,进一步研究酶学性质以及效应物对酶活性的影响等[16],单个酶的应用仍道阻且长。因此,目前直接利用微生物降解DON更具可行性。作者从各类可降解DON的微生物入手进行归纳总结,重点分析比较了其转化方式和产物毒性,以期为将来单个或混合菌种、单个酶或多个酶的应用奠定基础。
目前,国内外对于生物降解DON的研究有了一定进展,但是与分离出来的单菌株种类相关的文献报道不多,主要为细菌,有芽孢杆菌属、德沃斯氏菌属、诺卡氏菌属等(见表1)。关于DON降解酶的分离提纯及其基因外源表达的研究报道更是少之又少。
1 细菌的降解
1.1 芽孢杆菌属(Bacillus)
芽孢杆菌是一类可产芽孢的革兰氏阳性菌,对外界不良因素的抵抗力强,分布较广,具有增殖快、抗逆性强、稳定性强等特点。研究者已从霉变秸秆[17]、土壤[18]、被污染的玉米[19]或食用霉菌污染饲料的母鸡粪便[20]中,筛选到蜡样芽孢杆菌、枯草芽孢杆菌、地衣芽孢杆菌和环状芽孢杆菌等,均可在72 h内降解饲料中质量分数73.50%~98.85%的DON,实现高效降解,但是其代谢产物及毒性都未得到验证。其中,马秋刚发现的枯草芽孢杆菌ANSB471传代能力稳定,能分泌高活力的淀粉酶,提高动物对饲料的利用率[21];郭倩倩筛选的地衣芽孢杆菌YB9不仅具有耐盐耐高温、抗逆性较好的优点,而且经动物实验验证,可减弱DON对动物的毒性[18];有研究报道了环状芽孢杆菌对热的稳定性以及对pH的耐受性强[20]。
此外,芽孢杆菌作为益生菌中常见的菌属,在禽畜业发挥着重要作用。不仅可以促进免疫器官生长发育,增强非特异性和特异性免疫,而且可促进红细胞免疫,从而提高动物的免疫功能[22]。芽孢杆菌还具有产腈水合酶的潜能。从农田土壤中分离得到阿氏芽孢杆菌(Bacillus aryabhattai)Jn-102,所产酶对芳香腈有较好的水合作用,可用于制备酰胺化合物[23]。此外,地衣芽孢杆菌和枯草芽孢杆菌可产碱性蛋白酶,在碱性条件下水解蛋白质肽键。该酶在制药、食品、洗涤剂等工业中被广泛应用,并且国内相关研究已达到分子水平[24]。
1.2 德沃斯氏菌属(Devosia)
德沃斯氏菌为需氧型革兰氏阴性菌,不产芽孢。不同于对芽孢杆菌的研究仅停留在DON降解效率上,德沃斯氏菌的降解机制(见图1)研究得更为深入和透彻。目前大部分菌株分离自土壤或受镰刀菌感染的植物,可将DON的C3位羟基氧化或异构化,其降解酶及基因也已明确。这些菌株均可在48 h内降解液体培养基中质量分数88%以上的DON[25-28],其中DDS-1[25]和ANSB714[26]在饲料中的降解率分别为75.47%和86.19%。
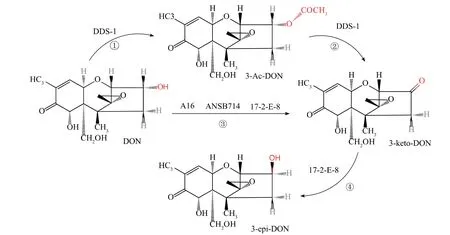
图1 德沃斯氏菌的降解途径Fig.1 Degradation pathway of Devosia
这些菌株的生物降解产物和机理相似。除德沃斯氏菌17-2-E-8可产生3-epi-DON外[27],其余3种菌株的最终产物都为3-keto-DON[25-26,28]。研究表明,德沃斯氏菌17-2-E-8先将DON氧化成毒性较低的3-keto-DON,再将其还原成3-epi-DON。有研究者[29-30]从该菌中克隆了参与降解反应的基因DepA和DepB。这两个基因分别属于乙醇脱氢酶和醛酮还原酶超家族,都需要辅酶参与才能完成催化反应。德沃斯氏菌17-2-E-8的DepB是第一个被克隆的参与DON C3—OH异构化的基因。另外3种菌株不能产生3-epi-DON,可能由于它们都缺乏一种特异性还原3-keto-DON的酶。其中,德沃斯氏菌ANSB714和A16的具体降解途径还未得到验证;德沃斯氏菌DDS-1是首先将DON乙酰化成3ADON,再氧化成3-keto-DON[31]。具有关键作用的3ADON氧化酶可降解小麦中58.11%(质量分数)的DON和68.39%(质量分数)的3ADON。第1株可降解DON衍生物——15ADON的德沃斯氏菌A16[28]的全基因组序列已被报道[32]。动物实验表明,ANSB714可显著减轻DON对小鼠和生长肥育猪的毒性作用,且菌株本身对实验生物体无害[33-34]。因此,利用ANSB714解除DON的危害在畜牧业中具有很大潜力。
德沃斯氏菌不仅可高效降解DON,还具有产κ-卡拉胶酶[35]、降解持久性有机污染物(POPs)[36]、有氧吸收磷[37]等潜能。有研究者[36]筛选出的德沃斯氏菌可在Aroclor1242溶液中降解60%(质量分数)的多氯联苯混合物(PCBs);郭娟娟等从角叉菜中分离得到可产高活力κ-卡拉胶酶的德沃斯氏菌,能特异性水解卡拉胶得到具有多种生物活性的卡拉胶寡糖,因此也可用于破除海藻细胞壁以提取其DNA[35]。目前,我国还没有工业化的卡拉胶菌株,此菌株具有一定生产潜力。
1.3 诺卡氏菌属(Nocardia)
诺卡氏菌为腐生型革兰氏阳性菌,大多数可引起人类和动物感染,特别是患有慢性肺病和免疫抑制性疾病(如艾滋病毒感染)的病人,导致高死亡率[38]。它们与德沃斯氏菌产生不同的DON代谢物,但是降解途径部分相同,都可产生3-epi-DON作为DON降解的中间体[39]。Ikunaga等从小麦地分离的诺卡氏细菌WSN05-2是第一个被报道具有DON异构化活性的菌株,7 d的DON转化率可达90%。它可将DON降解为3-epi-DON和另一种未知产物,但这2种物质只是中间产物[40]。
此外,该菌属还首次被报道[41]可产菊糖果糖转移酶(IFTase),催化菊糖形成双果糖酐Ⅰ(DFAⅠ)。目前,对DFAⅠ的研究较少,此发现不仅扩大了DFAⅠ型IFTase的研究范围,还为其晶体结构的研究提供了理论依据。同时,也降低了DFAⅠ的合成成本。
1.4 其他细菌
有研究者[42]从牛瘤胃的富集培养物中分离到一株名为BBSH797的厌氧细菌。该菌可以在24~48 h内将DON的C12-C13环氧基团水解成2个相邻的羟基,代谢成单一产物DOM-1[43],其毒性仅为DON的1/55[44],但是它对猪或家禽没有明显的解毒作用[45]。目前,关于DON脱环氧化的基因还没有被克隆,也未发现可在有氧条件下实现该降解途径的单一菌株[46]。
近年来,研究者们还发现了一些新的可降解DON的菌属,如Paradevosia属、假单胞菌属和肠杆菌属等。Paradevosia属菌株具有DON降解能力[47],可将DON完全转化为3-epi-DON。有报道表明[48],从土壤中分离出一株能在有氧条件下降解DON的绿脓杆菌,其上清液中的某种酶可在48 h内降解质量分数64.6%的DON。李晓凤等筛选出一株好氧肠杆菌,7 d后DON降解率可达40.40%[49]。
2 真菌的降解
除细菌外,少数真菌也对DON具有较高的降解效率(14 d内达90%以上),主要为曲霉属,起作用的为环氧化物水解酶。
曲霉是一类分布广泛、稳定性强的真菌,大部分可引起物质发霉腐败或产生毒素,也有部分曲霉具有降解霉菌毒素的功能。塔宾曲霉(Aspergillus tubingensis)具有DON生物转化能力,降解产物未得到验证[50]。环氧化物水解酶的基因已被克隆,并分别构建了原核和真核表达载体,且含有重组质粒酵母菌的表达产物,对DON的转化率达50%[51-53]。从米曲霉(Aspergillus oryzae)As-W.6中提取的脂肪酶(可能属于环氧化物水解酶)对DON的降解率超过70%[54]。
环氧化物水解酶能够高立体选择性催化水解一系列环氧化物,得到具有光学活性的环氧化合物和邻位二醇,且无需辅酶参与,这是获得许多生物活性分子前体的一条重要途径。它可应用于不同手性药物中间体的合成,具备一定普适性。例如,它可高效合成手性环氧氯丙烷、手性苯基乙二醇和手性苄基缩水甘油醚等原料中间体[55]。目前,已实现了绿豆[56]和菜豆[57]中环氧化物水解酶基因的克隆及表达。此外,曲霉属微生物还有应用于降解化学农药(有机磷类农药、磺酰脲类农药、菊酯类农药等)的潜力,发挥农药原药作用(防治病虫害、除草、抗病毒等)[58]。
3 混合菌的降解
人类对DON降解菌的研究是从发现混合菌开始的,其降解产物多为DOM-1。从动物肠道和瘤胃中分离得到的混合菌株一般为厌氧菌,实际生产中往往因其严格厌氧条件而受到限制。土壤中降解DON需氧菌的发现为研究提供了一个新方向。20世纪80年代,有研究者[59]证明了牛瘤胃和动物肠道中的混合微生物可将DON中的环氧结构破坏,但是纯培养物无作用。有研究者从褐色大头鲶鱼肠道内容物中得到的微生物混合物C133,培养96 h后DON的降解率达到100%,168 h后只能检测到DOM-1。这是鱼类肠道微生物对单端孢霉烯具有转化作用的首次报道[60]。从土壤中得到高度富集的细菌聚合体DX100(70%的菌种已知)[61],在无氧和有氧条件下都可去除DON的环氧基团,而某些细胞质还原酶可能是影响脱环氧化活性的原因。如何在有氧条件下从DX100中提取脱环氧化酶或鉴定关于脱环氧化的新基因是未来研究的方向。
4 其他的降解
除微生物外,植物或一些食品加工过程也可使DON转化为DON隐型毒素。植物感染真菌毒素后启动防御机制,使DON发生水解、还原、氧化反应或与有机分子结合从而改变其结构、极性,降低毒性,进而促使DON隐型毒素储存在植物液泡和质外体中或与细胞壁发生不可逆结合[13]。D3G是植物中最常见的DON改性形式之一,糖基转移酶将葡萄糖分子与DON分子的C3羟基结合,限制毒性基团与靶细胞成分的相互作用。DON的热稳定性使其在多数加工过程中保持稳定,但是烘焙、铣削、酸碱处理以及发酵等食品加工过程可使DON部分转化[14]。由于缺乏暴露数据和分析标准,目前尚无法对食物中的DON隐型毒素进行精确的风险评估[62]。此外,缺乏准确的毒代动力学和毒理学研究,不仅限制了对霉菌毒素转化机制的理解,还阻碍了食品中这些产物最大耐受水平的确定。
5 展 望
DON污染严重危害到谷物和粮食的质量与安全,也对畜牧业和农业经济造成了较大威胁,亟待解决。生物降解法较传统的物理和化学方法更为高效、环保,而微生物种类繁多,选择对DON具有降解作用的菌株存在很大的研究空间。作者按照菌属分类,综述了近10年可降解DON的菌株,发现降解机制研究得最为深入的是德沃斯氏菌,已明确并克隆了其降解酶的基因。芽孢杆菌报道的次数较多,但是研究深度仅停留在其对DON的降解效果上,代谢产物及其毒性均未得到明确。
从监管、毒理学和消费者方面考虑,微生物降解在人类食品和动物饲料工业中的应用受到局限。降解菌株的安全性至关重要,菌株本身是否无毒决定了其是否有应用价值,但是其功效研究主要集中在体外实验,对人体及动物产生的影响研究有限,仍需要大量毒理学研究和动物实验得以验证。目前,DON的降解机制、转化产物及其毒性有待进一步探究,距离满足实际生产应用还有一定差距。因此,不仅要筛选更高效的降解菌株,也要健全和完善安全性评价和降解机理的研究。
未来可应用降解酶和基因以优化降解DON的生物方法。从微生物、植物和哺乳动物组织中纯化和鉴定降解酶,研究其性质和活性。利用基因工程技术识别和表征降解酶的相关基因,使其被克隆并在作物中表达,培育出能抑制DON产生或能降解DON的品种,以防止DON进入人类和动物的食物链,影响食品安全。此外,降解基因还可能在微生物中表达,从而产生用于工业化规模生产和纯化酶的重组微生物,为处理DON污染的饲料和粮食提供行之有效的技术和策略,确保粮食和食品安全,保护消费者健康。

