细胞外基质/二氧化钛复合涂层的制备及其细胞响应
童汇慧,周贝贝
(1.浙江工商大学,浙江 杭州 310018; 2.浙江大学材料科学与工程学院,浙江 杭州 310027)
1 前 言
钛金属及其合金由于其优良的机械性能和生物相容性被广泛应用于骨科和牙科植入体[1-4]。为改善其与宿主骨组织的结合,也就是骨整合,通常需对其表面进行修饰[5]。近年来,纳米结构TiO2涂层,如纳米点[6]、纳米线[7]、纳米管[8-9]、纳米棒[10-11]等,在这方面得到了广泛的研究。例如TiO2纳米管薄膜可以显著加速成骨细胞的粘附和骨整合,不同直径的单个纳米管被发现能够影响细胞的粘附、形态、酶的活性并最终影响细胞的命运[12-14];不同晶相的纳米点薄膜表现出调控不同细胞粘附和增殖的能力等[15-16]。在这些涂层中,纳米棒薄膜因为具有准三维结构,能够为细胞附着、增殖及分化等行为提供合适的微环境从而得到了广泛的重视。合适的拓扑结构在细胞生长初期能够促进细胞粘附,促进细胞的成骨分化和骨整合等[11,17-18]。同时,纳米棒之间的空间可以用来进一步复合其他种类的材料[19-20],如磷酸钙、生物玻璃等,这可以进一步改进涂层的生物学性能。
近年来,细胞外基质(ECM)得到了越来越多的关注。ECM的主要成分包括结构性和功能性的蛋白质分子,如胶原蛋白、层粘连蛋白、糖胺聚糖和其他糖基化蛋白等。其独特的三维结构[21]不仅为细胞提供了支持结构和附着位点,还能提供细胞发挥功能所需的信号[22-25]。因此,ECM的主要成分可以作为生物材料以诱导合适的细胞响应,如粘附、增殖和分化等[26-28]。例如,层粘连蛋白在体外可以促进细胞的附着和存活[29];I型胶原能诱导人间充质干细胞(hMSCs)的成骨分化[28,30],这可能与其独立激活FAK和ERK信号通路,促进碱性磷酸酶和骨钙素的表达有关[26];引入I型胶原的支架也表现出良好的成骨性和更好的粘附相关基因表达[31]。近年来,由于从组织或体外培养获得的全ECM能够保留更多的天然成分和微观结构,将其用于组织修复的研究逐渐增多。Shraddha将hMSCs衍生的ECM加入到生物相容性聚合物中,获得电纺混合支架[32]。ECM的加入能显著提高软骨培养基中II型胶原蛋白的表达。而且,不同种类细胞衍生的基质可以促进间充质干细胞的增殖[33]。
然而,由于成分和结构的复杂性,如何在成分和微观结构上更好地仿生ECM仍然是一个难题。研究发现,体外培养获取的细胞片层通过聚多巴胺处理固定在Ti基底上,可促进骨髓间充质干细胞(BMSCs)的成骨向分化[34]。由于TiO2纳米结构对ECM蛋白有着良好亲合性[16],并提供了很大的容纳空间,因此可以将其作为固定ECM的基体,所形成的复合涂层可望初期由于ECM的存在具有良好的细胞响应性,ECM降解后则可通过纳米结构表面持续促进细胞响应。
鉴于此,本研究首先制备了TiO2纳米棒薄膜,然后通过体外细胞培养和去细胞处理在薄膜中沉积ECM以形成复合涂层,并对涂层表面干细胞的响应进行评价。
2 实 验
2.1 TiO2纳米棒与ECM复合涂层的制备
TiO2纳米棒薄膜制备参照文献方法[35]:先通过分相自组装在基底上制备TiO2纳米点晶种层,之后水热处理生长出TiO2纳米点薄膜[36]。在本研究中,为减少其它因素的干扰,采用石英基板做为基底。
将鼠前成骨细胞(MC3T3-E1,CRL-2594,ATCC)以5×104个细胞/cm2的密度接种在纳米棒薄膜上,培养3天;然后用磷酸盐缓冲溶液(PBS)和MilliQ纯净水洗涤细胞。采用冻融循环处理进行脱细胞处理:将细胞在-80 ℃的MilliQ纯净水中冷冻3 h,室温解冻后,用MilliQ水洗净,冻融循环重复3次。之后,将所得涂层在冻干机(FD-1A-50)中冷冻干燥12 h,进而通过紫外光照灭菌。ECM量可通过多次重复前述过程增加。将ECM沉积一次、沉积两次和沉积三次的复合涂层分别记为NRLM(低含量)、NRMM(中含量)和NRHM(高含量)。
2.2 复合涂层的表征
通过场发射扫描电子显微镜(FESEM,SU47)表征涂层表面形貌。涂层中的总蛋白量通过BCA试剂盒法检测。水接触角(WCA)用接触角仪(Dataphysics,OCA20) 以滴落法测量。每个样品重复测量4次。
通过免疫荧光染色表征复合涂层中的I型胶原和层粘连蛋白等:先将复合涂层用4%多聚甲醛固定15 min,之后用0.1%Triton X-100渗透10 min及0.5%BSA/10%FBS/0.5%Triton X-100在PBS中阻断1 h;然后用一抗以1/100稀释度在4 ℃下培育过夜;之后将复合涂层与二抗依次在37 ℃黑暗中培育80 min;最后在共聚焦激光扫描显微镜(CLSM,LSM780)下观察。ECM中的细胞核残留通过DAPI染色结合CLSM观察进行表征。
2.3 细胞培养
从Sprague-Dawley(SD)大鼠中分离并收集BMSCs。该动物实验方案经浙江大学医学院第一附属医院动物研究伦理委员会批准。将4周龄的雄性SD大鼠通过颈部脱臼牺牲后从股骨及胫骨上采集骨髓,然后悬浮在含有低葡萄糖型杜尔贝科改良的Eagle培养基(DMEM,Gibco)和10%胎牛血清(FBS,Gibco)的生长培养基中,在37 ℃、5%CO2的湿润气氛中培养。1天后通过更换培养基去除非粘附细胞,之后每两天更换一次培养基。亚培养阶段中,用0.25%胰蛋白酶(Amresco,USA)和1mM乙烯二胺四乙酸(Gibco)分离细胞,当细胞长到80%~90%融合时进行传代。
3 结果与讨论
3.1 复合涂层的成份及微观结构
典型的涂层Raman图谱与SEM图像如图1所示。复合涂层可以检测出锐钛矿相的存在(图1a),这可归为表面的纳米棒。如图1b所示,表面箭头所指处可以观察到明显的ECM沉积,ECM较为均匀地沉积在纳米棒之间空隙中,最终形成相互连接结构。
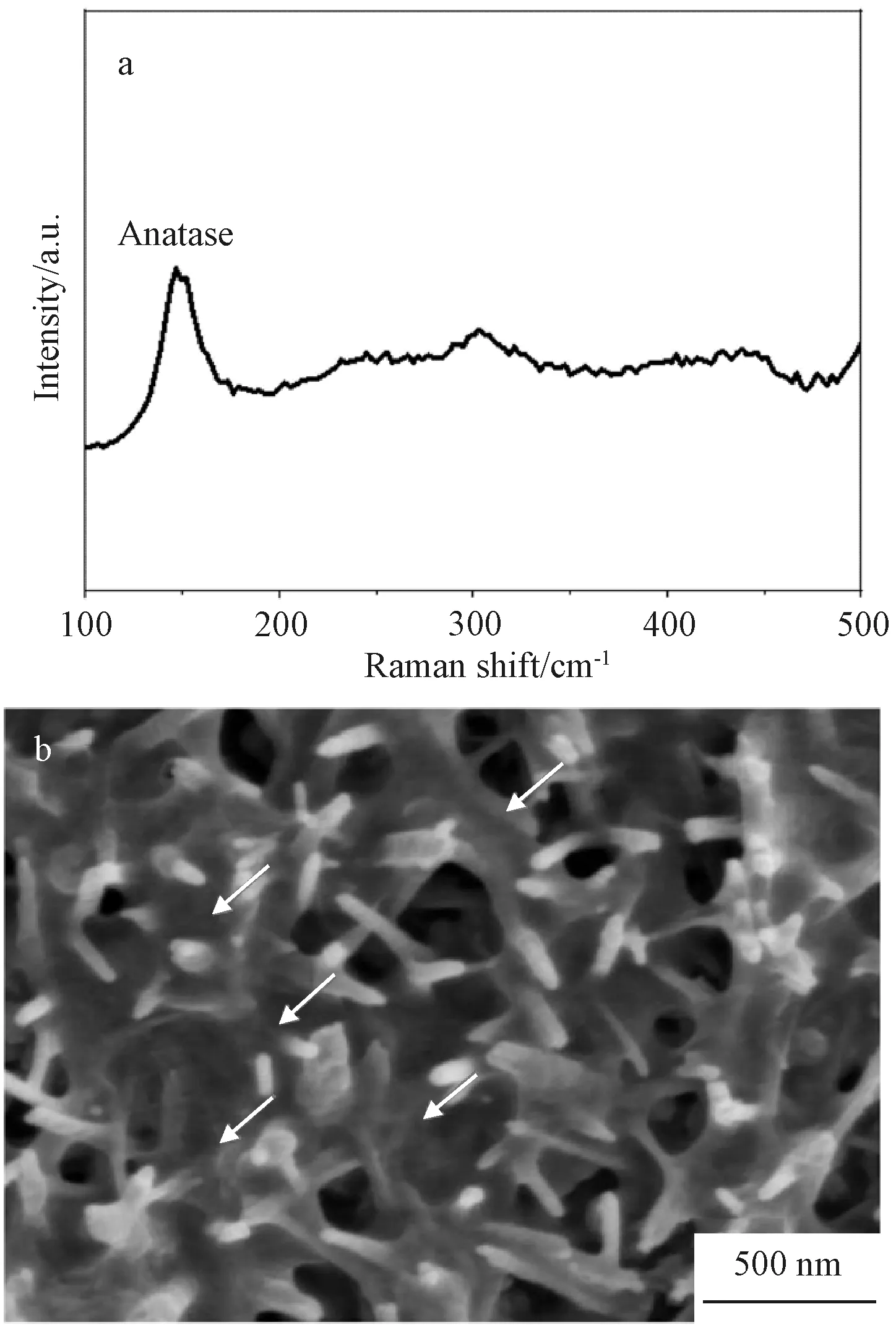
图1 复合涂层的典型Raman图谱(a)及SEM图像(b)Fig.1 Typical Raman spectrum (a) and SEM micrograph (b)
图2a表面吸附蛋白总量的结果显示,随着ECM沉积次数的增加,蛋白质总量明显增加。NRLM为23.4 μg/cm2,NRMM为33.1 μg/cm2,NRHM为53.5 μg/cm2。与此相对应,图2b的水接触角结果也证实了复合涂层变得比纳米棒更疏水。由于各种不溶于水的大分子和疏水官能团的存在,平均接触角由7.4°变为37.3°、41.0°和46.6°。这些结果证明ECM已经有效沉积在纳米棒之间,形成了ECM/TiO2复合涂层,且其含量可通过沉积次数在一定程度上可控。
荧光显微分析显示,去细胞处理后,细胞核含量显著减少(图3a、b)。而ECM的主要成分,包括I型胶原和层粘连蛋白,如图3c~f所示,在涂层中得到了有效保留。脱细胞前的涂层比脱细胞后的涂层显示出更多的I型胶原和层粘连蛋白存在。这意味着在脱细胞过程中可能有部分ECM流失。
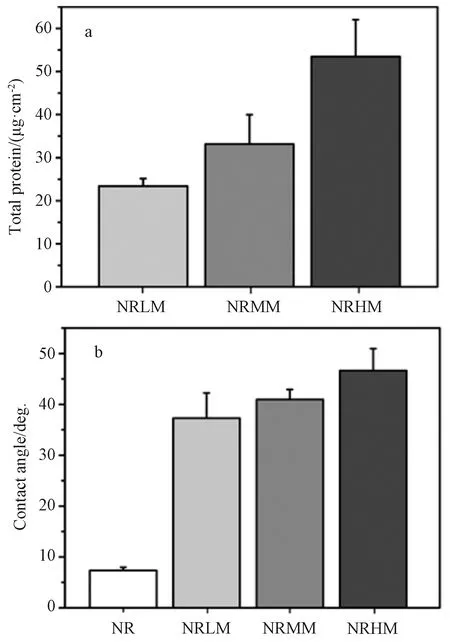
图2 复合涂层的蛋白含量及表面润湿性(a) 总蛋白含量; (b) 水接触角Fig.2 Total protein content and surface wettability(a) total protein amount; (b) contact angles
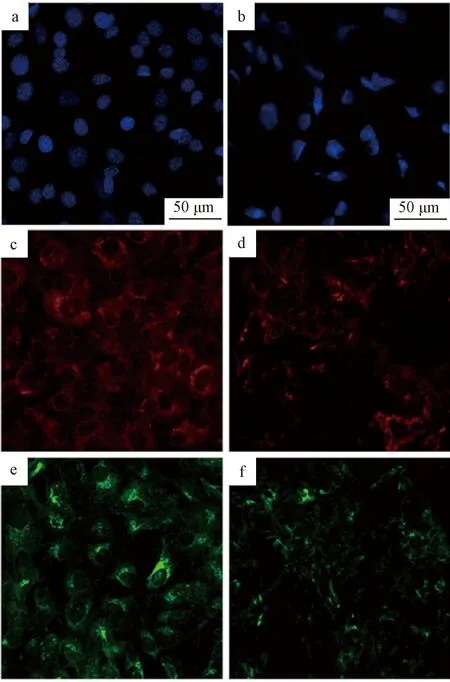
图3 复合涂层中的共聚焦荧光显微图像(a) 细胞核染; (b) 细胞核染; (c) I型胶原; (d) I型胶原染色; (e) 层粘连蛋白(去细胞前); (f) 层粘连蛋白(去细胞后) Fig.3 CLSM images of the composite coatings(a) DAPI; (b) DAPI; (c) Col-I; (d) Col-I ; (e) laminin (Before decellularization); (f) laminin (After decellularization)
3.2 BMSC对复合涂层的反应
CCK-8结果显示NRLM和NRMM涂层显著改进了细胞的粘附性(图4a)。经过4天和7天的培养,复合涂层上的细胞有明显的增殖,NRMM组的效果最好。
碱性磷酸酶(ALP)的水平可以表征成骨向的早期分化。图4b中,复合涂层上培养细胞的ALP活性明显高于NR对照组,说明复合涂层能有效促进干细胞早期分化为成骨细胞。在所有涂层中,NRHM涂层的数值最高。
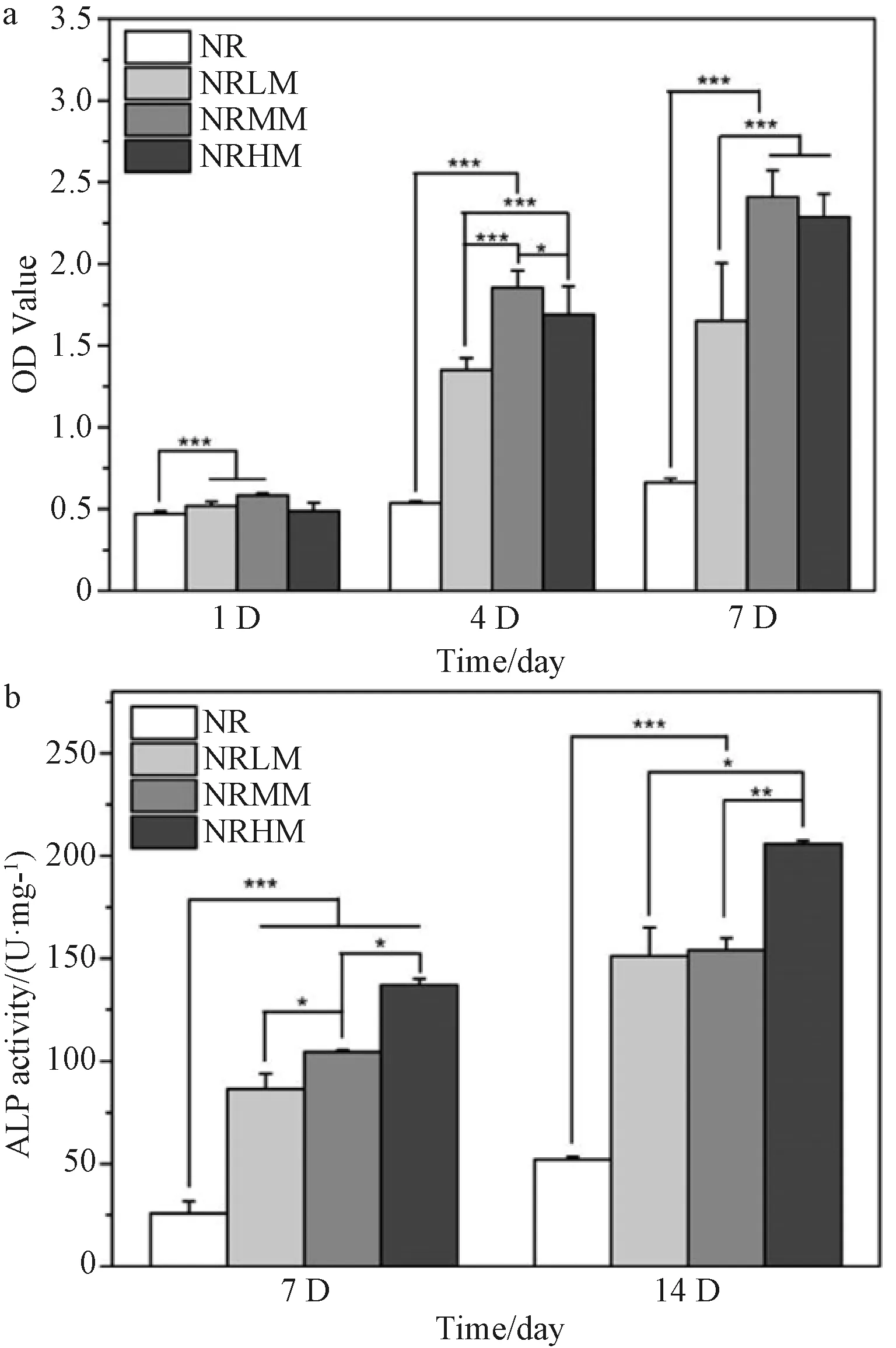
图4 复合涂层的CCK-8 (a)与ALP结果 (b)Fig.4 CCK-8 (a) and ALP level (b) of BMSCs on composite coatings
图5为实时PCR表征的成骨相关基因表达的量化结果,包括ALP、Col-Ⅰ和Runx-2。培养14天后,ALP基因在所有复合涂层中的表达量均有所下降,与对照组相比无明显差异。Col-Ⅰ是成骨分化中期的一个指标,其在所有复合涂层中的表达量均显著高于对照组,且NRMM组表现最佳。而在代表全期成骨的指标Runx-2中,NRMM也是最高的。作为成骨晚期的指标,采用茜素红染色法对21天后的细胞矿化情况进行了评估,结果如图6所示。所有复合涂层均显示出显著上调的细胞矿化行为。尤其是NRMM组,其促进细胞矿化的能力远优于其他组,而NRHM涂层在矿化能力方面仅次于NRMM。
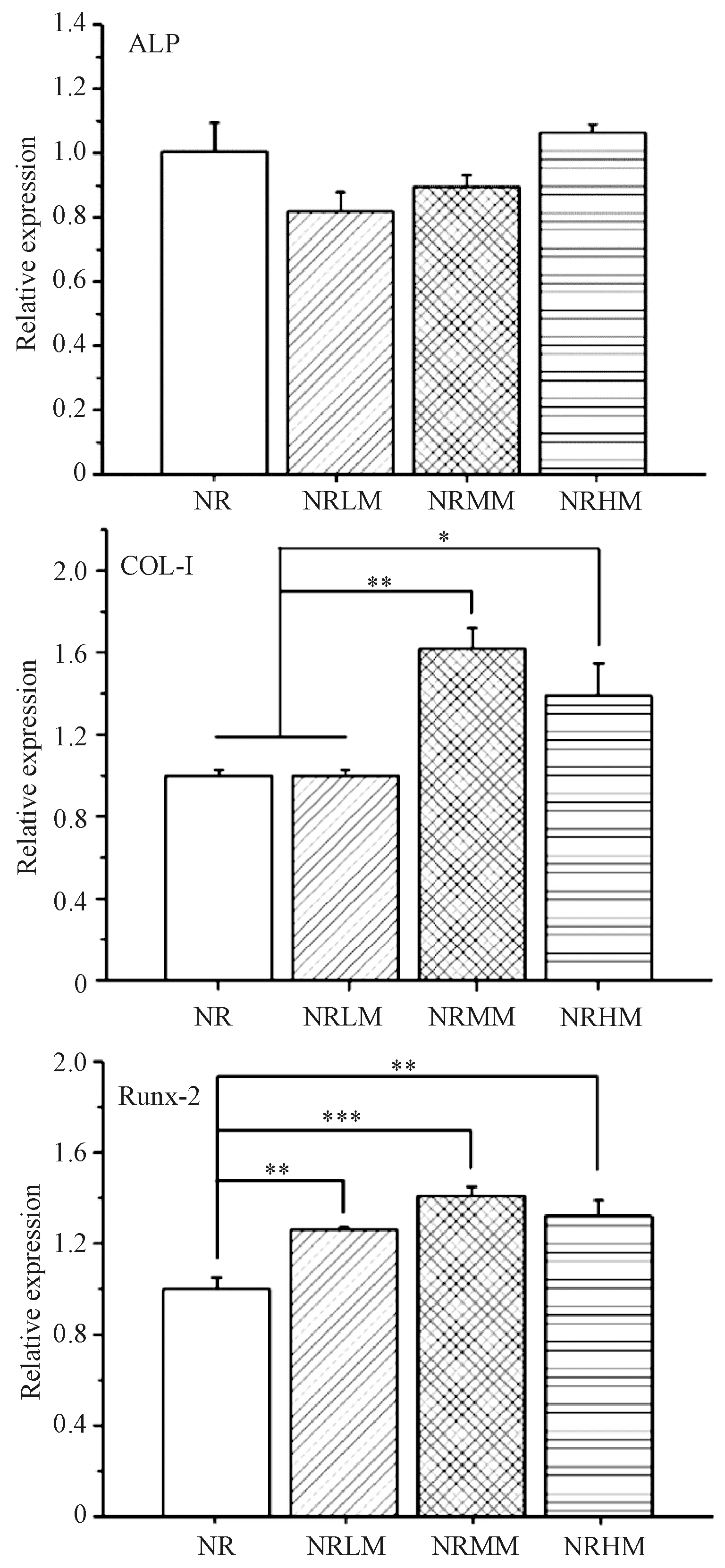
图5 成骨相关基因表达Fig.5 Bone-related gene expression
事实上,由于纳米棒与蛋白质之间具有良好的亲和力[11,17-18],ECM可以很好地沉积在单个纳米棒之间,并形成相互连接的结构,这种相互连接的结构可以很好地固定ECM,最终形成ECM/TiO2纳米棒复合涂层。由于残留的细胞体和细胞核可能导致异物反应,因此通常需要进行脱细胞处理[37]。如图3b所示,一些细胞核成分仍然存在,这可能是由于细胞与其之下的纳米棒之间的相互作用造成的。尽管强化去细胞化能够进一步减少细胞体和细胞核等,但将进一步导致ECM的过多损失,如图3d、3f所示。有鉴于此,本研究在ECM获取和BMSCs获取方面均选择了同一类型的大鼠。如图4~图6所示,这种细胞核的残留并未显示出对生物相容性的不利影响。这意味着,采用同源自体细胞培养获取细胞外基质有可能是一种有效地制备植入体表面生物活性涂层的手段。
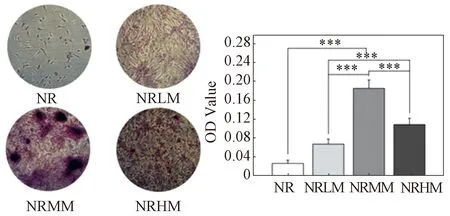
图6 复合涂层表面矿化行为Fig.6 Mineralization behavior of the composite coatings
综合以上实验数据,对于复合涂层上的细胞反应,NRLM涂层比无ECM组和ECM含量较多的组在初始粘附性、展布性和ALP基因表达方面都有改善。这表明,少量ECM的加入可能对促进成骨早期分化有较好的传导作用。由于TiO2纳米棒薄膜对粘附和分化有利(如纳米棒暴露长度影响细胞反应),早期细胞反应的改善可能是ECM和纳米结构协同作用的结果;而对于NRMM和NRHM,随着ECM含量的增加,细胞增殖和成骨相关基因的表达方面的提升则可能来自于ECM的优势。但是,随着更多的ECM沉积导致纳米棒在表面暴露逐渐减少,这可能导致表面主要表现出ECM特性。由于TiO2纳米棒和ECM的协同作用,NRMM表现出最佳的矿化性能。
4 结 论
在TiO2纳米棒薄膜的基础上结合细胞薄层培养沉积,成功得到了ECM/TiO2复合涂层,复合涂层表现出良好的生物相容性和调控BMSCs细胞的粘附、增殖和成骨分化等行为的能力。本工作提供了一种利用宿主细胞体外培养获取细胞外基质用于骨金属植入体表面修饰的新方法,这可能为植入体的表面修饰提供新思路。

