非受体酪氨酸激酶对糖氧剥夺诱导的少突胶质细胞凋亡的影响及其机制
张竣 张莹 王树坤 侯琳 袁增强,
(1 青岛大学基础医学院,山东 青岛 266071; 2 军事医学研究院军事认知与脑科学研究所)
随着社会人口的老龄化,人群缺血性脑白质病变(WMIL)发病率逐渐增高,且WMIL与神经退行性疾病密切相关[1-2]。MIL的发病机制复杂,高血压、糖尿病、高血脂等常见的老年疾病往往会诱发MIL,其中慢性脑缺血引发的WMIL在中老年人MIL中占比极高[3-4]。对血管性痴呆患者随访研究发现,其发病前脑白质就已经出现血流量减少的现象[5]。WMIL患者临床表现为认知障碍、情感障碍,患者不仅生活能力显著下降,而且给家庭带来沉重的负担[6]。但是,目前WMIL尚无针对性的治疗手段。脑白质中少突胶质细胞(OLs)含量丰富,且对低灌注异常敏感,极易发生缺血缺氧从而导致细胞凋亡[7]。因此,亟需进一步研究OLs缺血缺氧导致细胞凋亡的机制。
非受体酪氨酸激酶(c-Abl)广泛表达于机体的细胞核或细胞质中,其下游底物众多,与信号转导、细胞黏附、细胞周期、氧化应激和DNA损伤等均密切相关[8-10]。c-Abl最初作为一种癌基因被发现,与B细胞受体融合表达引发慢性粒细胞白血病[11]。近些年来,c-Abl在神经系统中的作用越来越受到关注[12-13]。在体外培养的神经细胞中,过氧化氢可激活c-Abl,通过磷酸化哺乳动物Ste20样激酶1/2(MST1/2)介导神经细胞的凋亡[14-15];在阿尔兹海默病中,β-淀粉样蛋白(Aβ)可激活c-Abl,通过磷酸化细胞抑癌因子p73导致神经元凋亡[16];在帕金森病中,1-甲基-4苯基-1,2,3,6-四氢吡啶(MPTP)及1-甲基-4苯基吡啶(MPP+)均可激活c-Abl,通过磷酸化p38 Y182位点导致了多巴胺能神经元的凋亡[17]。但是,c-Abl在OLs中的作用少有报道。本研究在体外建立oli-neu和OLs糖氧剥夺(OGD)模型,初步探讨c-Abl如何参与OGD介导的细胞凋亡,以揭示细胞缺血缺氧的分子机制,为WMIL的防治提供新靶点与新思路。
1 材料与方法
1.1 动物及材料
出生后3 d 的C57BL/6J乳鼠(北京斯贝福公司);少突胶质细胞系(oli-neu)(本实验室储存);DMEM/F12培养基(美国Gibco 公司);甲状腺素T3、多聚右旋赖氨酸(PDL)(美国Sigma公司);c-Abl磷酸化抑制剂ABL001(美国Selleck公司);Y245-c-Abl抗体和p-p38抗体(美国Cell Signaling Technology公司);caspase-3抗体(武汉三鹰生物公司);Anexin V-FITC/PI试剂盒(上海碧云天生物技术有限公司);CellTiter-Glo试剂盒(美国Promega公司)。
1.2 方法
1.2.1oli-neu与OLs的培养 将oli-neu接种于含体积分数0.05的胎牛血清、体积分数0.01的马血清、体积分数0.01的链霉素和体积分数0.02的B27(100倍)的高糖DMEM/F12培养基中,置于37 ℃、含体积分数0.05的CO2细胞培养箱内,培养至合适密度后用于后续实验。取生后3 d的C57BL/6J乳鼠经低温麻醉后处死,乙醇消毒后剥离大脑半球,使用抗体吸附方法[18]获得原代少突胶质前体细胞(OPCs),用DMEM/F12重悬计数后均匀铺于PDL包被的培养皿中,1.5 h后将培养基更换为OPC增殖培养基,再培养1 d后,更换为含有T3的OPC分化培养基,分化3 d后用于后续实验。
1.2.2oli-neu细胞活力和凋亡的检测 将oli-neu以每孔约103个均匀平铺于96孔板中,培养36 h后,将oli-neu进行OGD处理(置于含体积分数0.05的CO2和体积分数0.1的O2的无糖培养基中培养),分别于第0、3、6、9小时时使用CellTiter-Glo试剂盒检测自发光强度,测定oli-neu的活力。oli-neu先分别加入等体积的二甲基亚砜(DMSO)(A组)和ABL001(100 nmol/L)(B组)进行预处理后,再经OGD处理6 h以后,测定oli-neu细胞活力。将oli-neu以每孔约106个均匀平铺于12孔板中,培养24 h后进行OGD处理,分别于第0、3、6、9小时时使用Annexin V-FITC/PI试剂盒检测细胞凋亡情况,细胞凋亡判断标准:Annexin V-FITC(-)/PI(+)为坏死细胞,Annexin V-FITC(+)/PI(+)为晚期凋亡细胞,Annexin V-FITC(+)/PI(-)为早期凋亡细胞,Annexin V-FITC(-)/PI(-)为正常细胞。细胞凋亡率的计算方法为早期凋亡细胞与晚期凋亡细胞之和与总细胞的比值。
1.2.3Western blot方法检测oli-neu和OLs中相关蛋白的相对表达量 分别将oli-neu和OLs以每孔约106个均匀平铺于12孔板中,培养24 h后,分别进行OGD处理,并分别于第0、3、6、9 h小时时使用裂解液(提前加入蛋白酶抑制剂和磷酸酶抑制剂)提取总蛋白,先采用BCA试剂盒测定浓度后再进行Western blot实验[18]。分别加入Y245-c-Abl抗体和p-p38抗体(1∶500)4 ℃孵育过夜,以β-actin作为内参照。使用Image J 软件分析蛋白条带灰度值,目的蛋白相对表达量以目的蛋白灰度值/内参照蛋白灰度值计算,结果取3次实验的均值。同时对A组、B组采用Western blot方法检测oli-neu中Y245-c-Abl、p-p38和caspase-3蛋白的相对表达水平,其中以cleaved-caspase-3的相对表达量与pro-caspase-3的相对表达量的比值表示细胞凋亡的相对变化,实验重复3次,取均值。于OLs中先分别加入等体积的DMSO(C组)和ABL001(100 nmol/L)(D组)进行预处理以后,再经OGD处理6 h,同样采用Western blot方法检测OLs中Y245-c-Abl、p-p38蛋白相对表达水平,实验重复3次,取均值。
1.3 统计分析
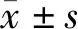
2 结 果
2.1 OGD对oli-neu细胞活力和凋亡的影响
oli-neu经OGD处理第0、3、6、9小时时细胞活力分别为1.00±0.02、0.88±0.03、0.38±0.07、0.31±0.01,细胞凋亡率分别为(12.47±2.11)%、(16.82±1.31)%、(23.43±2.41)%、(35.68±3.16)%,随着OGD处理时间的延长,细胞活力明显下降,细胞凋亡率明显上升(F=249.10、68.18,P<0.05)。
2.2 oli-neu和OLs经OGD处理后Y245-c-Abl和p-p38蛋白的相对表达水平比较
Western blot实验结果显示,oli-neu和OLs经OGD处理第0、3、6、9小时时,各时间点细胞内Y245-c-Abl、p-p38蛋白的相对表达水平比较差异均有显著性(F=4.68~15.93,P<0.05);在OGD处理第6小时时oli-neu内上述两种蛋白表达水平较第0小时时显著升高(q=3.61、4.01,P<0.05);在OGD处理第3小时时OLs内Y245-c-Abl蛋白的相对表达水平较第0小时时显著升高(q=2.99,P<0.05);在OGD处理第3、6、9小时时,OLs内的p-p38蛋白的相对表达水平较第0小时时显著升高(q=4.48~6.20,P<0.05)。结果见表1。
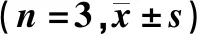
表1 OGD处理oli-neu和OLs不同时间点Y245-c-Abl、p-p38蛋白相对表达水平比较
2.3 ABL001预处理对oli-neu和OLs的影响
A、B组中oli-neu的细胞活力分别为0.39±0.07、0.53±0.01,细胞凋亡率则分别为(22.41±0.53)%、(18.76±1.81)%,两组细胞活力和凋亡率比较,差异均具有显著性(t=3.81、3.33,P<0.05)。Western blot结果显示,A组oli-neu内Y245-c-Abl和p-p38蛋白的相对表达水平及cleaved-caspase-3/pro-caspase-3比值分别为0.74±0.02、0.83±0.06和1.04±0.05,B组分别为0.64±0.04、0.54±0.12和0.90±0.06,A、B组间上述3个指标比较差异均有显著性(t=2.80~4.23,P<0.05)。C组OLs内Y245-c-Abl和p-p38蛋白的相对表达水平分别为0.91±0.15、0.90±0.15,D组分别为0.49±0.17、0.64±0.05,C、D组间上述2个指标比较差异均有显著性(t=3.06、3.79,P<0.05)。
3 讨 论
胶质细胞在大脑的营养传递、吞噬和修复等方面发挥重要作用[19-20]。OLs是中枢神经系统中的成髓细胞[21-22]。OLs沿着轴突形成髓鞘,在髓鞘间的间隔形成郎飞结来完成动作电位间跳跃式传导,对神经元起到保护、快速传导的作用[23-24]。此外,OLs还可通过释放脑源性生长因子等为神经元提供营养支持,尤其是在长投射的轴突中[25-26]。OLs对神经元的保护和神经功能的维持至关重要,其功能障碍会直接导致神经元的退行性病变[27]。
脑白质具有动脉走行较长、侧支循环少的供血特点,对低灌注非常敏感,容易发生缺血性病变[7]。目前临床对WMIL尚无针对性的治疗方案。本研究对oli-neu经OGD处理,结果显示随着OGD处理时间的延长,细胞活力显著下降,细胞凋亡率明显升高,提示在oli-neu经OGD处理过程中可能有多种凋亡信号被激活。
c-Abl在多物种间高度保守,且参与众多的细胞过程,包括调控肌动蛋白细胞骨架、细胞周期以及细胞凋亡等[28-29]。在体内c-Abl结构中存在SH3-SH2-激酶结构域的发卡结构,该发卡结构通过氨基酸残基(由豆蔻酸修饰)与激酶结构域中疏水性口袋结合,从而使c-Abl被抑制[30-31]。然而在受到外界压力或DNA损伤时,位于SH2结构域与激酶结构域连接处的245位点被磷酸化,激活c-Abl[32]。近年来,在多种肿瘤疾病之中均发现有激活状态的c-Abl[32-35]。而在神经退行性疾病中,活性氧可以调节c-Abl的活性,介导细胞死亡。c-Abl是否也参与到OGD诱导的oli-neu凋亡过程尚不清楚。本研究的结果显示,在OGD处理第6小时时oli-neu内c-Abl被显著激活,经ABL001预处理,再经OGD处理6 h后,oli-neu细胞凋亡率降低,提示c-Abl与OGD诱导的oli-neu细胞凋亡密切相关。丝裂原激活蛋白激酶(MAPK)在响应外界压力刺激中非常重要。在真核细胞中,有几条平行的MAPK信号通路以响应不同的刺激,其中p38MAPKs主要由炎症因子和外界压力激活,在多个生理过程中发挥重要作用。在先前研究中,c-Abl在MPTP诱导的帕金森模型中被激活,激活的c-Abl直接磷酸化p38并介导多巴胺神经元凋亡[17]。本研究通过ABL001抑制了OGD诱导的细胞内c-Abl磷酸化的同时,也抑制了p38的磷酸化,提示c-Abl-p38信号通路也参与了OGD诱导的oli-neu的凋亡。
由于原代细胞在研究分子机制中具有不可替代的作用,并且其在体外的发生发展与体内更加相近。因此,本研究对原代培养的OLs进行OGD处理,以验证c-Abl-p38信号通路是否也介导了原代OLs的凋亡。结果显示,OLs经过ABL001预处理,再经OGD处理6 h后,c-Abl激酶活性被抑制,同时p38的磷酸化水平也下降,提示在原代OLs的OGD模型中也存在c-Abl-p38信号通路的激活。然而p38下游底物众多,介导不同的生物学功能。在OGD诱导的原代神经元凋亡中,p38抑制剂SB203580通过抑制p38的磷酸化发挥抗凋亡作用[36]。研究发现,在星形胶质细胞OGD/复氧(OGD/R)导致的细胞水肿中,通过抑制p38的激活降低了水通道蛋白4(AQP4)的表达,从而减轻了细胞的水肿[37]。人趋化因子CX3CL1和其受体CX3CR1介导小胶质细胞激活,通过p38MAPK/PKC信号通路在缺血性脑损伤中发挥负面作用[38]。然而在本研究中,p38如何介导其下游的底物参与OGD诱导的OLs凋亡尚不清楚,有待进一步深入探讨。
总之,本研究结果显示c-Abl参与了OGD诱导的oli-neu和OLs凋亡过程,而c-Abl抑制剂可以减轻细胞凋亡,其促进凋亡的机制可能是通过c-Abl-p38通路介导的。c-Abl有望成为WMIL新的治疗靶点,并为慢性WMIL的防治提供新的思路。但是c-Abl在体内如何发挥作用还有待深入探究。

