晚期糖基化终末产物对糖尿病小鼠角膜树突状细胞活化的影响及作用机制
张雅妮 白晓飞 韦超
(1 青岛大学,山东 青岛 266071; 2 山东第一医科大学(山东省医学科学院)山东省眼科研究所;3 山东第一医科大学(山东省医学科学院)山东省眼科研究所,山东省眼科学重点实验室-省部共建国家重点实验室培育基地)
晚期糖基化终末产物(AGEs)是由蛋白质、脂质以及核酸的游离氨基与还原糖的羰基发生糖基化反应所形成[1]。正常条件下,AGEs在体内的累积与年龄呈正相关[2]。糖尿病可导致AGEs在体内各组织内呈病理性蓄积,是引起糖尿病并发症的重要原因之一[3-4]。目前,在糖尿病大鼠的角膜上皮、基质以及内皮层细胞均检测到AGEs的沉积,而且AGEs的沉积与糖尿病角膜病变引起的上皮愈合延迟有关[5-6]。树突状细胞(DCs)作为一种强有效的抗原递呈细胞,在控制炎症反应、促进免疫耐受、募集免疫细胞和产生抗病毒细胞因子等生理过程中发挥重要作用[7]。在正常角膜基质及上皮层中均发现有DCs,呈角膜外周密集而角膜中央稀疏分布[8]。研究发现,DCs损耗可以延迟角膜上皮伤口愈合以及角膜神经的再生[9]。Toll样受体4(TLR4)作为TLRs家族的成员,可上调炎性因子和干扰素的表达,引起炎症和免疫反应[10-11]。已有相关研究显示,TLR4信号通路参与了糖尿病引起的氧化应激和炎症反应,而TLR4抑制剂瑞沙托维(TAK-242)可有效逆转糖尿病引起的活性氧产生和核因子κB(NF-κB)活性[12-13]。然而,糖尿病条件下过度堆积的AGEs能否通过调控TLR4信号通路活化DCs尚不清楚。本研究旨在通过动物实验和细胞实验研究探讨AGEs对糖尿病小鼠角膜中DCs活化功能的影响及相关机制。
1 材料与方法
1.1 材料和设备
SPF级雄性C57BL/6小鼠36只,购自北京维通利华实验动物繁育有限公司,4~6周龄。1640培养基(美国HyClone公司),白细胞介素4(IL-4)、粒细胞-巨噬细胞集落刺激因子(GM-CSF)(美国PEPROTECH公司),TAK-242(美国MedChemExpress公司),SYBR Green qPCR试剂盒(南京诺唯赞生物科技股份有限公司),AGE-BSA、双抗夹心ELISA试剂盒(美国Abcam公司)。
1.2 实验方法
1.2.11型糖尿病小鼠模型的建立 选用6周龄小鼠,随机分为正常对照组(A组)12只和1型糖尿病组(B组)18只。A组小鼠连续5 d腹腔注射0.1 mL柠檬酸-柠檬酸钠缓冲液,B组小鼠连续5 d腹腔注射链脲佐菌素60 mg/kg。3个月后当小鼠血糖值>16.7 mmol/L,即为1型糖尿病小鼠建模成功。A、B组小鼠各6只,断颈处死后取下眼球,剪下角膜,用于后续的Western Blot实验。其他小鼠用于后续角膜上皮损伤模型构建。
1.2.2体外诱导小鼠骨髓源树突状细胞(BMDCs)4周龄正常小鼠6只,断颈处死后分离股骨和胫骨,用1640培养基冲洗骨髓腔至其变白。制备为单细胞悬液后,加入红细胞裂解液静置3 min,离心弃上清液,PBS重悬2次以后。加入含10 μg/L IL-4和20 μg/L GM-CSF的1640培养基,重悬后接种。置于37 ℃、含体积分数0.05 CO2的恒温箱中培养。培养3 d后更换为含有IL-4和GM-CSF(浓度同前)的1640培养基。培养6 d后用于后续实验。
1.2.3小鼠BMDCs分组及处理 将培养6 d的BMDCs按实验设计随机分为C、D、E、F、G、H组。C、F组为空白对照组,于1640培养基中培养12 h;D组为牛血清白蛋白(BSA)组,于含有200 mg/L BSA的1640培养基中培养12 h;E、G组为AGE-BSA组,于含200 mg/L AGE-BSA的1640培养基中培养12 h;H组为TAK-242组,使用5 μmol/L TAK-242预处理1 h后,加入同G组的培养基培养12 h,然后进行后续试验。
1.2.4酶联免疫吸附法(ELISA)检测各组细胞上清液内干扰素-β(IFN-β)蛋白的浓度 分别收集C、D、E、F、G、H组小鼠BMDCs上清液,严格按照ELISA试剂盒说明书操作,检测各组细胞上清液中IFN-β蛋白的浓度。
1.2.5Western Blot实验检测各组小鼠的角膜内AGEs及各组细胞内p-IRF3、p-p65蛋白的表达水平 向A、B组角膜以及C、D、E、F、G、H组BMDCs内加入裂解液(含体积分数0.01磷酸酶抑制剂和体积分数0.01蛋白酶抑制剂)冰上裂解30 min,收集裂解液并超声破碎,随后离心吸取上清液,分别获得角膜组织与细胞总蛋白,利用BCA试剂盒检测蛋白浓度。将20 μg蛋白样品上样至含体积分数0.10 SDS-PAGE凝胶中,电泳、转膜;用含体积分数0.05 BSA室温封闭1 h,再分别加入一抗AGEs、干扰素调节因子3(IRF3)、磷酸化IRF3(p-IRF3)、p65以及p-p65,4 ℃孵育过夜,次日加入1∶5 000的辣根过氧化物酶标记的二抗,室温孵育2 h;以蛋白印迹成像系统进行显影。以GAPDH/β-actin作为对照,使用Image Lab软件分析条带灰度值。
1.2.6实时荧光定量PCR(RT-qPCR)检测各组细胞炎性因子的表达 小鼠BMDCs按步骤1.2.2培养6 d后,按步骤1.2.3分为C、D、E、F、G、H组,6组细胞采用艾德莱试剂盒提取细胞内总RNA。然后根据诺唯赞反转录试剂盒说明书,在RNA内加入4×gDNA wiper Mix,42 ℃作用2 min;随后加入5×HiScript Ⅲ qRT SuperMix,37 ℃作用15 min;继以85 ℃作用5 s,然后反转录为cDNA。根据SYBR Green嵌合荧光法进行qPCR,以GAPDH作为内参照。引物由美国Invitrogen公司设计并合成,引物序列见表1。采用2-△△CT方法计算各组BMDGs内IFN-β、CXC基序趋化因子10(CXCL10)、白细胞介素-6(IL-6)和白细胞介素-12p35(IL-12p35) mRNA的相对表达量。

表1 小鼠关键基因引物核苷酸序列
1.2.7小鼠角膜上皮损伤模型构建及分组与处理将18只6周龄小鼠随机分为I、J、K组,每组6只。I组在按照A组小鼠处理的基础上于结膜下注射溶剂(体积分数0.01二甲基亚砜+体积分数0.99 PBS);J组在按照B组小鼠处理的基础上于结膜下注射溶剂(同I组);K组小鼠在按照B组小鼠处理的基础上于结膜下注射0.375 g/L TAK-242,TAK-242溶于溶剂内(同I组)。所有小鼠腹腔注射麻醉药全身麻醉后置于操作台上,以无齿镊固定眼球,用直径2.5 mm的环钻轻压中央角膜上皮层,轻轻旋转环钻在上皮层留下压痕,不损伤角膜基质层,用上皮刮刀将压痕范围内的角膜上皮组织刮除,致角膜上皮组织损伤。将荧光素钠染液滴在小鼠眼球表面,于刮除后0、24和40 h在裂隙灯下观察小鼠角膜上皮修复情况并拍照。
1.3 统计学方法
2 结 果
2.1 两组小鼠角膜内AGEs表达比较
Western Blot实验检测结果显示,与A组小鼠相比,B组小鼠角膜组织中AGEs蛋白的水平显著增高。见图1。
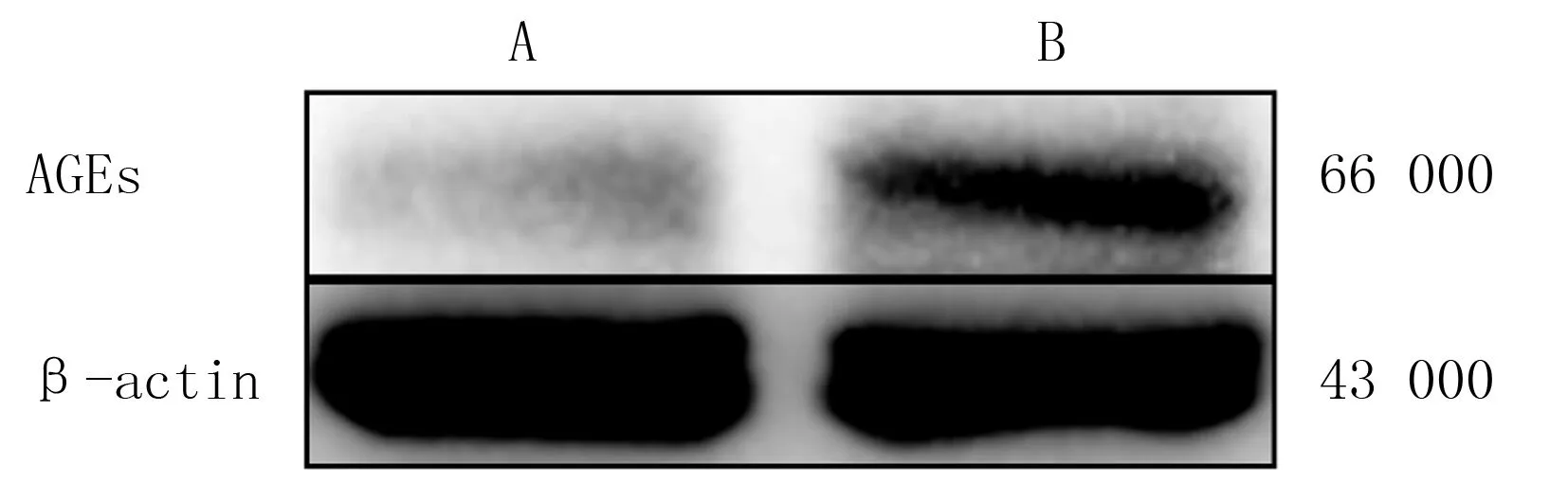
A、B分别对应A、B组图1 两组小鼠角膜组织AGEs蛋白表达情况
2.2 各组小鼠BMDCs活化情况比较
ELISA结果显示,C、D、E组BMDCs上清液内IFN-β蛋白的表达量比较差异具有显著意义(F=176.52,P<0.05),E组BMDCs上清液中IFN-β表达量显著高于C、D组(t=13.51、14.95,P<0.05)。见表2。RT-qPCR分析显示,3组小鼠BMDCs内IFN-β、CXCL10、IL-6和IL-12p35 mRNA相对表达量比较差异具有显著意义(F=46.98~4 251.15,P<0.05),E组细胞内IFN-β、CXCL10、IL-6以及IL-12p35 mRNA的相对表达量均显著高于C、D组(P<0.05)。见表2。Western Blot结果显示,E组TLR4通路下游关键蛋白p-IRF3和p-p65的表达量较C、D组明显增加。见图2。
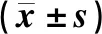
表2 3组小鼠BMDCs中炎性因子表达水平的比较

C、D、E分别为C、D、E组图2 3组小鼠BMDCs中IRF3、p-IRF3、p65和p-p65蛋白的表达水平
2.3 TAK-242干预后各组小鼠BMDCs活化情况比较
ELISA检测结果显示,F、G、H组BMDCs上清液内IFN-β蛋白表达量比较差异具有显著性(F=23.01,P<0.05),其中G组细胞上清液中IFN-β蛋白的表达量显著高于F组(t=34.90,P<0.05),H组细胞上清液中IFN-β蛋白的表达量显著低于G组(t=34.97,P<0.05)。见表3。RT-qPCR检测结果显示,3组小鼠BMDCs内IFN-β、CXCL10、IL-6和IL-12p35 mRNA相对表达量比较差异具有显著性(F=44.64~1 257.10,P<0.05),其中G组细胞内IFN-β、CXCL10、IL-6和IL-12p35 mRNA相对表达量显著高于F组(P<0.05),H组低于G组(P<0.05)。见表3。Western Blot实验结果显示,H组TLR4通路下游相关蛋白p-IRF3和p-p65表达水平较G组明显降低。见图3。
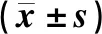
表3 3组小鼠BMDCs中炎性因子表达水平的比较
2.4 TAK-242对糖尿病小鼠角膜上皮损伤修复的影响
组别、时间及其交互作用均对小鼠角膜上皮损伤面积具有明显影响(F组别=19.94,F时间=446.68,F交互=9.96,P<0.05)。单独效应结果显示,在24、40 h,3组小鼠角膜上皮损伤面积比较差异有统计学意义(F=5.85、4.89,P<0.05),其中J组角膜上皮损伤面积显著高于I组(P<0.05),K组低于J组(P<0.05)。3组小鼠不同时间点角膜上皮损伤面积比较差异有显著性(F=8.97~16.69,P<0.05),其中,24 h上皮损伤面积均小于0 h(P<0.05),40 h上皮损伤面积均小于24 h(P<0.05)。见图4、表4。
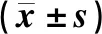
表4 各组小鼠角膜上皮刮除后上皮损伤面积比较
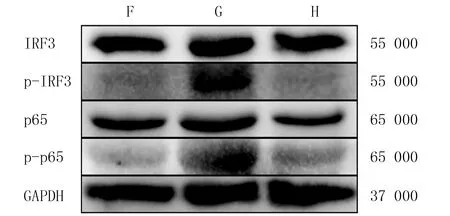
F、G、H分别为F、G、H组图3 3组小鼠BMDCs中IRF3、p-IRF3、p65和p-p65蛋白的表达水平
3 讨 论
AGEs作为一类复杂的非酶促蛋白质翻译后修饰产物,参与了糖尿病角膜病变、糖尿病肾病、糖尿病足及糖尿病视网膜病变等多种糖尿病并发症的发病过程[5,14-16]。AGEs在角膜上皮基底膜的沉积可影响上皮细胞与基底膜的黏附,进而引发糖尿病角膜上皮的改变,是引起糖尿病角膜病变的重要机制之一[17]。本实验通过Western Blot实验检测显示,糖尿病小鼠角膜表达AGEs蛋白较正常小鼠明显增多,进一步证实了AGEs在糖尿病角膜病变中异常沉积。

I、J、K分别对应I、J、K组图4 各组小鼠角膜上皮刮除后荧光素钠染色结果
近年来,LEPPIN等[18]发现DCs在糖尿病及其并发症的致病过程中发挥关键性作用,糖尿病角膜病变中角膜DCs的增加可能与神经纤维减少存在关联。研究表明,DCs可以通过模式识别受体(例如Toll样受体)识别外来物从而起到了保护角膜的作用[19]。TLR4作为Toll样受体家族成员,已被证实参与了糖尿病的发病过程[20]。TLR4信号通路主要通过MyD88/NF-κB和TRIF/IRF3两条途径,引起下游信号级联反应以及诱发慢性炎症反应,该炎症反应是糖尿病角膜病变发生发展的关键因素之一[21-22]。TLR4/TRIF/IRF3途径主要参与Ⅰ型干扰素的表达[23]。糖尿病通过活化TLR4/NF-κB加剧氧化应激、炎症反应,进而参与到糖尿病并发症的发病过程中[24-25]。基于角膜内DCs数量少且难分离,本研究通过体外原代培养BMDCs模型后发现,AGE-BSA可引起BMDCs内p-p65和p-IRF3蛋白表达增加,这表明AGE-BSA可能通过影响TLR4/NF-κB和TLR4/IRF3两条途径来调控BMDCs的活化,进一步上调下游炎性相关细胞因子的表达(包括IFN-β、CXCL10、IL-6和IL-12p35),进而参与到糖尿病角膜病变的慢性炎症反应中。TAK-242作为一种选择性TLR4抑制剂,可直接结合在TLR4胞内结构域中抑制其活化[26]。本实验结果显示,TAK-242干预后,BMDCs内p-p65和p-IRF3蛋白的表达均降低,且通路下游的炎性相关细胞因子水平亦显著下调,提示阻断TLR4信号通路可以抑制AGE-BSA对于BMDCs的活化作用,进一步表明AGE-BSA可能通过TLR4信号通路调控BMDCs的活化。
糖尿病患者在遭受眼部创伤或手术后易发生浅表点状角膜炎、复发性角膜糜烂及持续性上皮缺损等症状[27]。糖尿病角膜病变引起的病理改变包括AGEs的沉积、角膜上皮基底膜成分的改变、角膜神经的损伤以及氧化应激等[28]。AGEs的累积可触发细胞凋亡、氧化应激及慢性炎症等病理过程,进一步加重糖尿病患者角膜的病变[29-30]。基于此,本研究旨在探讨TLR4信号通路在糖尿病角膜上皮损伤修复过程中的作用。荧光素钠染色结果显示,在角膜上皮刮除后24、40 h,糖尿病小鼠角膜上皮愈合较正常小鼠延迟,与之前报道的结果一致[31]。而糖尿病小鼠结膜下注射TAK-242干预后,上皮修复速度较糖尿病对照小鼠加快,说明TLR4信号通路可能参与了糖尿病角膜上皮损伤修复延迟的病理过程。
综上所述,本研究证实糖尿病小鼠角膜内存在AGEs过表达,AGE-BSA可能通过调控TLR4信号通路来促进BMDCs分泌炎性相关细胞因子,TLR4信号通路可能参与了糖尿病小鼠角膜上皮损伤修复延迟愈合的过程。本研究不足在于角膜内DCs含量比较少,在动物水平验证其功能变化存在一定困难,仅能通过其对角膜上皮愈合的影响间接验证,后续研究将对此不足进一步完善。本研究结果为揭示TLR4信号通路在糖尿病角膜病变防治中的作用提供了实验依据。

