玉米-大豆间套作下田间小气候对大豆花形态建成进程的影响
杜青,陈平,刘姗姗,罗凯,郑本川,杨欢,何舜,杨文钰,雍太文
玉米-大豆间套作下田间小气候对大豆花形态建成进程的影响

1四川农业大学农学院/农业部西南作物生理生态与耕作重点实验室/四川省作物带状复合种植工程技术研究中心,成都 611130;2四川省成都市种子管理站/四川省成都市农产品质量安全中心,成都 610072
【】探讨玉米-大豆间套作下田间小气候的变化对大豆花芽分化进程的影响,以期为明确大豆对生长环境变化的反应机理提供形态学依据。于2018—2019年开展田间试验,采用二因素裂区设计,主因素是不同大豆品种:南豆25(ND)、桂夏3号(GX)和贡秋豆8号(GQ),副因素为种植模式:大豆单作(SS)、玉米-大豆套作(RI)和玉米-大豆间作(SI)。于2018年,在大豆出苗后40、47、54和61 d对其主茎顶端的花芽进行连续性的形态学解剖观察,并在此基础上于2019年进一步对大豆出苗后54 d的主茎顶端、中部和底部的花芽进行分部位观察。同时在2019年,统计分析不同种植模式下大豆冠层透光率、田间温度、相对湿度以及CO2浓度等小气候的变化对大豆不同部位花芽分化进程的影响。2018年,3个大豆品种的花芽分化规律表现为GQ要快于ND和GX。在出苗后47 d和61 d,此时大豆处于营养生长后期和生殖生长前期,不同种植模式间的差异最大,表现为间套作的花芽分化进程要稍快于单作。2019年,对大豆营养生长到生殖生长转变的关键时期(出苗后54 d)的花芽分化进程进行分层观察发现,3个大豆品种均表现为冠层>中部>底部,但是在不同模式下的表现不一致,ND和GX在SS模式下的花芽分化进程要慢于RI和SI模式,GQ的花芽分化在3个种植模式之间的差异并不显著。ND、GX和GQ的透光率在出苗后60 d为1个拐点,此时RI和SI模式冠层的透光率与SS模式相比无显著差异,中部和底部的透光率虽呈下降趋势,但都要显著高于SS模式。而在出苗后70 d,ND、GX和GQ在SI模式的冠层透光率最低,分别是82.1%、88.2%和86.8%,而此时的SS和RI模式的冠层透光率均接近100%。在生殖生长后期,ND、GX和GQ在RI和SI模式的日均温度均要高于SS模式,同时RI模式要高于SI模式。不同种植模式下的ND、GX和GQ的相对湿度均在出苗后70 d有一个显著下降趋势,其中RI模式的相对湿度最低,分别是73.5%、75.4%和78.2%。ND、GX和GQ的CO2浓度在RI和SI模式下都要低于SS模式,在间套作种植中下又以RI模式的CO2浓度最低,尤其是在出苗后70 d分别比SS模式低10.3%、10.2%和10.9%。玉米-大豆间套作种植可以促进大豆花芽从营养生长到生殖生长的转变。在大豆生育后期,间套作模式下尤其是套作玉米收获后,套作大豆的中下层的透光率显著高于单作,行间温度、相对湿度和CO2浓度均低于单作,这种带状间套作种植模式的大豆行间微环境优于单作,有利于大豆生殖生长后期荚果的发育,为间套作大豆产量形成机制提供了形态学依据。
间套作;大豆;田间小气候;花芽分化
0 引言
【研究意义】大豆((L.)Merr.)是重要的油料作物,也是人类重要的蛋白质来源作物,在食物体系中占有非常重要的位置[1]。间套种植具有集约利用土地、空间和时间,增产增效,稳产保收,缓解作物争地的矛盾等优点。大力发展南方间套作大豆有助于我国大豆产业的振兴[2]。在温度、光照等条件有限且种植制度复杂的西南地区,在不影响玉米播种面积的情况下增加大豆的播种面积,有利于提高西南地区大豆产出[3-4]。大豆产量取决于有效荚数、单株粒数、百粒重、有效株数等产量构成因素[5]。相对于其他产量因素来说,有效荚数是影响大豆产量最主要的因素[6-7]。与大豆单作相比,间套作种植的大豆主要存在开花结荚数量减少,进而成荚数偏低的现象,研究间套作条件下的大豆花芽形成规律及差异对弄清间套作环境影响大豆产量形成的机制具有重要意义。【前人研究进展】植物花芽分化是指其主茎茎尖生长点由分生出的叶片或腋芽转变成为花序或花朵的过程,同时也是植物从营养生长阶段转变为生殖生长阶段的标志。对于大豆花芽分化的各个阶段以及花发育过程的特点已有了一定的研究。吕薇等[8]将大豆的花芽分化阶段划分为5个时期,分别是大豆花原基分化期,花朵萼片原基分化期,花朵的花瓣原基分化期,花朵的雄蕊雌蕊原基分化期以及最终的雄蕊雌蕊成熟期。而且大豆的花瓣与雌雄蕊原基几乎是在同一时间发生的,没有明显的间隔时间。Thomas等[9]采用透射电镜对大豆主茎的茎顶端分生组织进行观察,发现在短日照诱导大豆开花的处理中,在营养生长阶段大豆的主茎茎端生长点呈圆屋顶形状且以二裂形式被引发。花芽的分化除了与其自身的品种特性有关,同时很大程度上会受到外界环境变化的影响,包括营养条件、温湿度、风以及光照等。生殖器官的发育与多种胁迫因子有关,也决定着植株的长势与产量。因此,开展对不同品种大豆花器官的研究对于大豆丰产、稳产具有明显的重要性。田间小气候,即植物近地局部范围的气候,其变化,是指农作物与其接近地面的气层、土层的物理和生物相互作用过程所形成的小范围气候环境变化,包括光照、湿度、温度以及风和二氧化碳等气候因子的变化,这些因子影响农作物的生长发育和产量形成过程。而间套作相对于单作群体结构更加复杂,复合群体中个体的生长发育引起群体内部结构改变,影响作物田间小气候。作物的种类、种植密度、叶面积以及株行距等因素组合将会形成不同的田间小气候[10-12]。研究表明,现有大豆间套作模式系统中,作物配置、密度和品种选择等均会导致群体光分布产生差异,对套作大豆的光合特性等农艺性状产生影响[13-14]。杨峰等[15]和FENG等[16]通过对不同株型玉米套作大豆生长环境动态分析,发现与半紧凑型和松散型玉米品种相比,在与紧凑型玉米品种进行套作时,大豆的冠层光合有效辐射最大,行间空气温度最高而湿度最低。【本研究切入点】大豆的成花特性除了受不同品种的影响外,同时也受到栽培措施和环境因素制约。前人对于大豆花芽分化的研究主要集中在其各个发育阶段的划分以及花发育过程特点的描述上。大豆在营养生长向生殖生长转变期间会分化出大量的花芽,但是大部分的花芽会在田间环境的影响下败育或者脱落,进而影响生殖生长后期荚果的发育和脱落[17]。大豆花芽分化关系到后期大豆结荚,掌握大豆花芽分化规律对于提高其产量有重要意义。【拟解决的关键问题】本研究以大豆单作为对照,通过分析玉米-大豆间套作下大豆花芽分化进程差异,田间光照、温度和相对湿度的变化,以及这种变化对花芽分化进程的影响,以期揭示间套作对于不同大豆品种群体田间小气候和花芽分化的影响,并为间套作下大豆产量变化规律提供形态学理论支撑。
1 材料与方法
1.1 试验地点及材料
试验于2018—2019年在四川省仁寿县珠嘉乡踏水村(仁寿现代农业专家大院)进行。玉米为登海605(紧凑型,由山东登海种业股份有限公司提供);大豆品种分别为贡秋8号,自贡市农业科学研究所选育;桂夏3号,广西农业科学院选育;南豆25,四川省南充市农业科学研究所选育。
1.2 试验设计
试验采用二因素裂区设计,主区为3个大豆品种,分别为南豆25(ND),桂夏3号(GX),贡秋8号(GQ);副区为3个种植模式,分别为大豆单作(SS),玉米-大豆套作(RI),玉米-大豆间作(SI)。玉米-大豆间套作模式均采用宽窄行种植方式,其中宽行160 cm,窄行40 cm,在玉米宽行内种植2行大豆,套作比例是2﹕2。大豆单作行距是50 cm,穴距17 cm,穴留1株。间套作模式下大豆穴距17 cm,穴留2株,播种密度是11.7×104株/hm2。间套作玉米穴距17 cm,穴留1株,播种密度是5.85×104株/hm2。每个小区种植4带,面积为36.8 m2,重复3次。套作玉米在4月1日播种,间作玉米于5月30日播种,大豆统一在6月1日播种,其他田间管理同大田。玉米、大豆的肥料均在播种时作为底肥一次性施用,玉米施入纯N、P2O5和K2O分别为60、105和112.5 kg·hm-2,大豆施入纯N、P2O5和K2O分别为60、63和52.5 kg·hm-2。
1.3 测定项目与方法
1.3.1 大豆花芽形态学解剖结构观察 2018年,从大豆第3片三出复叶(V3)时期[18]开始,每间隔7 d采一次样品,采样部位是大豆主茎顶端部位的花芽。2019年,在大豆播种后第54天取样,采样部位是大豆主茎的顶端、中部和底部的花芽。所有解剖样品均在植株上剥离后立即使用FAA 固定液(70%乙醇﹕冰醋酸﹕福尔马林=90﹕5﹕5)进行固定,并保存在4 ℃冰箱中备用。采用常规石蜡切片,用酒精进行脱水,并用二甲苯透明后用石蜡进行包埋,在LEICARM 2015 型切片机上进行切片,切片厚度8 µm,铁矾苏木精对材料进行染色,然后在显微镜(Olympus BX41)下观察并拍照。
1.3.2 大豆田间小气候测定 2019年,从出苗后第50天开始,每隔10 d测定大豆冠层、中部和底部的有效光合辐射,在晴天上午9:00—11:00,用美国LI- COR公司的光量子仪(LI-1400)测定大豆光合有效辐射。
分别在出苗后50、60、70、80 d测定田间CO2浓度,从上午7:00至19:00,每隔6 h测定一次CO2浓度。用GXH-3010E1 型便携式红外线分析仪测定大豆行间的空气CO2浓度,连续测定3 d,计算其平均值。
分别在大豆出苗后60、70、80 d测定田间温度、相对湿度,从7:00至19:00,每隔6 h测定1次温湿度。在大豆行内选取2点,将J207-2型干湿温度计悬挂于支撑架上,干湿温度计置于大豆冠层,连续测定3 d,计算2个测定处的平均值,最终计算出田间相对湿度(%)。
1.4 数据处理与分析
所有数据均采用Excel 2010软件进行整理和排列,整理好的数据采用SPSS 25进行方差统计分析,最后使用Origin 2017进行作图。
2 结果
2.1 大豆生育进程差异
ND、GX和GQ在2个播种季的总生育时期变化较小,不同种植模式对大豆的生育时期进程的影响主要在大豆花前的营养生长时期(VE—V7)的长短,以及开花时间的变化(图1)。单作下ND、GX和GQ的VE—V7平均日数分别为33.5、40.5和31.5 d,R1—R2的平均日数分别为30.5、29.5和29 d。而间套作下ND、GX和GQ的VE—V7平均日数分别为33.5、40.0和31.25 d,R1—R2的平均日数分别为30.75、30.25和30 d。

ND:南豆25,GX:桂夏3号,GQ:贡秋8号。VE-V7:出苗-第七片复叶展开,R1-R2:始花期-盛花期,R3-R4:始荚期-盛荚期,R5-R6:始粒期-盛粒期,R7-R8:始熟期-完熟期。SS:大豆单作,RI:玉米-大豆套作,SI:玉米-大豆间作。下同
2.2 大豆主茎顶端花芽分化进程差异
连续2年(2018—2019年)对ND、GX和GQ这3个大豆品种在SS、RI和SI模式下的花芽发育进程进行解剖学结构观察。2018年分别在出苗后40、47、54和61 d观察大豆顶端花芽发育进程差异(图2—4)。2019年进一步对出苗后54 d的大豆主茎顶端、中部和底部的花芽进行解剖学观察(图5—7)。大豆的花芽分化是一个连续的过程,为便于记载和描述,本试验在参考李晓梅等[19]的自贡冬豆花芽分化步骤基础上,进一步将大豆的花芽分化过程划分为生长锥肥大期、花序原基分化期、花原基分化期、雌雄蕊分化期以及花器官完成期。
图2、图3和图4分别是2018年SS、RI和SI模式下ND、GX和GQ在出苗后40、47、54和61 d得的主茎顶端花芽分化进程。
出苗后40 d(V3期),ND(图2-A,E,I)、GX(图3-A,E,I)和GQ(图4-A,E,I)在SS、RI和SI模式下的植株处于营养生长阶段,主茎顶端处于叶原基的分化状态而花原基尚未分化。出苗后47 d(V5期),ND(图2-B,F,J)在SS模式下的茎顶端分生组织处于枝梗分化期,主要产生分枝但也有少量的花原基出现;在RI和SI模式下可以看出有明显的花原基分化。GX(图3-B,F,J)在SS、RI和SI模式下茎顶端仍然处于枝梗分化期。GQ(图4-B,F,J)在SS模式下处于花原基分化期,在RI模式下分化出明显的雌雄蕊结构,在SI模式下雌雄蕊结构已分化完成,雌蕊内部出现明显的子房,且有正在发育中的胚珠。出苗后54 d(V7),ND(图2-C,G,K)在SS模式下处于雌雄蕊分化进行中,在中心部位出现明显的心皮组织,在RI模式下处于雄蕊分化期,在SI模式下处于雌雄蕊分化期,其心皮组织带有明显的弯曲的花柱。GX(图3-C,G,K)在SS、RI和SI模式下仍处于花原基分化阶段,尚未有明显的花器官组织出现。GQ(图4-C,G,K)在SS、RI和SI模式下的雌蕊内部已分化出完整的子房和明显弯曲的花柱。出苗后61 d(R1期),ND(图2-D,H,L)植株生长已转变为生殖生长阶段,在SS和RI模式下处于雌雄蕊结构分化期,花器官发育完成同时也可以明显看到发育中的子房和胚珠,在SI模式下处于雌雄蕊分化期。GX(图3-D,H,L)在SS模式下是花原基分化期,未见明显的花器官组织,在RI和SI模式下可以看到有明显的雌雄蕊组织,其中在SI模式下已有明显的胚珠出现。GQ(图4-D,H,L)在SS、RI和SI模式下花器官已分化完成,子房内有正在发育中的胚珠。

SAM:茎顶端分生组织;APR:茎顶花序原基;O:胚珠;OV:子房;S:雄蕊;P:雌蕊。标尺:200 μm

图3 不同种植模式下GX的花芽分化进程

图4 不同种植模式下GQ的花芽分化进程
2.3 大豆不同部位花芽形态差异
图5、图6和图7分别是2019年ND、GX和GQ出苗后54 d,在SS、RI和SI模式下主茎不同部位的花芽解剖结构。2019年,主要观察出苗后54 d(V7期)的ND、GX和GQ在SS、RI和SI模式下的主茎冠层上部、中部和底部的花芽解剖结构变化。ND在SS模式下主茎冠层上部(图5-M)的花芽处于雌雄蕊分化期;主茎中部(图5-P)和底部(图5-S)的花序上着生着许多小花原基,此时处于花原基分化阶段;在RI模式下主茎冠层上部(图5-N)、中部(图5-Q)和底部(图5-T)的花序均有小花原基着生,但在冠层的解剖图中可以发现处于发育中的苞片原基;在SI模式下主茎的冠层上部(图5-O)、中部(图5-R)和底部(图5-U)的叶腋处均有花芽着生,处于小花分化期。
GX在SS模式下的冠层上部(图6-M)和中部(图6-P)花芽分化处于花原基分化期,在冠层上部分化出较多的小花原基,中部的分布着少量的小花原基,底部(图6-S)的花芽分化还处于营养生长阶段;在RI模式下,冠层上部(图6-N)中心已经分化出明显的雄蕊和心皮组织,中部(图6-Q)花芽已分化出雄蕊,但尚未分化雌蕊结构,底部(图6-T)的仍处于花原基的分化阶段,尚未分化出明显的雌雄蕊结构;在SI模式下,冠层上部(图6-O)、中部(图6-R)和底部(图6-U)的花芽解剖发现,这3个部位仍处于花原基的发育阶段,尚未有明显的花器官组织出现。

图6 玉米-大豆间套作模式下GX主茎冠层上部、中部和底部的花芽解剖
GQ在SS模式下,冠层上部(图7-M)花芽内部出现明显的雄蕊结构,但未见明显的心皮组织,处于雌雄蕊结构分化阶段,中部(图7-P)和底部(图7-S)的花芽解剖结构处于花原基分化阶段;在RI模式下,冠层上部(图7-N)、中部(图7-Q)和底部(图7-T)的花芽可以看到尚处于分化中的雌雄蕊,其中冠层上部的雄蕊分化快于中部和底部;在SI模式下,冠层上部(图7-O)可以见到明显的雌雄蕊分化,其中雌蕊内部已分化出明显的子房结构,中部(图7-R)的花芽有较多的小花原基着生,底部(图7-U)的花芽处于花原基分化阶段。

图7 玉米-大豆间套作模式下GQ主茎冠层上部、中部和底部的花芽解剖
2.4 大豆植株不同部位的透光率差异
大豆植株不同部位的透光率在不同种植模式下的规律变化表现不一样(图8)。在出苗后50—100 d,ND冠层透光率在SS模式下最高,基本稳定在100%。出苗后50 d ND冠层透光率在间套作模式下最低,在RI和SI模式下分别为43.7%和14.3%。出苗后60 d左右RI模式逐渐上升并接近于SS模式,但此时SI模式的冠层透光率最低(82%)。出苗后70 d,ND冠层透光率在SI模式下有一个显著下降的趋势,但随后SI模式逐渐上升并与SS与RI模式差异不显著。ND中部和底部透光率在RI模式最高,分别为79.4%和58.8%,其次是SI模式,分别为32.8%和14.9%,在SS模式下最低,分别为18.3%和3.89%。在出苗后70 d,ND中部和底部透光率在RI模式下逐渐下降为32.7%和8.2%,而在SI模式下则逐渐上升,中部和底部透光率最终在出苗后100 d最高,分别为51.7%和20.6%。
GX冠层透光率在SS模式下基本稳定于100%,而在RI模式下是50.5%,在SI模式下最低(9.9%)。在出苗后60 d左右,GX冠层透光率在SS、RI和SI模式下没有显著差异。在出苗后70 d,GX冠层透光率在SI模式下为88.1%,低于SS与RI模式。但在出苗后90 d左右,GX冠层透光率在SS(87.8%)和RI(90.1%)模式显著低于SI(100.0%)模式,最终3个模式均稳定在100%左右且没有显著差异。在出苗50 d,GX的中部透光率和底部透光率均在RI模式下最高,分别达到84.2%和58.8%,均高于SI(30.8%和32.5%)和SS(24.7%和4.6%)模式。但是在出苗后90—100 d SI模式逐渐增加,中部和底部透光率达到45.6%和17.35%,并高于SS和RI模式。
GQ冠层透光率在不同模式下的变化趋势与ND和GX的变化一致。出苗后50 d,在SS模式下最高,基本稳定在100.0%,在间套作模式下要低于单作,RI与SI模式分别是36.9%和12.9%。在出苗后70 d,冠层透光率在SI模式最低(81.8%)。GQ中部透光率随着时间推移虽然在下降,但均表现为RI>SI>SS。GQ底部透光率在出苗后50—70 d也表现为RI>SI>SS,但在出苗70—80 d后,表现为SI模式逐渐增加到23.7%,而SS与RI模式不断降低,最终分别为16%和13.9%。
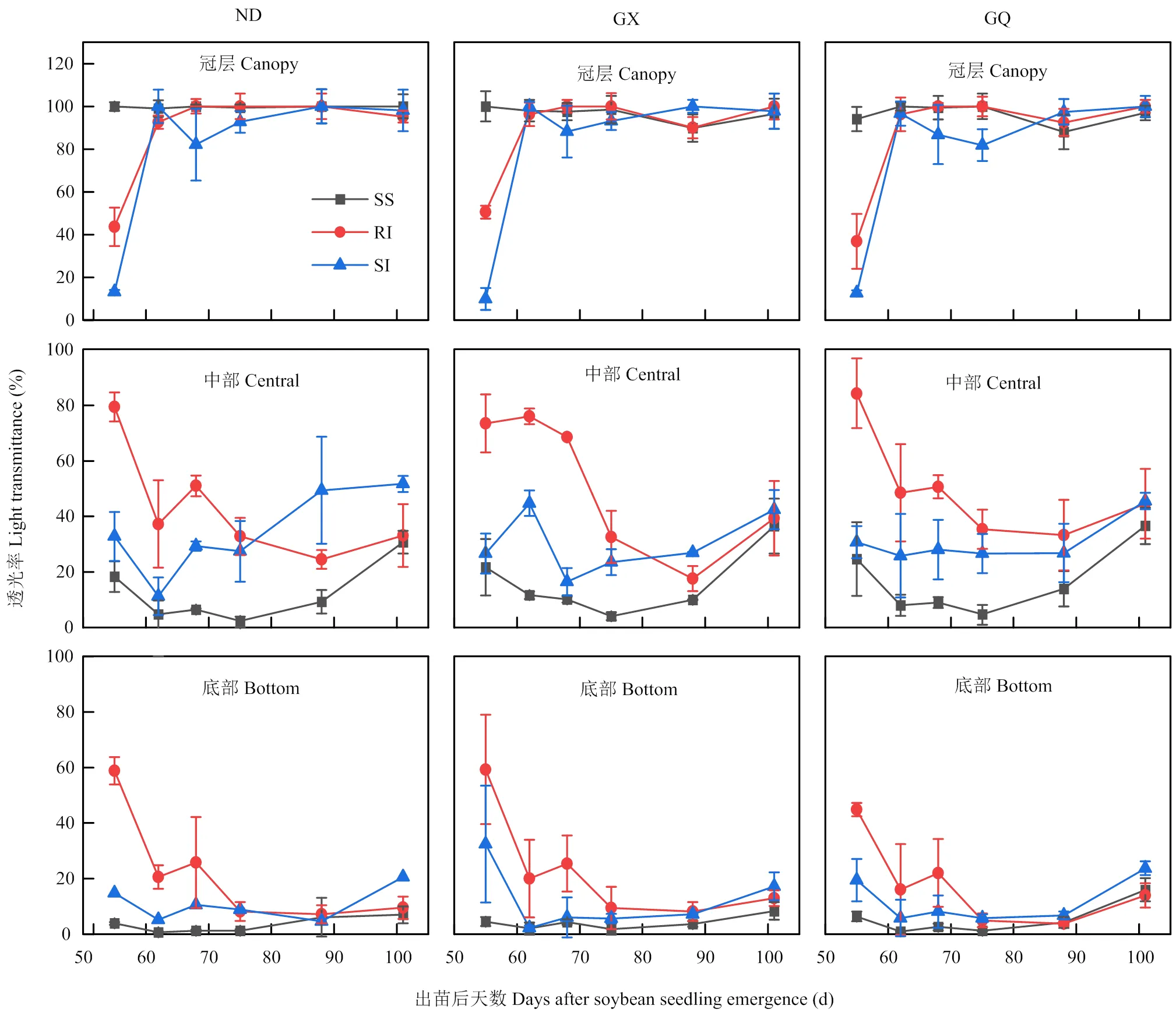
图8 大豆群体不同部位透光率
2.5 大豆田间温度、相对湿度和CO2浓度差异
大豆田间日均温度随着生育时期推进,在不同的种植模式下都表现出先增后减的趋势(图9)。在出苗后60 d,ND、GX和GQ均表现为RI模式较高,ND分别较SI与SS模式高出4.7%和3.9%,GX分别较SI与SS模式高出7.4%和6.9%,GQ分别较SI与SS模式高出5.5%和6.3%,3个品种下的SI与SS模式间基本无差异。在出苗后70 d,ND和GX都表现为RI和SI模式间无显著差异,而RI和SI模式均显著高于SS模式,ND分别高出8.3%和7.1%,GX分别高出7.9%和5.8%;而GQ表现为RI模式最高,而SI与SS模式间无显著差异。在出苗后80 d,3个大豆品种在SS、RI和SI模式下差异逐渐缩小,但ND和GQ在SI模式下要高于RI与SS模式,GX表现为RI模式要高于SI与SS模式。
ND、GX和GQ在不同种植模式下的田间相对湿度总体表现为随着时间推移呈现出先减后增的趋势,在不同模式之间大豆单作的相对湿度均高于玉米-大豆间套作模式(图10)。在出苗后70 d,ND的RI和SI模式与SS模式相比差异最大,RI和SI模式分别比SS模式低21.9%和17.7%。在出苗后60 d,GX的RI模式与SS和SI模式相比差异最大,RI模式分别比SS和SI模式低11.6%和10.9%。在出苗后60和80 d,GQ的SI模式接近SS模式,而在出苗后70 d显著低于SS模式的同时与RI模式相比无显著差异。
ND、GX和GQ在不同种植模式下的田间CO2浓度在出苗后50—70 d之间呈持续增加的趋势,在第70天达到最大值,并以此为转折点,在出苗后70—80 d不断下降(图11)。在出苗后60 d,此时的3个大豆品种在不同种植模式下均表现为SI>SS>RI,在出苗后70 d,大豆单作和玉米-大豆间套作模式均到达峰值,但不同种植模式之间以SS模式最高(ND是629 µmol·mol-1,GX是623µmol·mol-1,GQ是627 µmol·mol-1),ND的SS模式分别较RI与SI模式高出10.4%和7.0%,GX分别高出10.3%和5.0%,GQ分别高出10.9%和6.8%。
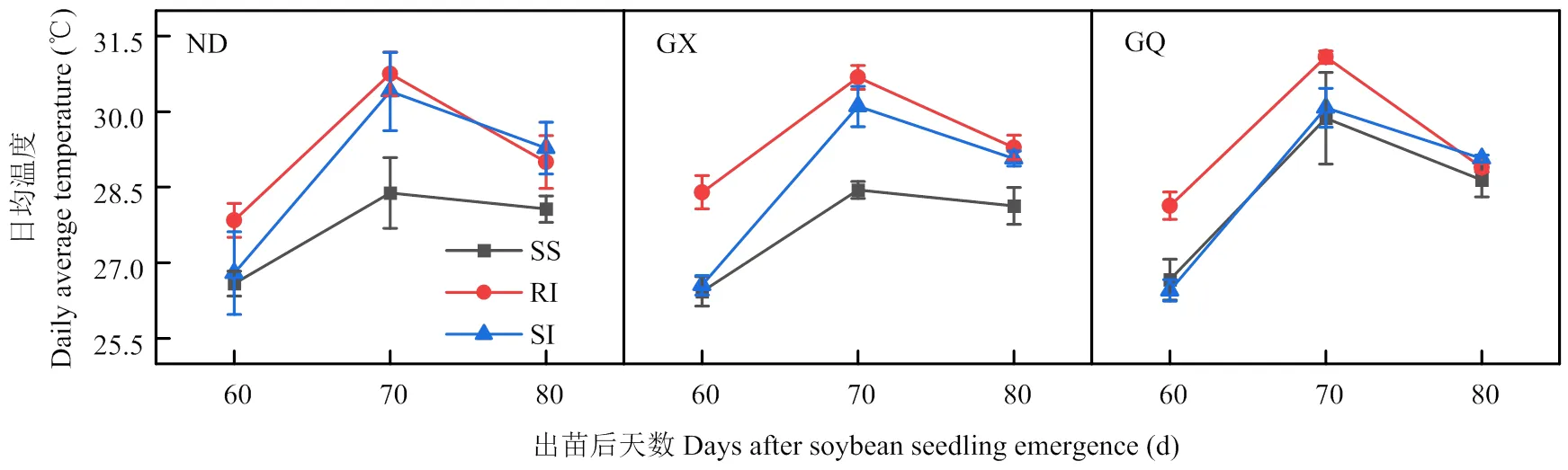
图9 不同品种大豆的田间温度
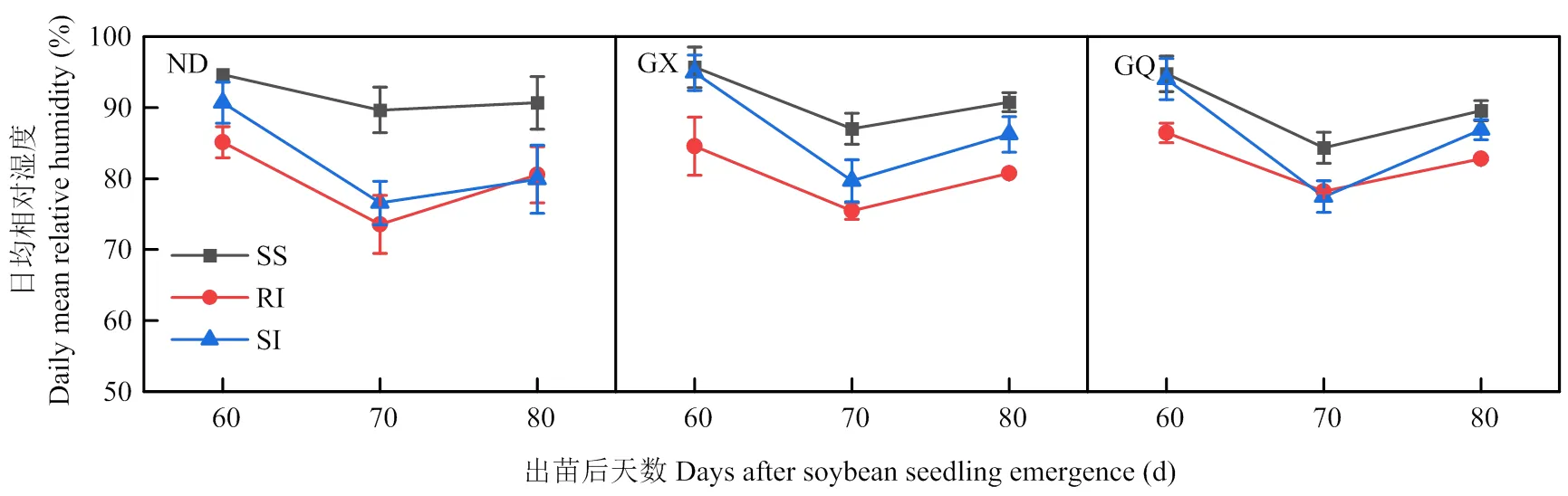
图10 不同品种大豆的田间相对湿度

图11 不同品种大豆的田间CO2浓度
3 讨论
光是调控作物生长与发育的重要环境信号之一,在不同光周期条件下,作物自身会产生促进或抑制花芽分化的相关信息[20],继而调控准确的开花时间,来确保其自身在特定环境下的最佳开花时机,进而保证作物的产量[21]。本试验中GQ主茎顶端的花芽分化进程在套作下要快于单作和间作,而ND和GX在套作模式下花芽分化进程较慢,3个大豆品种的花芽分化进程在3个模式下各不相同,说明花芽分化不仅与外界环境有关并且在品种间存在差异。张孟臣[22]通过比较不同熟期夏大豆品种的花荚形成规律,发现早熟品种的花和荚与晚熟品种相比,其发育快、时间短,但是花和荚的脱落也快于晚熟品种。早熟品种较晚熟品种的盛花期和终花期相对缩短10 d左右,始荚期缩短5 d左右,盛荚期和鼓粒期缩短了10—15 d。姜妍等[23]研究表明具有有限结荚习性的大豆品种,其主茎顶端的花序发育开始时间较早,而其分化速度较快,而在无限结荚习性的大豆品种中,其主茎顶端的花序发育起始时间较晚,因而花序的分化时间也较短。
大豆是短日照豆科作物,其花的分化和发育受到光周期的严格调控并持续整个生长期。研究发现短日照可以促进糜子从营养生长阶段转变到生殖生长阶段[21]。不同种植模式对大豆花分化和发育的影响,其实质是不同日照长度和温湿度对雌雄花分化和发育的影响。玉米-大豆间套作种植是禾本科与豆科、高位作物和低位作物间套作种植的主要模式之一。这种空间生态位差异直接影响大豆群体中的光强和光质分布[24]以及该模式下的微环境(空气温、湿度等)。在间套种植模式下,低位作物在某一生长阶段可能持续受到高位作物的荫蔽影响,处于弱光胁迫中[25-26],不仅光强降低[27],而且光质也发生改变,特别是红光与远红光比值降低,会直接影响大豆的形态建成[28]。曹凯[29]研究表明红光与远红光比值降低会抑制番茄开花。张继波等[30]的研究也发现红光与远红光比值在0.5时会推迟菊花的发育进程,在2.5时促进菊花发育。
本研究发现,在玉米大豆共生期间,ND、GX和GQ的冠层透光率为SS>RI>SI,而中下部的透光率为RI>SI>SS;田间温度表现为RI>SI>SS,相对湿度为SS>SI>RI,CO2浓度表现为SI>SS>RI。此时(出苗后40、47 d)ND和GQ在套作和间作下的冠层花芽内部可以看见明显的花原基分化,在单作下有少量的花原基出现。由于品种差异,GX在3个种植模式下仍然处于枝梗分化期。因为此时大豆处于营养生长期,单作大豆不受遮荫影响,冠层叶片生长过旺,导致中下部透光率降低。而间套作大豆受到玉米遮荫影响,冠层叶片生长受到抑制,所以中下部透光率反而会高于单作。同时由于单作大豆全生育期获得的光照、水肥资源等较充足,所以单作大豆长势较好,会减轻阳光对于土壤的直射,避免水分过快蒸发,单作大豆群体内相对湿度较高。间套种植改变了田间的温湿度、CO2浓度以及透光率等。研究表明大豆的开花速率与平均日温呈线性函数关系[31]。宋伟等[11]发现扩大花生的行内间距,同时采用大小行的种植模式不但能使田间透光率、CO2浓度和群体光合速率提高,而且使得田间的相对湿度降低,最终提高了花生的整体产出。研究表明短日照诱导可抑制小豆植株生长而促进小豆的花芽分化。菊花花芽在短日照8 h/16 h处理下比12h/12h处理分化更早,完成更快,还能促进开花的提前和整齐性[32]。在短日照下矮牵牛植株的株型更紧凑,但是也需要达到较大的营养生长量才能开花[33]。因此套作下的大豆花芽接受到光环境信号,使得该模式下的花芽分化提早进行,而单作大豆的花芽分化然处于正常分化阶段。
同时,本研究发现在共生期结束以后,ND、GX和GQ的大豆冠层透光率在间套作下和单作差距变小,间作大于套作;中下部的透光率在间套作下高于单作,ND和GX的间作高于套作,而GQ则表现为套作高于单作。田间温度呈先升后降的趋势,相对湿度表现为先降后升,CO2浓度也是先呈持续增长的趋势而后在出苗后70 d开始下降,间套作低于单作,其中间作大于套作。此时(出苗后54、61 d)ND、GX和GQ已进入生殖生长期,品种间的差异更加明显。ND在间套作下处于雌雄蕊分化期且有明显弯曲的花柱出现,在单作下处于雌雄蕊分化进行中且中心部位出现明显的心皮组织。GX此时为刚进入生殖生长期,但是在间套作下可以看见明显的雌雄蕊组织。GQ此时的花器官分化完成,不同种植模式间的差异很小,有完整的子房以及明显弯曲的花柱和正在发育的胚珠。环境的变化导致了大豆花芽分化进程的差异。低温处理可以促进榴莲的花芽分化,并且与多效唑处理结果相似[34]。增加滴水量有利于促进植株的生长,延缓植株衰老,显著增加总花数,延长花期[35]。
4 结论
在大豆的营养生长向生殖生长转变的时期,大豆品种贡秋豆8号主茎顶端的花芽分化进程要快于南豆25和桂夏3号;3个品种大豆的花芽分化在套作模式下快于单作和间作,且冠层>中部>底部。与单作相比,在间套作下大豆生育后期中下层的透光率和日均温度显著高于单作,同时相对湿度和CO2浓度要低于单作,这种带状间套作种植模式的行间通风透光率均优于单作,并且这种高温低湿的生长环境更有利于大豆生殖生长后期荚果的发育。
[1] Wu Y S, Feng Y, Gong W Z, Ahmed S, Fan Y F, Wu X L, Yong T W, Liu W G, Shu K, Liu J, DU J b, Yang W y. Shade adaptive response and yield analysis of different soybeangenotypes in relay intercropping systems. Journal of Integrative Agriculture, 2017, 16(6): 1331-1340.
[2] Wu Y S, Wang E L, He D, Liu X, Archontoulis S, Huth N I, Zhao Z G, Gong W Z, Yang W Y. Combine observational data and modelling to quantify cultivar differences of soybean. European Journal of Agronomy, 2019, 111: 125940.
[3] Du J B, Han T F, Gai J Y, Yong T W, Sun X, Wang X C, Yang F, Liu J, Shu K, Liu W G, Yang W Y. Maize-soybean strip intercropping: Achieved a balance between high productivity and sustainability. Journal of Integrative Agriculture, 2018, 17(4): 747-754.
[4] Du Q, Zhou L, Chen P, Liu X M, Song C, Yang F, Wang X C, Liu W G, Sun X, Du J B, Liu J, Shu K, Yang W Y, Yong T W. Relay-intercropping soybean with maize maintains soil fertility and increases nitrogen recovery efficiency by reducing nitrogen input. The Crop Journal, 2019, 8(1): 140-152.
[5] Liu X B, Jin J, Wang G H, Herbert S J. Soybean yield physiology and development of high-yielding practices in Northeast China. Field Crops Research, 2008, 105(3): 157-171.
[6] 韩秉进, 潘相文, 金剑, 王光华, 刘长江, 刘晓冰. 大豆植株性状相关性与产量回归分析. 中国生态农业学报, 2008, 16(6): 1429-1433.
Han B J, PAN X W, JIN J, WANG G H, LIU C J, LIU X B. Correlation and regression analysis of trait and yield of soybean. Chinese Journal of Eco-Agriculture, 2008, 16(6): 1429-1433. (in chinese)
[7] Liu B, Liu X B, Wang C, Li Y S, Jin J, Herbert S J. Soybean yield and yield component distribution across the main axis inresponse to light enrichment and shading under different densities. Plant Soil and Environment, 2010, 56(8): 384-392.
[8] 吕薇, 崔琳, 王学东. 大豆花芽分化和发育的扫描电子显微镜观察. 电子显微学报, 2009, 28(6): 587-590.
LÜ W, CUI L, WANG X D. Observation of differentiation and development of floral organs of soybean by SEM. Journal of Chinese Electron Microscopy Society, 2009, 28(6): 587-590. (in chinese)
[9] Thomas J F, Kanchanapoom M L. Shoot meristem activity during floral transition in(L.) Merr. Botanical Gazette1991, 152(2): 139-147.
[10] 陈国鹏, 王小春, 蒲甜, 曾红, 陈诚, 彭霄, 丁国辉, 王锐, 杨文钰. 玉米-大豆带状套作中田间小气候与群体产量的关系. 浙江农业学报, 2016, 28(11): 1812-1821.
CHEN G P, WANG X C, PU T, ZENG H, CHEN C, PENG X, DING G H, WANG R, YANG W Y. Relationship of field microclimate and population yield in maize-soybean relay strip intercropping system. Acta Agriculture Zhejiangensis, 2016, 28(11): 1812-1821. (in chinese)
[11] 宋伟, 赵长星, 王月福, 王铭伦, 程曦, 康玉洁. 不同种植方式对花生田间小气候效应和产量的影响. 生态学报, 2011, 31(23): 7188-7195.
SONG W, ZHAO C X, WANG Y F, WANG M L, CHEN X, KANG Y J. Influence of different planting patterns on field microclimate effect and yield of peanut (L.). Acta Ecologica Sinica, 2011, 31(23): 7188-7195. (in chinese)
[12] 娄善伟, 赵强, 高云光, 郭仁松, 阿不力克木, 张巨松. 不同密度水平对覆膜棉花田间小气候及产量的影响. 干旱地区农业研究, 2009, 27(5): 88-92.
LOU S W, ZHAO Q, GAO Y G, GUO R S, ABULI K M, ZHANG J S. The effect of different density on microclimate and yield in cotton field under film mulching. Agricultural Research in the Arid Areas, 2009, 27(5): 88-92. (in chinese)
[13] 孙明明, 王萍, 吕世翔, 李智媛, 王冠, 王晓丽, 宋昊. 大豆间套作种植技术研究进展. 大豆科学, 2017, 36(5): 818-823.
SUN M M, WANG P, LÜ S X, LI Z Y, WANG G, WANG X L, SONG H. Advances in planting techniques for soybean intercropping. Soybean Science, 2017, 36(5): 818-823. (in chinese)
[14] Fan Y F, Chen J X, Cheng Y J, Raza M A, Wu X L, Wan Z L, Liu Q L, Wang R, Wan X C, Yong T W, Liu W G, Liu J, Du J B, Shu K, Yang W Y, Yang F. Effect of shading and light recovery on the growth, leaf structure, and photosynthetic performance of soybean in a maize-soybean relay-strip intercropping system. Plos One, 2018, 13(5): e0198159.
[15] 杨峰, 崔亮, 黄山, 刘卫国, 雍太文, 杨文钰. 不同株型玉米套作大豆生长环境动态及群体产量研究. 大豆科学, 2015, 34(3): 402-407.
YANG F, CUI L, HUANG S, LIU W G, YONG T W, YANG W Y. Soybean growth environment and group yield in soybean relay intercropped with different leaf type maize. Soybean Science, 2015, 34(3): 402-407. (in chinese)
[16] Feng L Y, Raza M A, Chen Y K, Muhammad H, Khalid B, Ahmad M T, Ahsan F, Fan Y F, Du J B, Wu X L, Song C, Liu C Y, Bawa G, Zhang Z W, Yuan S, Yang F, Yang W Y. Narrow-wide row planting pattern improves the light environment and seed yields of intercrop species in relay intercropping system. Plos One, 2019, 14(2), e0212885.
[17] Liu B, Qu D N. Effects of shading on spatial distribution of flower and flower abscission in field-grown three soybeans in Northern China. Emirates Journal of Food Agriculture, 2015, 27(8): 629-635.
[18] Fehr W R, Caviness C E, Burmood D T, Pennington J S. Stage of development descriptions for soybeans,(L.) Merrill. Crop Science, 1971, 11(6): 929-931.
[19] 李晓梅, 吴存祥, 马启彬, 张胜, 李春林, 张新英, 韩天富. 大豆品种自贡冬豆花芽分化及开花逆转过程的形态解剖学研究. 作物学报, 2005, 31(11): 1437-1442.
LI X M, WU C X, MA Q B, ZHANG S, LI C L, ZHANG X Y, HAN T F. Morphology and anatomy of the diferentiation of flower buds and the process of flowering reversion in soybean cv.Zigongdongdou. Acta Agronomica Sinica, 2005, 31(11):1437-1442. (in chinese)
[20] 舒黄英, 郝园园, 蔡庆泽, 王振, 朱国鹏, 成善汉, 周媛, 汪志伟. 模式植物拟南芥开花时间分子调控研究进展. 植物科学学报 2017, 35(4): 603-608.
SHU H Y, HAO Y Y, CAI Q Z, WANG Z, ZHU G P, CHENG S H, ZHOU Y, WANG Z W. Recent research progress on the molecular regulation of flowering time in. Plant Science Journal, 2017, 35(4): 603-608. (in chinese)
[21] 董明, 降彦苗, 李海权, 耿玲玲, 刘建烨, 乔志红, 刘国庆. 光周期变化对糜子形态建成及幼穗发育进程的影响. 中国农业科学, 2020, 53(6): 1118-1125.
DONG M, JIANG Y M, LI H Q, GENG L L, LIU J H, QIAO Z H, LIU G Q. Effects of photoperiod changes on morphological characters and young panicle development in proso millet (L.). Scientia Agricultura Sinica, 2020, 53(6): 1118-1125. (in chinese)
[22] 张孟臣. 早晚熟夏大豆品种花荚形成的比较. 大豆科学, 1998, 17(3): 236-241.
ZHANG M C. Comparison of development of flowers and pods between early and late summer soybean variaties, Soybean Science, 1998, 17(3): 47-52. (in chinese)
[23] 姜妍, 吴存祥, 胡珀, 侯文胜, 祖伟, 韩天富. 不同结荚习性大豆品种顶端花序发育过程的形态解剖学特征. 作物学报, 2014, 40(6): 1117-1124.
JIANG Y, WU C X, HU B, HOU W S, ZU W, HAN T F. Morphological and anatomic characteristics on terminal raceme development of soybean varieties with different stem termination types. Acta Agronomica sinica, 2014, 40(6): 1117-1124. (in chinese)
[24] King R W, Hisamatsu T, Goldschmidt E E, Blundell C. The nature of floral signals in. I. Photosynthesis and a far-red photoresponse independently regulate flowering by increasing expression of FLOWERING LOCUS T (FT). Journal of Experimental Botany, 2008, 59(14): 3811-20.
[25] SAIFUDDIN M, HOSSAIN A M B S, NORMANIZA O. Impacts of shading on flower formation and longevity, leaf chlorophyll and growth of bougainvillea glabra. Asian Journal of Plant Sciences, 2010, 9(1): 20-27.
[26] Yang F, Wang X C, Liao D P, Lu F Z, Gao R C, Liu W G, Yong T W, Wu X L, Du J B, Liu J, YANG W Y. Yield response to different planting geometries in maize–soybean relay strip intercropping systems. Agronomy Journal, 2015, 107(1): 296-304.
[27] Yang F, Feng L Y, Liu Q L, Wu X L, Fan Y F, Raza M A, Cheng Y K, Chen J X, Wang X C, Yong T W, Liu W G, Liu J, Du J B, Shu K, Yang W Y. Effect of interactions between light intensity and red-to- far-red ratio on the photosynthesis of soybean leaves under shade condition. Environmental and Experimental Botany, 2018, 150: 79-87.
[28] Yang F, Huang S, Gao R C, Liu W G, Yong T W, Wang X C, Wu X L, Yang W Y. Growth of soybean seedlings in relay strip intercropping systems in relation to light quantity and red:far-red ratio. Field Crops Research, 2014, 155: 245-253.
[29] 曹凯, 红光与远红光对番茄生长发育的影响及开花相关基因功能研究[D]. 杨凌: 西北农林科技大学, 2016.
CAO K. A research of red light anf far-red light on tomato growth and flowering-related genes[D]. Yangling: Northwest A&F University, 2016. (in chinese)
[30] 张继波, 杨再强, 张静, 彭晓丹, 张婷华. 红光与远红光比值对切花菊'神马'发育和外观品质的影响. 生态学杂志, 2012, 31(4): 816-822.
ZHANG J B, YANG Z Q, ZHANG J, PENG X D, ZHANG T H. Effects of red/far red light ratio on the development and appearance quality of cut chrysanthemum cultivar ‘Jingba’ in greenhouse. Chinese Journal of Ecology, 2012, 31(4): 816-822. (in chinese)
[31] Hadley P, Roberts E H, Summerfield R J, Minichin F R. Effects of temperature and photoperiod on flowering in soya bean [(L.) Merrill]: a quantitative model. Annals of Botany, 1984, 53(5): 669-681.
[32] 林贵玉, 郑成淑, 孙宪芝, 王文莉. 光周期对菊花花芽分化和内源激素的影响. 山东农业科学, 2008(1): 35-39.
LIN G Y, ZHENG C S, SUN X Z, WANG W L. Effects of photoperiod on flower bud differentiation and contents of endogenous hormones in chrysanthemum. Shandong Agricultural Sciences, 2008(1): 35-39. (in chinese)
[33] 胡惠蓉, 刘亚红, 胡晓龙, 包满珠. 两种光周期下矮牵牛'幻想粉红'生长发育特性的研究. 园艺学报, 2005, 32(4): 719-721.
HU H R, LIU Y H, HU X L, BAO M Z. Studies on the characteristics of the growth and development of‘Fantasy Pink’ under two kinds of photoperiod. Acta Horticulture Sinica, 2005, 32(4): 719-721. (in chinese)
[34] Kozai N, Hirokazu H, Yoshimi Y. Determination of the crucial floral morphogenesis stage leading to early flowering with paclobutrazol treatment in durian (Murr.). Tropical Agriculture Development, 2012, 56(1): 35-37.
[35] 李春艳. 滴水量对大豆根系生长及花荚形成的影响[D]. 乌鲁木齐: 新疆农业大学, 2016.
LI C Y. Relationship of soybean root growth and flower-pod formation under different irration quantities[D]. Urumqi: Xinjiang Agriculture University, 2016. (in chinese)
Effect of Field Microclimate on the Difference of Soybean Flower Morphology under Maize-Soybean Relay Strip Intercropping System
DU Qing1, CHEN Ping1, LIU ShanShan1, LUO Kai1, ZHENG BenChuan1, YANG Huan1, HE Shun2, YANG WenYu1, YONG TaiWen
1College of Agronomy, Sichuan Agricultural University/Key Laboratory of Crop Ecophysiology and Farming System in Southwest, Ministry of Agriculture/Sichuan Engineering Research Center for Crop Strip Intercropping System, Chengdu 611130;2Sichuan Chengdu Seed Management Station/Sichuan Chengdu Agricultural Products Quality and Safety Center, Chengdu 610072
【】The purpose of this study was to explore the effect of field microclimate change on the process of soybean flower bud differentiation under maize-soybean intercropping system, so as to provide a morphological basis for clarifying the response mechanism of soybean to the change of growth environment. 【】The field experiment was carried out from 2018 to 2019. The two-factor split zone experiment was set. The primary factors were different soybean varieties: Nandou 25 (ND), Guixia 3 (GX), and Gongqiudou 8 (GQ), and the secondary factors were soybean monoculture (SS), maize-soybean relay intercropping system (RI), and maize-soybean strip intercropping system (SI). In 2018, the continuous morphological anatomy of the flower buds at the top of the main stem of soybean was observed at 40, 47, 54 and 61 days (d) after emergence, respectively. On this basis, the flower buds at the top, middle and bottom of the main stem of soybean were further observed at 54 d after emergence in 2019. At the same time, in 2019, the effects of microclimate changes such as light transmittance, field temperature, relative humidity and CO2concentration on flower bud differentiation in different parts of soybean under different planting patterns were statistically analyzed.【】In 2018, the flower bud differentiation of three soybean varieties showed that GQ was faster than ND and GX. At 47 and 61 d after emergence, soybean was in the late stage of vegetative growth and early stage of reproductive growth, and the biggest difference among different planting patterns was that the process of flower bud differentiation under intercropping system was slightly faster than that under monoculture. In 2019, the flower bud differentiation process of soybean in the critical period from vegetative growth to reproductive growth (54 d after emergence) was observed. It was found that the three soybean varieties all showed canopy > middle > bottom, but the performance was different in different planting systems. The flower bud differentiation process of SS in ND and GX was slower than that of RI and SI. The flower bud differentiation processes of GQ were no significant difference among the three planting systems. The light transmittance of ND, GX and GQ was an inflection point at 60 d after emergence, and the canopy light transmittance of RI and SI was not significantly different from that of SS. Although the light transmittance of the central and bottom showed a downward trend, it was significantly higher than that of SS. At 70 d after emergence, the canopy light transmittance of ND, GX and GQ of SI was the lowest, which was 82.1%, 88.2% and 86.8%, respectively, while the canopy transmittance of SS and RI was close to 100%. In the later stage of reproductive growth, the daily average temperature of ND, GX and GQ in RI and SI was higher than that of SS, and which of RI was higher than that of SI. The relative humidity of ND, GX and GQ under different planting systems all had a significant downward trend at 70 d after emergence, among which the relative humidity of RI was the lowest, which was 73.5%, 75.4% and 78.2%, respectively. The CO2concentration of ND, GX and GQ under RI and SI was lower than that of SS, and the CO2concentration of RI was the lowest, especially at 70 d after emergence, which was 10.3%, 10.2% and 10.9% lower than that of SS, respectively. 【】Maize-soybean relay strip intercropping system could promote the transformation of soybean flower buds from vegetative growth to reproductive growth. In the late growth stage of soybean, especially after relay intercropped maize harvested, the light transmittance of central and bottom of intercropped soybean was significantly higher than that of monoculture, while the interrow temperature, relative humidity and CO2concentration of relay intercropping system were lower than those of monoculture. Therefore, the interrow microenvironment of this intercropping system was better than that of monoculture, which was beneficial to pod development in the later stage of soybean reproductive growth and provided a morphological basis for yield formation mechanism.
intercropping; soybean; field microclimate; flower bud differentiation

10.3864/j.issn.0578-1752.2021.13.005
2020-09-08;
2020-10-30
国家现代农业(大豆)产业技术体系专项(CARS-04-03A)、国家重点研发计划(2018YFD0201006)
杜青,E-mail:1391731793@qq.com。通信作者杨文钰,E-mail:mssiyangwy@sicau.edu.cn。通信作者雍太文,E-mail:scndytw@qq.com
(责任编辑 杨鑫浩)

