小麦TaBG的克隆及其在花药开裂中的潜在功能
谭照国,李艳梅,白建芳,郭昊宇,栗婷婷,段文静,刘子涵,苑少华,张天豹,张风廷,陈兆波,赵福永,赵昌平,张立平
小麦的克隆及其在花药开裂中的潜在功能
谭照国1,2,李艳梅2,白建芳2,郭昊宇2,栗婷婷2,段文静2,刘子涵2,苑少华2,张天豹2,张风廷2,陈兆波2,赵福永1,赵昌平2,张立平1,2
1长江大学生命科学学院,湖北荆州 434025;2北京市农林科学院北京杂交小麦工程技术研究中心/杂交小麦分子遗传北京市重点实验室,北京 100097
【】-葡萄糖苷酶(4--D-glueosidase,BG)是一种水解酶,可以从糖聚合物或寡聚糖中水解糖苷键释放出非还原性糖基,对控制花药开裂具有重要作用。小麦光温敏雄性不育系BS366在不育环境下花药不开裂,在可育环境下花药开裂或不完全开裂。从BS366中克隆,分析其在花药开裂中的潜在功能,为进一步解析小麦光温敏雄性不育系花药开裂异常的分子机理提供理论基础。以不育系BS366花药的cDNA为模板,克隆;利用生物信息学软件对及其蛋白结构进行预测,构建系统进化树、预测互作蛋白并对进行上游启动子元件以及互作miRNA预测;构建-16318hGFP载体,观察其在小麦原生质体中的亚细胞定位;使用实时荧光定量PCR(qPCR)方法测定在不育环境、可育环境下不同发育时期花药中的表达量,以及MeJA处理下及与其互作的在花药和颖壳中的表达模式。属于糖基水解酶超家族基因,全长为1 473 bp,编码490个氨基酸,蛋白理论等电点为8.12,属于不稳定的亲水性蛋白。通过miRNA互作预测,发现可能受、等抗逆性相关的miRNA调控。通过蛋白互作预测,发现TaBG可能与氧化还原酶(glucose-methanol-choline oxidoreductase,GMC)、内切葡聚糖酶(endoglucanase,EG)等蛋白互作。TaBG定位于小麦原生质体的液泡中。qPCR结果表明,在花药发育双室期(stage13)、花药开裂时期(stage14)和衰退期(stage15)中的表达量呈现先升高后下降的趋势。在花药开裂时期表达量最高,并且在不开裂花药中的表达量是正常开裂花药的2.8倍。经MeJA处理后,花药和颖壳中的均呈下调表达,表达模式与其相反。可能受、等抗逆相关miRNA的调控,参与花药开裂调控。由于表达量的升高,增加了不育环境下花药中可溶性糖的含量,进而增加花药中的渗透势,从而减缓花药开裂时的脱水活动,导致花药不开裂。
小麦;-葡萄糖苷酶;miRNA;花药开裂
0 引言
【研究意义】小麦光温敏核雄性不育系是二系杂交小麦技术的核心与基础,其中,不育系BS366在不育环境条件下花药不开裂,在可育环境条件下花药开裂或不完全开裂;而在杂交种子生产过程中花药开裂程度的大小直接影响散粉情况,进而影响植株受精的优劣。因此,明确小麦花药开裂调控因素对提高二系杂交小麦制种繁种效率、促进二系杂交小麦的发展具有重要意义。【前人研究进展】花药是由最初的雄蕊原基形成,然后雄蕊原基角隅处的孢原细胞经过平周分裂形成造孢细胞和初生壁细胞,造孢细胞经过一系列的有丝分裂和减数分裂形成小孢子,即后来的花粉。而初生壁细胞则经过平周分裂形成了药室内壁(纤维层)、中间层和绒毡层。当花药成熟时,药室内壁细胞壁的内切向壁和横向壁发生带状加厚,从而有助于花药的开裂和花粉的散放[1]。Browne等[2]把雄蕊原基发生到花药开裂脱落的整个过程分为15个时期,其中,花药开裂阶段分为双室时期(bilocular stage,stage13)、花药开裂时期(dehiscence,stage14)、衰退期(senescence,stage15)。研究表明,在花药开裂阶段,药室内壁和表皮细胞内水有规律的转运,引起花药表皮细胞脱水,进而使药室向外弯曲,最终导致花药开裂[1]。影响花药脱水的因素有很多,研究发现在拟南芥花药药隔周围存在H+蔗糖转运体(sucrose-H+symporter 1,AtSUC1),表达量的提高会增加药隔的渗透势从而导致花药周围组织脱水[3]。-葡萄糖苷酶(4--D-glueosidase,BG)是一种水解酶,可以从糖聚合物或寡聚糖中水解糖苷键释放出非还原性糖基[4]。该酶在微生物、植物、高等动物中都有存在,它们具有不同的蛋白序列,在生物体内发挥不同的生物活性功能。在拟南芥中,BG2能够水解脱落酸葡萄糖酯(abscisic acid-glueosidase,ABA-GE)从而增加体内ABA水平,在对渗透胁迫的响应过程中发挥重要功能。拟南芥中,超量表达能够恢复突变体幼苗叶片发黄的现象,且的等位T-DNA插入突变体对干旱和高盐都敏感,说明-葡萄糖苷酶在植物提高体内ABA水平来响应外界胁迫的过程中发挥重要功能[5]。在大麦中,-葡萄糖苷酶BGQ60可以特异性水解-(1,3)和(1,4)糖苷键连接的低聚糖,参与细胞壁水解[6]。拟南芥中许多与BG同源的多聚半乳糖苷酶(polygalacturonase,PGs)能够降解花药细胞之间的胶质和细胞壁从而调节花药开裂[7]。其中,拟南芥花药开裂区域多聚半乳糖醛酸酶ADPG1(DEHISCENCE ZONE POLYGALACTURONASE1)、ADPG2(DEHISCENCE ZONE POLYGALACTURONASE2)和QRT2(QUARTET2)均受茉莉酸的调节,其中ADPG2受乙烯调节,QRT2则受乙烯和脱落酸共同调节[8];另外,前期研究表明,在离体环境下,外源茉莉酸甲酯(Methyl jasmonate,MeJA)能够诱导并提高小麦光温敏不育系BS366的花药开裂率,进而提高散粉能力,获得较高的结实率[9]。【本研究切入点】从开裂花药和不开裂花药转录组分析中筛选获得在不开裂花药中高表达基因(),且TaBG作为水解酶参与小麦光温敏不育系花药开裂调控的研究鲜见报道。【拟解决的关键问题】本研究以小麦光温敏雄性不育系BS366为试验材料,并从其花药中克隆获得,通过基因结构、保守结构域、顺式作用元件、系统进化关系、miRNA互作分析以及蛋白互作预测等,推测小麦在不同组织、不同花药发育时期以及对花药开裂前后的表达模式及调控方式,为进一步解析小麦光温敏雄性不育系花药开裂异常的分子机理提供理论基础。
1 材料与方法
1.1 材料
以北京杂交小麦工程技术研究中心提供的小麦(L.)光温敏核雄性不育系BS366为研究材料。
1.2 试验材料处理及采集
于2018年10月20日前后将光温敏核雄性不育系BS366分别播种在北京市农林科学院院内(可育环境)和国家杂交小麦邓州(河南)基地(不育环境)。2019年4-5月在小麦开花期间观察、统计花药开裂情况。收集2种环境下,stage13、stage14、stage15时期的花药,并取3个生物学重复(共18个样)用于转录组测序,剩余样品于-80℃保存备用[2]。
在花药开裂时期(河南邓州不育环境)分别取BS366的根、茎、叶、颖壳、雌蕊和雄蕊等6种组织,-80℃保存备用。
茉莉酸甲酯、水杨酸试验处理:在四叶期结束后,将长势良好的BS366植株移入人工气候培养箱(20℃,相对湿度75%,12 h白天/12 h黑夜)中,生长至2周龄,即抽穗期,共分2组处理:第一组每天喷施茉莉酸甲酯(MeJA),浓度分别为0、0.5、2和4 mmol·L-1;第二组每天先喷施茉莉酸甲酯(MeJA),浓度分别为0、0.5、2和4 mmol·L-1,6 h后加喷施10 mmol·L-1的SA。连续5 d后采集花药组织[10],-80℃保存备用。
1.3 TaBG的克隆
通过分析转录组测序中花药开裂和不开裂的差异表达基因(differentially expressed gene,DEG),筛选出与花药开裂相关且差异表达的候选基因()。转录组数据中,在花药开裂的3个时期(stage13、stage14和stage15),可育环境中的表达量与不育环境中的表达量比值取Log2后分别为1.97、2.84和0.37。利用Ensembl plants网站(http://plants.ensembl.org/)查找()序列,Blast比对发现分别与7A、7B、7D染色体上的、和有1 507 bp片段的相似度为98%、1 473 bp片段的相似度为97.1%、1 223 bp片段的相似度为98.4%。根据网上序列,使用Oligo7软件设计扩增引物-F/R和TaBG蛋白编码区扩增引物-CF/CR(表1)。使用Trizol法提取1.2中采集样品的总RNA经浓度测量、质检合格后于-80℃保存。使用PrimeScript ™ RT reagent Kit with gDNA Eraser(TaKaRa,Japan),将总RNA反转为cDNA。以不育环境下发育时期为stage14的BS366花药的cDNA为模板,进行PCR扩增,扩增体系为2×Phanta Max Master Mix 10 μL、上下游引物(10 μmol·L-1)各1 μL、模板cDNA 2 μL(100 ng·μL-1)和ddH2O 6 μL,扩增程序参照2×Phanta Max Master Mix说明书,用琼脂糖凝胶电泳检测、回收目的条带,再与TA载体连接,转化感受态细胞(DH5α),筛选阳性克隆测序(华大基因)。
1.4 生物信息学分析
使用DNAman软件将1.3中测序获得的序列翻译成TaBG的氨基酸序列,利用ExPaSy(https:// web.expasy.org)、Prabi(https://npsa-prabi.ibcp.fr)、SWISSMODEL(https://web.expasy.org/)在线软件,分别进行一、二、三级结构预测,使用NCBI conserved domains(https://www.ncbi.nlm.nih.gov/)、SignalP Server(https://www.dtu.dk/)、ProtScale(https://www.expasy. org/)和Cell-PLoc 2.0(http://www.csbio.sjtu.edu.cn/)分别进行保守结构域、信号肽、疏水性和亚细胞定位预测。利用PlantCARE(http://bioinformatics.psb. ugent.be/)[11]对编码序列上游2 000 bp的DNA序列进行顺式作用元件分析。使用DNAMAN(ver.9.0)对TaBG氨基酸序列与其他植物BG的氨基酸序列进行比对。使用MEGA6.0对TaBG和其他植物的BG构建进化树。利用MEME(http://meme-suite.org/)对TaBG进行motif(基序)预测。使用STRING(https:// www.string-db.org/)和plantgrn(http://plantgrn.noble. org/)分别进行蛋白互作预测和miRNA互作预测。
1.5 BG蛋白的亚细胞定位
利用Oligo7软件设计亚细胞定位引物-DF和-DR(表1)。将与载体16318hGFP连接,构建-GFP融合表达载体。将融合载体转化到小麦原生质体[12],利用激光共聚焦显微镜(Leica TCS SP8,德国)进行观察。

表1 引物序列及用途
1.6 TaBG的实时荧光定量PCR分析
利用测序得到的序列的保守区域设计定量引物-QF/-QR(表1),以小麦作为内参基因。cDNA模板混合后稀释成不同倍数(1﹕3、1﹕9、1﹕27、1﹕81、1﹕243)制作引物的标准曲线,并计算引物扩增效率。参照TB Green® Premix Ex Taq™(TaKaRa,Japan)试剂盒说明书配制定量反应体系(10 μl):cDNA稀释10倍后的工作液1 μl、正反向引物(10 μmol L-1)各0.5 μl、ddH2O 3 μl及TB Green Premix Ex Taq 5 μl。以检测目的基因在小麦不同组织和不同处理样品中的相对表达量。qPCR程序为95℃15 s;95℃5 s,60℃30 s,40个循环;增加熔解曲线,95℃ 15 s,60℃ 1 min,95℃ 15 s。每个样品设3次技术重复和3次生物学重复,阴性对照以无菌水为模板,采用Pfaffl法计算基因相对表达量[13]。使用Original 8.0软件作图。
1.7 miRNA的qPCR验证
利用miRNA提取试剂盒(康为世纪,CW0627S)提取miRNA,使用miRNA cDNA第一链合成试剂盒(康为世纪,CW2141)进行cDNA合成。使用miRNA荧光定量PCR检测试剂盒(康为世纪,CW2142)进行miRNA qPCR分析。反应程序同1.6。3次生物学重复,以为内参,利用Pfaffl法进行表达定量分析[13]。
2 结果
2.1 花药开裂形态观察
以小麦光温敏雄性不育系BS366为试验材料,在花药发育衰退期(stage 15)观察花药形态(图1),结果显示,北京环境下(可育环境)分为花药完全开裂(图1-A)和部分开裂(图1-B)2种类型、河南邓州(不育环境)花药不开裂(图1-C)。
2.2 TaBG的克隆及生物信息学分析
以不育环境下发育时期为stage14的BS366花药cDNA为模板,根据获得的序列,克隆其cds序列,经PCR扩增得到一条长1 500 bp左右的片段(图2-A)。扩增产物经连接、转化、测序和ORF Finder在线分析,的全长CDS为1 473 bp,编码490个氨基酸(图2-B)。
利用ExPaSy对TaBG一级结构进行预测,结果显示,该蛋白分子式为C2603H3849N685O713S15,相对分子量为56.63 kD,疏水性平均值为-0.316,蛋白质不稳定系数为74.82,等电点为8.12,表明该蛋白为不稳定碱性蛋白。通过SignalP Server和NCBI conserved domains对TaBG结构域及基序进行预测(图3),结果表明,该蛋白在第1—18个氨基酸是信号肽(图3-A),为分泌蛋白,并且无跨膜结构域,属于糖基水解酶超家族1(cl23725)。

A:完全开裂(北京);B:不完全开裂(北京);C:不开裂(河南邓州)

A:TaBG的克隆,M:DL 2000 maker;1:TaBG扩增产物;B:TaBG的序列分析
TaBG的二级结构预测显示,α螺旋、延伸链和无规则卷曲的氨基酸残基数分别为189、85和216个,占比分别为38.57%、17.35%和44.08%。
为进一步了解的功能,通过PlantCARE对启动子区的2 000 bp序列进行顺式作用元件分析,结果显示,上游序列含多个顺式作用元件(表2),包括与抗逆性相关的脱落酸作用元件(ABRE)、茉莉酸甲酯作用元件(CGTCA-motif、TGACG-motif)、水杨酸作用元件(TCA-element)、光响应元件(G-box、TCT-motif)和分生组织表达相关元件(CAT-box)。

表2 启动子元件分析
根据SWISS-MODEL预测三维结构,发现TaBG三维结构中有糖基结合位点,并且拥有完整的糖基水解酶功能。根据WoLFPSORT对TaBG氨基酸序列进行扫描,结果发现,该蛋白可能定位于液泡中。
2.3 小麦TaBG的保守结构域及系统进化
对比小麦与其他植物BG氨基酸序列(图4),发现小麦(L)与大麦(L)、二穗短柄草(L.)、水稻(L)、黍()、玉米(L)、高粱(L.)的TaBG氨基酸序列相似度分别是95.5%、88.66%、79.22%、79.24%、78.8%和75.1%,这7种植物的BG序列中均含有糖基水解酶的底物结合位点。

EMS63424.1:小麦Triticum aestivum L.;KAE8767126.1:大麦Hordeum vulgare L.;XP_010237292.1:二穗短柄草Hordeum vulgare L.;XP_015620634.1:水稻Oryza sativa L.;XP_025809448.1:黍Panicum;XP_020393252.1:玉米Zea mays L.;XP_021304604.1:高粱Sorghum bicolor L.
通过对小麦TaBG和23个其他物种BG氨基酸序列构建系统进化树(图5),结果显示,小麦TaBG与节节麦BG聚为一个分支,表明亲缘关系较近。MEME软件预测结果显示,TaBG和其他物种BG蛋白一样具有10个motif(图5,表3)。推测TaBG可能与其他植物BG具有相似的糖基水解酶功能。
2.4 TaBG与miRNA互作的预测分析及互作蛋白的预测分析
前期研究发现miRNA对花药发育具有一定的调控功能,通过预测与互作的miRNA,发现在不同物种中有540个miRNA与互作,其中和等,分别以翻译抑制和剪切抑制的方式作用于(图6-A)。小麦中,具有典型的发卡结构(图6-B),在转录调控中通常作为负调控因子,通过降解靶基因来调控基因表达。

图中进化树中不同颜色部分表示不同分组。XP_020155850.1:节节麦;XP_020155849.1:节节麦;XP_020166122.1:节节麦;VAI78197.1:硬粒小麦;EMS63424.1:小麦;VAI90324.1:硬粒小麦;KAE8767126.1:大麦;XP_010237292.1:二穗短柄草;XP_006664007.1:野生稻;KAF0922613.1:野生稻;EEC69164.1:野生稻亚型;XP_015620634.1:梗稻;KAB8117340.1:水稻亚种;TVU50559.1:弯叶画眉草;PWZ23263.1:玉米;XP_020393252.1:玉米;XP_021304604.1:高粱;RLN3116:糜子;RLM98073.1:糜子;PUZ66950.1:糜子;XP_025809448.1:糜子;RLN31163.1:糜子;TVU50559.1:弯叶画眉草;RLM98073.1:糜子;XP_021304604.1:高粱;PWZ23263.1:玉米;XP_004963948.1:小米;XP_020393252.1:玉米;XP_006490742.1:橙子

表3 基序序列
为进一步了解TaBG与其他蛋白间的作用关系,利用STRING对TaBG潜在的蛋白互作关系进行预测,结果表明,TaBG可能和氧化还原酶(glucose- methanol-choline oxidoreductase,GMC)、降解纤维素的内切葡聚糖酶(endoglucanase)等蛋白互作(图6-C)。
2.5 TaBG亚细胞定位
将构建的TaBG-16318hGFP融合表达载体和16318hGFP空载体用PEG介导的转化法分别转化到小麦原生质体中,在激光共聚焦显微镜下观察荧光蛋白。结果显示,TaBG定位在液泡中(图7)。
2.6 不同育性环境花药发育时期下TaBG的表达模式分析
由图8-A可知,在不同育性环境下,在花药发育双室期(stage13)、花药开裂时期(stage14)和衰退期(stage15)的表达呈现先升高后下降的趋势与转录组数据中可育环境中的表达量与不育环境中的表达量比值取Log2后分别为1.97、2.84和0.37基本一致。在不同育性环境下的这三个时期中,花药开裂时期(stage14)表达量均最高,且在不育环境的表达量是可育环境的2.8倍。

A:TaBG与miRNA互作图;B:tae-miR395a的发卡结构;C:TaBG蛋白互作网络图
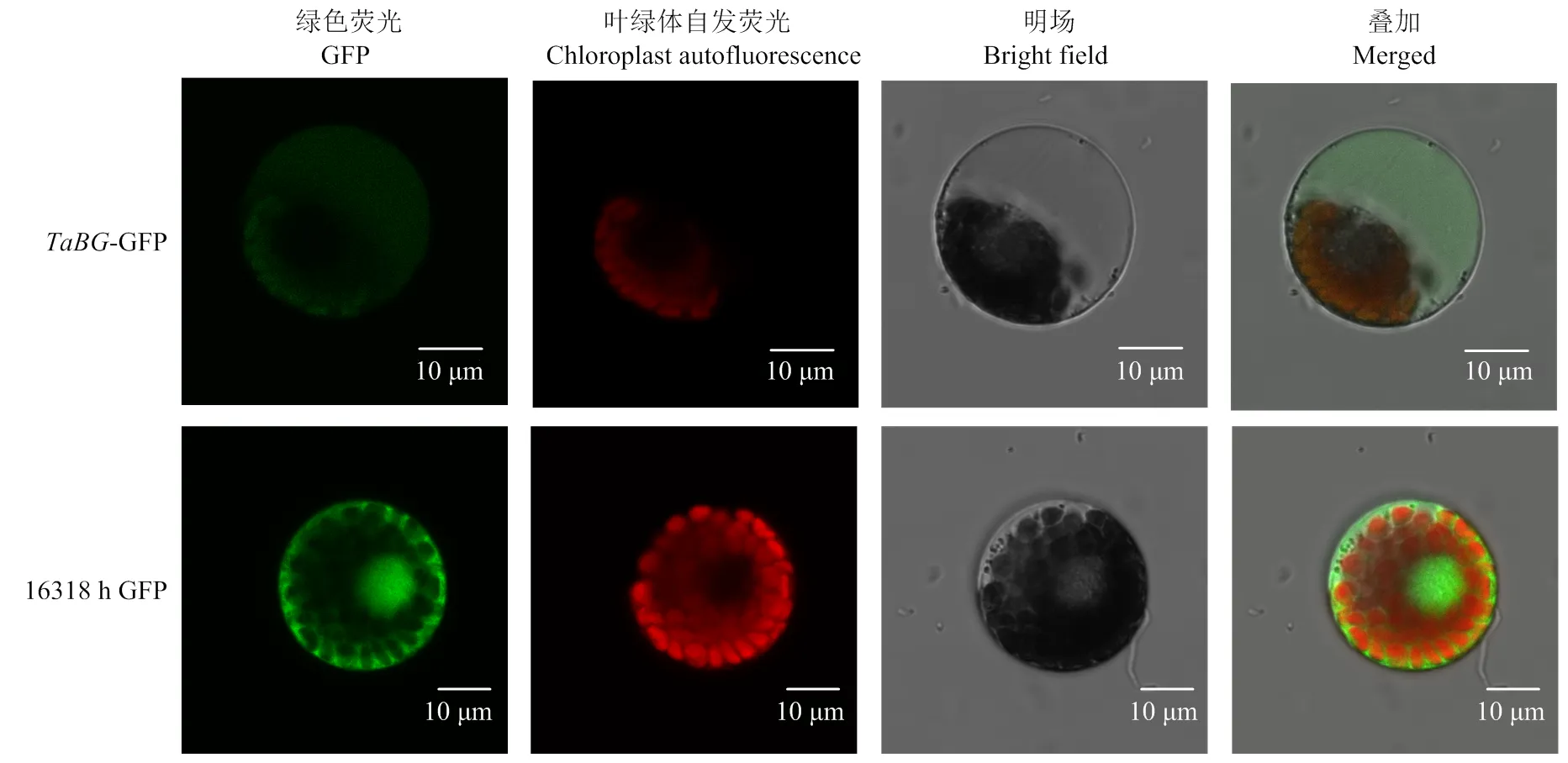
图7 TaBG-GFP融合蛋白的亚细胞定位
为进一步了解在小麦花药开裂期不同组织中的表达模式,分析了在根、茎、叶、颖壳、雌蕊、雄蕊中的表达模式,结果发现,在各组织中均有表达,在花药中表达量最高,在雌蕊中表达量最低(图8-B)。

图8 TaBG在小麦不同花药发育时期及组织中的表达模式
2.7 TaBG及tae-miR395a在MeJA、SA处理下的表达模式分析
通过分析启动子区顺式作用元件,发现启动子区包含有响应茉莉酸甲酯、水杨酸的元件。为确定该基因是否受茉莉酸甲酯和水杨酸调控,以及对该基因的调控方式,利用茉莉酸甲酯、水杨酸对开花前的花药进行处理。结果发现,不同浓度MeJA处理时,在花药中的表达总体下调,在0.5 mmol·L-1浓度处理下表达量最低(图9-A)。不同浓度的MeJA处理后再喷施SA(10 mmol·L-1),发现花药中的表达量比喷施SA前高。不同浓度MeJA处理时,与在花药中表达模式相反,花药中的表达呈现先升高后下降的趋势。在2 mmol·L-1MeJA浓度处理下,花药中表达量最高(图9-A)。不同浓度MeJA处理后再喷施SA(10 mmol·L-1),花药中的表达趋势与不同浓度MeJA处理时相似,但整体表达量较只进行不同浓度MeJA处理时要低(图9-A和图9-B)。
为研究在颖壳中是否也受MeJA及SA的调控,同时考察了MeJA及SA处理下颖壳中及互作的的表达模式。结果发现,在不同浓度MeJA处理时,在颖壳中的表达低于花药,不同浓度MeJA处理后表达下调(图9-C)。不同浓度MeJA处理后再喷施SA,颖壳中表达下调。MeJA处理下,颖壳中的表达量随着处理浓度的增加而升高,在2 mmol·L-1MeJA处理时达最大值(图9-C)。不同浓度MeJA处理后再统一喷施SA(10 mmol·L-1),颖壳中的表达量整体上比只进行MeJA处理时要低(图9-D)。
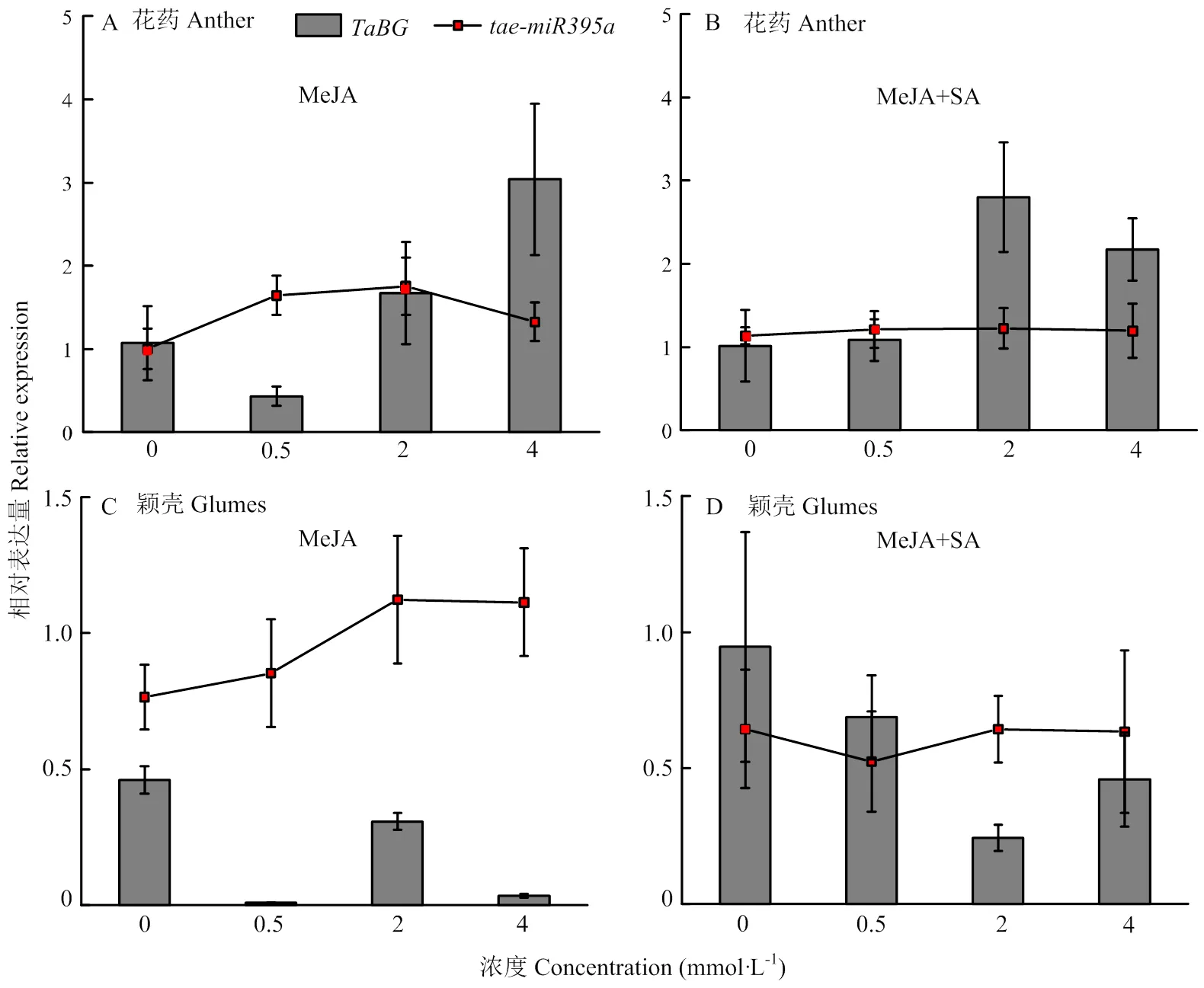
在MeJA(0、0.5、2和4 mmol·L-1)和SA(10 mmol·L-1)处理后,花药(A和B)和颖壳(C和D)中TaBG与tae-miR395a的相对表达量。MeJA:用不同浓度MeJA(0、0.5、2和4 mmol·L-1)处理麦穗。MeJA+SA:用不同浓度MeJA(0、0.5、2和4 mmol·L-1)处理麦穗后再喷施SA(10 mmol·L-1)
3 讨论
-葡萄糖苷酶在植物中参与很多代谢过程,包括防御[14]、释放活性激素、细胞壁的分解代谢、植物体内生物和非生物胁迫应答等[15]。当植物受到侵害致使植物细胞破碎时,-葡萄糖苷酶便能催化水解糖苷键释放防御化合物来抵御虫菌的侵害[16]。在植物中还发现许多以非活性形式存在的植物激素苷,他们很容易被特定-葡萄糖苷酶激活,从而调节植物体内的激素水平。在拟南芥中,AtBG1定位在内质网内膜上,能水解ABA-GE产生ABA,对干旱胁迫作出响应[17]。植物的细胞壁是最大的碳水化合物储存库,果胶是植物细胞壁的主要成分,细胞壁中果胶网络会随着植物细胞形状改变而分解,而多聚半乳糖醛酸酶能够催化果胶水解和分解,所以PGs对于植物发育也具有非常重要的作用[18]。在小麦细胞质雄性不育系中,通过群体定位得到的最有可能的候选基因是,该基因编码果胶酯酶,参与果胶代谢途径[19]。
研究表明-葡萄糖苷酶是纤维素水解的最后一步,能水解结合于末端非还原性的-D-葡萄糖键,同时释放出-D-葡萄糖和相应的配基[20]。在植物不同组织中也有分布,如主要在水稻的花和胚芽鞘中表达[21]。因此,推测在花药中的高表达也可增加花药中可溶性糖的含量,进而提高花药中特定区域细胞的渗透势以减缓花药的脱水活动。本研究中不开裂花药中的表达量比开裂花药的要高(图8-A),进一步证明了该推论。
蛋白质的生物学功能与其在细胞中的定位密切相关。TaBG小麦原生质体亚细胞定位结果显示此蛋白定位在液泡中,与拟南芥中的AtBG2定位在液泡中一致[17]。但是TaBG在花药中具体部位中的分布与花药内部不同区域水转运关系仍需进一步试验验证。
通过miRNA互作分析预测,发现在不同物种中存在540个miRNA与互作,其中主要的是和,分别以翻译抑制和剪切抑制的方式作用于(图6-A)。为植物中一个保守的miRNA家族,目前已经在多种植物中鉴定出来,在植物生长和发育过程中能够响应各种生物及非生物胁迫[22]。在水稻中,和在干旱胁迫下通过ABA途径下调表达[23]。在植物中不仅能以翻译抑制的方式作用于,它的靶基因还编码一类核转录因子(nuclear transcription factor YA,NF-YA)。在拟南芥中,miR169/NF-YA模型会参与对干旱和氮胁迫的响应,还会参与对糖代谢以及细胞伸长等生理过程的调控[24]。是一类与植物营养缺陷胁迫有关的miRNA。缺硫条件能诱导表达。硫作为植物的必要营养元素,在植物生长发育及代谢中起重要作用,其中,硫参与糖代谢并对淀粉的合成具有一定的影响。家族还参与多种植物对病害、冷害、硫营养等胁迫的响应过程[25]。MeJA处理下,花药表达上调(图9-A),由此推测miRNA可能通过调控从而增加花药中硫酸根的积累,进而促进淀粉形成,减少花药中可溶性糖的含量,以增加花药的脱水活动,促进花药开裂。
GMC氧化还原酶家族在生物体内葡萄糖、胆碱和甾醇等物质的代谢过程中发挥重要作用。内切葡聚糖酶主要将纤维素水解为葡萄糖[26]。蛋白互作预测研究表明,与糖基水解酶、GMC氧化还原酶(glucose-methanol-choline oxidoreductase)、内切葡聚糖酶(endoglucanase)等酶共同表达(图6-C)。它们共同作用于花药特定区域,使得花药中还原性糖含量增加,进而增加渗透势,减缓花药的脱水活动[27]。
前期研究表明,MeJA是重要的生长调节物质,涉及不同发育进程,例如开花、果实成熟和衰老[9]。在水稻中裂颖突变体(split husk 1,)是的等位突变体,编码JA生物合成途径中关键的丙二烯氧化合酶(allene oxide synthase,AOS)。的颖花形态与野生型基本一致,能正常开花但不能正常闭颖,突变体花药中茉莉酸含量降低[28]。对拟南芥茉莉酸突变体(花药不开裂,花丝短)的研究发现,茉莉酸能促进茉莉酸突变体花药开裂、加速花丝伸长和增加花粉活力。在小麦中也有研究表明花药开裂与MeJA密切相关,喷施MeJA能提高小麦花药开裂率。启动子响应元件分析发现,上游启动子区存在茉莉酸甲酯、水杨酸、脱落酸等顺式响应元件(表2)。为了进一步确定对小麦花药开裂的影响以及与的调控关系,本研究发现MeJA处理能降低花药中的表达(图9-A和图9-C),与前人研究中MeJA能促进花药开裂的结果一致[10]。另外发现,与互作的在花药和颖壳中表达下调。在喷施SA处理后表达整体上升,表明不同浓度MeJA处理后再喷施SA能促进的表达,从而使其互作的靶基因的表达受到抑制,进而促进花药开裂。
4 结论
从小麦光温敏核雄性不育系BS366花药中克隆到,该基因长1 473 bp,编码490个氨基酸,含有糖苷水解酶结构域,在植物中高度保守,属于糖基水解酶超家族1(cl23725);不开裂花药中,的表达量要高于开裂花药;花药在外源激素MeJA溶液处理下,能抑制的表达。
[1] WILSON Z A, SONG J, TAYLOR B, YANG C. The final split: the regulation of anther dehiscence. Journal of Experimental Botany, 2011, 62(5): 1633-1649.
[2] BROWNE R G, IACUONE S, LI S F, DOLFERUS R, PARISH R W. Anther morphological development and stage determination in. Front Plant Science, 2018, 9(2): 228.
[3] SANDERS P M, BUI A Q, WETERINGS K, MCINTIRE K N, HSU Y C, LEE P Y. Anther developmental defects inmale-sterile mutants. Sex Plant Reprod,1999, 11: 297-322.
[4] REUVENI M, SAGI Z, EVNOR D, HETZRONI A.-Glucosidase activity is involved in scent production in Narcissus flowers. Plant Science, 1991, 147(1): 19-24.
[5] XUE L J, ZHANG J J, XUE H W. Genome-wide analysis of the complex transcriptional networks of rice developing seeds. PLoS One, 2012, 7(2): e31081.
[6] LEAH R, KIGEL J, MUNDY J. Biochemical and molecular characterization of a barley seed -glucosidase. Biological Chemistry, 1995, 270: 15789-15797.
[7] RHEE S Y, OSBORNE E, POINDEXTER P D, SOMERVILLE C R. Microspore separation in the quartet 3 mutants of Arabidopsis is impaired by a defect in a developmentally regulated polygalacturonase required for pollen mother cell wall degradation. Plant Physiology, 2003, 133(3): 1170-1180.
[8] OGAWA M, KAY P, WILSON S, SWAIN S M. ARABIDOPSIS DEHISCENCE ZONE POLYGALACTURONASE1 (ADPG1), ADPG2, and QUARTET2 are polygalacturonases required for cell separation during reproductive development in. The Plant Cell, 2009, 21: 216-233.
[9] CHEONG J J, CHOI Y D. Methyl jasmonate as a vital substance in plants. Trends in Genetics, 2003, 19(7): 409-413.
[10] BAI J F, WANG Y K, WANG P, YUAN S H, GAO J G, DUAN W J, WANG N, ZHANG F T, ZHANG W J, QIN M Y, ZHAO C P, ZHANG L P. Genome-wide identification and analysis of thegene family in wheat (L.). BMC Genomics, 2018, 19(1): 754.
[11] LESCOT M, DéHAIS P, THIJS G, MARCHAL K, MOREAU Y, PEER Y V D, ROUZé P, ROMBAUTS S. PlantCARE, a database of plant-acting regulatory elements and a portal to tools for in silico analysis of promoter sequences. Nucleic Acids Research, 2002, 30: 325-327.
[12] 孙鹤, 郎志宏, 朱莉, 黄大昉. 玉米、小麦、水稻原生质体制备条件优化. 生物工程学报, 2013, 29(2): 224-234.
Sun H, Lang Z H, Zhu L, Huang D F. Optimized condition for protoplast isolation from maize, wheat and rice leaves.Chinese Journal of Biotechnology, 2013, 29(2): 224-234. (in Chinese)
[13] PFAFFL M W . A new mathematical model for relative quantification in real-time RT-PCR. Nucleic Acids Research, 2001, 29: 2003-2007.
[14] SUZUKI H, TAKAHASHI S, WATANABE R, FUKUSHIMA Y, FUJITA N, NOGUCHI A, YOKOYAMA R, NISHITANI K, NISHINO T, NAKAYAMA T. An isoflavone conjugate-hydrolyzing beta-glucosidase from the roots of soybean () seedlings: purification, gene cloning, phylogenetics, and cellular localization. Biological Chemistry, 2006, 281(40): 30251-30259.
[15] BRZOBOHATY B, MOORE L, KRISTOFFERSEN P, BAKO L, CAMPOS N, SCHELL J, PALME K. Release of active cytokinin by a beta-glucosidase localized to the maize root meristem. Science, 1993, 262(5136): 1051-1054.
[16] JONES P, VOGT T. Glycosyltransferases in secondary plant metabolism: tranquilizers and stimulant controllers. Planta, 2014, 213(2): 164-174.
[17] LEE K H, PIAO H L, KIM H Y, CHOI S M, JIANG F, HARTUNG W, HWANG I, KWAK J M, LEE I J, HWANG I. Activation of glucosidase via stress-induced polymerization rapidly increases active pools of abscisic acid. Cell, 2006, 126(6): 1109-1120.
[18] KE X, WANG H, LI Y, ZHU B, ZANG Y, HE Y, CAO J, ZHU Z, YU Y. Genome-wide identification and analysis of polygalacturonase genes in. InternationalJournal of Molecular Sciences, 2018, 19(8): 145156-145156.
[19] CHEN Y, JIA Y, NIU F, WU Y, YE J, YANG X, ZHANG L, SONG X. Identification and validation of genetic locusfor wheat fertility restoration in the presence ofcytoplasm. Theoretical and Applied Genetics, 2020: 1-11.
[20] DAVIES H G J C O I S B. Structural and sequence-based classification of glycoside hydrolases. 1997, 7(5): 637-644.
[21] CHUENCHOR W, PENGTHAISONG S, ROBINSON R C, YUVANIYAMA J, OONANANT W, BEVAN D R, ESEN A, CHEN C J, OPASSIRI R, SVASTI J, CAIRNS J R. Structural insights into rice BGlu1 beta-glucosidase oligosaccharide hydrolysis and transglycosylation. Journal of Molecular Biology, 2008, 377(4): 1200-1215.
[22] ZHAO M, DING H, ZHU J K, ZHANG F, LI W X. Involvement of miR169 in the nitrogen-starvation responses in. New Phytologist, 2011, 190(4): 906-915.
[23] ZHAO B, LIANG R, GE L, LI W, XIAO H, LIN H, RUAN K, JIN Y. Identification of drought-induced microRNAs in rice. Biochemical and Biophysical Research Communications, 2007, 354(2): 585-590.
[24] LEYVA-GONZALEZ M A, IBARRA-LACLETTE E, CRUZ-RAMIREZ A, HERRERA-ESTRELLA L. Functional and transcriptome analysis reveals an acclimatization strategy for abiotic stress tolerance mediated byNF-YA family members. PLoS One, 2012, 7(10): e48138.
[25] LIU W, CHENG C, CHEN F, NI S, LIN Y, LAI Z. High-throughput sequencing of small RNAs revealed the diversified cold-responsive pathways during cold stress in the wild banana (). BMC Plant Biology, 2018, 18(1): 308.
[26] TRUDEAU D L, LEE T M, ARNOLD F H. Engineered thermostable fungal cellulases exhibit efficient synergistic cellulose hydrolysis at elevated temperatures. Biotechnology and Bioengineering, 2014, 111(12): 2390-2397.
[27] BONNER L J, DICKINSON H G. Anther dehiscence in Lycopersicon esculentum Mill: I. Structural aspects. New Phytologist, 1989, 113(1): 97-115.
[28] 潘孝武, 刘文强, 黎用朝, 熊海波, 盛新年, 段永红, 余亚莹, 赵文锦, 魏秀彩, 李小湘. 水稻裂颖突变体的鉴定及基因定位. 中国水稻科学, 2019, 33(4): 323-330.
PAN X W, LIU W Q, LI Y C, XIONG H B, SHENG X N, DUAN Y H, YU Y Y, ZHAO W J, WEI X C, LI X X.Identification and genetic analysis. of split husk mutantin rice.Chinese Journal Of Rice Science, 2019, 33(4): 323-330. (in Chinese)
[29] 向群, 张立平, 赵昌平, 唐忠辉, 徐小芹, 苑少华. 外源茉莉酮酸甲酯通过调节相关基因表达诱导光温敏雄性不育小麦BS366离体花药开裂. 中国生物化学与分子生物学报, 2010, 26(11): 1028-1035.
Xiang Q, Zhang L P, Zhao C P, Tang Z H, Xu X Q, Yuan S H. Methyl jasmonic acid in vitro induces anther dehiscence of photothermo-sensitive male sterile wheat line BS366 through regulating related gene expression. Chinese Journal of Biochemistry and Molecular Biology, 2010, 26(11): 1028-1035.(in Chinese)
Cloning ofand analysis of its function in anther dehiscence in wheat
TAN ZhaoGuo1,2, LI YanMei2, BAI JianFang2, GUO HaoYu2, LI TingTing2, DUAN WenJing2, LIU ZiHan2, YUAN ShaoHua2, ZHANG TianBao2, ZHANG FengTing2, CHEN ZhaoBo2, ZHAO FuYong1, ZHAO ChangPing2, ZHANG LiPing1,2
1College of life sciences, Yangtze University, Jingzhou 434025, Hubei;2Beijing Engineering and Technique Research Center for Hybrid Wheat, Beijing Academy of Agriculture and Forestry Sciences/The Municipal Key Laboratory of the Molecular Genetics of Hybrid Wheat, Beijing 100097
【】-glucosidase (BG, 4--D-glueosidase) is a kind of hydrolase which hydrolyzes glycosidic bond from glycopolymer or oligosaccharide to release non reducing sugar group, which plays an important role in controlling anther dehiscence. The anthers of the photoperiod-temperature sensitive genic male sterile (PTGMS) wheat line BS366 did not dehiscence in sterile environment, but completely or partially cracked in fertile environment. In order to study the regulatory function ofgene on anther dehiscence in wheat, thewas cloned from BS366 and its potential function in anther dehiscence was analyzed, which provided theoretical basis for further analysis of molecular mechanism of abnormal anther dehiscence in photoperiod thermo sensitive male sterile line of wheat.【】was cloned from the anther of PTGMS line BS366, and the primary structure, secondary structure, tertiary structure of TaBG proteinwere predicted. In addition, the cis-acting elements in promoter region prediction, phylogenetic tree construction with other species, interaction between miRNA and TaBG were performed using bioinformatics software. The expression levels ofand the interactedin anthers and glumes under MeJA and SA treatment were determined. 【】 The total length ofis 1 473 bp, which encoded 490 amino acids, andthe theoreticalis 8.12, belonging to the glycosylhydrolase superfamily. The results showed thatmay be regulated by stress resistance-related miRNAs, such asand. Based on the prediction of protein interaction, it was found thatmight interact with glucose-methanol-choline oxidoreductase (GMC) and endoglucanase (EG). TaBG is located in the liquid bubble of the wheat proton. The qPCR results showed that the expression ofin Bilocular stage (stage 13), Dehiscence (stage14) and Senescence (stage15) showed an upward and then downward trend.was the highest expression in Dehiscence, and the expression ofin no dehiscence of anther was 2.8 times higher than that of complete dehiscence of anther. After treatment of MeJA, the expression ofin anther and glume showed downward. Theexpression pattern was the opposite.【】might be involved in anther dehiscence with stress tolerance related miRNA such asand. High expression ofcould increase the content of soluble sugar in the anther under the sterile environment, and then increase the osmotic potential in the anther, so as to slow down the dehydration of anther dehiscence. This study will lay a foundation for elucidating the biological function ofin regulating anther dehiscence.
wheat; 4--D-glueosidase; miRNA; anther dehiscence

10.3864/j.issn.0578-1752.2021.13.002
2020-11-25;
2021-02-05
国家自然科学基金(31872881)、国家自然科学青年基金(31901490)、北京市农林科学院杰出科学家项目(JKZX201907)
谭照国,Tel:18977388904;E-mail:tanzhaoguo@foxmail.com。李艳梅,E-mail:lymei1013@163.com。谭照国和李艳梅为同等贡献作者。通信作者赵福永,E-mail:fyzhao@yangtzeu.edu.cn。通信作者赵昌平,E-mail:cp_zhao@vip.sohu.com。通信作者张立平,Tel:13681046953;E-mail:lpzhang8@126.com
(责任编辑 李莉)

