酿酒酵母高密度增殖酒糟多肽糖蜜培养基优化
苏 昊,梁璋成,林晓姿,何志刚 ,邓冬莲,林晓婕
[1. 福建省农业科学院农业工程技术研究所,福建 福州 350003;2. 福建省农产品(食品)加工重点实验室,福建 福州 350003]
0 引言
【研究意义】酿酒酵母(Saccharomyces cerevisiae)是酵母菌属中最重要、应用最广泛的一类,在食品发酵、功能性营养源和生物领域等有重要作用[1]。酿酒酵母菌体富含活性多糖[2]、蛋白质[3]、活性肽[4]、核酸[5]、氨基酸[6]、维生素[7]等营养功能成分,被不断研究开发并应用于医药、功能食品和饲料等多个行业。酿酒酵母高密度发酵过程中,培养基的营养控制是关键,其营养成分不均衡会使酵母细胞的生长受到抑制。实现酿酒酵母产业化应用的前提是获得高浓度的酵母细胞。酵母工业化生产培养基主要原料来源于制糖废料糖蜜,糖蜜长期以来作为发酵工业中的碳源用于发酵生产酵母,是酵母生产中不可缺少及替代的廉价原料[8]。【前人研究进展】已有研究表明小麦、大豆等谷物蛋白酶解物中的多种小分子多肽,包括Leu-Asp、Ala-Leu-Asp、Ala-Gln-Pro、Glu-Asn-Gly、Leu-Leu-Leu-Trp、Pro- Pro-Tyr等,可促进酵母细胞的生长[9−10],并可提高酿酒酵母的逆环境耐受性和细胞存活率,促进酵母细胞的增殖[11−13]。前期研究还发现以红曲酒糟酶解制备的多肽[14−15]中的天门冬氨酸、谷氨酸、苯丙氨酸、缬氨酸、亮氨酸和甘氨酸总质量分数达53.50%,是一种优质的蛋白质营养资源。作为酵母的增殖培养基,糖蜜存在营养不均衡的缺陷,往往需要添加一种或多种的氮碳源、无机盐类及其他增殖因子等营养强化剂,以实现有效的高密度培养。如Wang等[16]利用常见的农副产物,在糖蜜的基础上,添加1.56%的麦麸和0.21%的CaCO3,对马克斯克鲁维酵母的增殖培养基进行优化,优化后的培养基中酵母生长菌量达到了7.8×108cfu·mL−1,是YPD培养基的4.11倍,同时原料成本仅为其1/6。红曲酒糟作为红曲黄酒生产中的重要副产物,其中含有大量可被转化的氨基酸和小分子多肽成分,原料来源广泛且价格低廉,可用于酵母的增殖。【本研究切入点】但目前,使用酒糟中的多肽成分作为酵母增殖因子的相关报道仍然鲜见。【拟解决的关键问题】本研究以分离于红曲黄酒中的优良酿酒酵母JH301[17]为研究对象,以酵母菌工业生产常用糖蜜为基础培养基,以红曲酒糟制备的酒糟多肽为天然活性增殖因子,辅以多种碳源、氮源、无机盐,对培养基的配方加以优化,为制备酿酒酵母高活力菌剂提供低成本高密度培养基。
1 材料与方法
1.1 试验试剂
孟加拉红培养基:市售,用于酿酒酵母计数。
红曲酒糟:由福建宁德黄家酒业提供,当年生产红曲酒糟,60 ℃烘干粉碎后备用;蛋白质质量分数38.2%,含水量10.3%。
复合蛋白酶(200000 U·g−1),江苏锐阳生物科技有限公司。
大米、大蒜等辅料均为市购。
糖蜜、菊粉和大豆多糖等添加剂均为食品级,其他化学试剂均为国产分析纯。
1.2 仪器与设备
SPX-250BS-II生化培养箱(上海新苗医疗器械制造有限公司),YXQ-CS-50S II全自动立式压力蒸汽灭菌器(上海博达实业有限公司医疗设备厂),SWCJ-1FD型单人单面净化工作台(苏州净化设备有限公司),UV-1750紫外可见分光光度计(苏州岛津仪器有限公司),FE28型pH酸度计(梅特勒-托利多),HH-8数显电热恒温水浴锅(常州亿通分析仪器制造有限公司)。
1.3 材料制备
酿酒酵母JH301:分离于红曲米,由福建省农产品(食品)加工重点实验室选育,保藏号:CCTCC M2015226。
基础培养基制备:将糖蜜用蒸馏水搅拌稀释至可溶性固形物为45%~50%,使用柠檬酸pH值调节至3.5~3.8,搅拌加热至90 ℃保温10 min,冷却静置后取上清液稀释至可溶性固形物含量为10%,调节pH值至4.5±0.2。
酒糟多肽制备:本实验室自制。将红曲酒糟和水以固液比为1∶10混匀,加入1%蛋白复合酶,调节pH值为8.5,50 ℃下恒温酶解3 h,121 ℃下灭酶10 min,冷却静置收集上清液,备用。其中,可溶性蛋白含量不低于250 g·L−1。
大米糖化液制备:按米饭与水质量比1:1混合,添加70 U·g−1的淀粉酶、560 U·g−1糖化酶,60 ℃下酶解2 h,冷却并调整糖化液可溶性固形物为30%,备用。
大蒜汁制备:去皮大蒜与水质量比1∶2,搅碎,搅拌加热至微沸。过滤,冷却,115 ℃灭菌20 min。
1.4 试验方法
1.4.1 种子液的制备 将酿酒酵母JH301菌种接入基础培养基,在30 ℃、150 r·min−1的摇床上培养18 h,获 得种子液。
1.4.2 单因素试验 将基础培养基分别添加不同质量浓度的碳源、氮源、无机盐与天然产物促进因子,其中碳源(葡萄糖、蔗糖、麦芽糖、半乳糖、海藻糖、棉籽糖)的添加量分别为10、30、50、70、90 g·L−1;氮源(胰蛋白胨、硫酸铵、硝酸钾、铵水、牛肉膏)的添加量分别为5、10、20、30、40、50 g·L−1;无机盐(硫酸镁、氯化钾、磷酸二氢钾、磷酸氢二钾)的添加量分别为0.5、1.0、3.0、5.0、7.0 g·L−1;天然产物增殖因子(大米糖化液、大豆多糖、酒糟多肽、菊粉、大蒜汁)的添加量分别为10、30、50、70、90 g·L−1。按体积分数2%的接种量接入活化后的酿酒酵母种子液,分别测定培养时间0 和18 h的培养液OD600值,计算ΔOD600=OD18 h−OD0h,以基础培养基发酵18 h的ΔOD600为对照CK,考察 各营养强化剂对酿酒酵母JH301生长的影响。
1.4.3 增殖培养基优化 根据单因素试验结果,选取对酿酒酵母增殖影响显著的碳源、氮源、无机盐及天然产物增殖因子作为影响因子,以酵母菌菌体密度为指标,采用均匀试验对培养基配方进行优化。各处理培养基pH均调节至4.5±0.2,按体积分数 2%的接种量接种后于30 ℃培养18 h。
1.4.4 指标测定
(1)酿酒酵母OD值的测定
取发酵后的菌悬液,稀释10倍后,使用光密度法测定OD600吸光值[18]。
(2)酿酒酵母生物量
参照GB 4789.15—2016《食品安全国家标准食品微生物学检验霉菌和酵母计数》中的方法测定酵母菌生物量,采用平板计数法。
(3)酿酒酵母菌体密度对数值
菌体密度对数值以酵母生物量的log值进行换算得到。
1.5 数据处理
采用DPS 7.05软件中的Duncan法对单因素试验中,不同质量浓度和不同种类的碳源、氮源、无机盐及天然产物增殖因子对酵母菌增殖量即ΔOD600的差异性进行比较,筛选出对酵母菌增殖有显著促进作用的营养因子及其质量浓度。
2 结果与分析
2.1 碳源对酿酒酵母JH301生长的影响
由图1可见,以添加量为0 g·L−1碳源的试验组为CK,随着培养基中碳源浓度的增加,添加不同碳源处理的ΔOD600均呈现先升高后降低的趋势,且差异显著。其中,海藻糖、棉籽糖、葡萄糖的增殖效果较好,在添加30 g·L−1海藻糖、50 g·L−1棉籽糖和30 g·L−1葡萄糖时有最大值,碳源ΔOD600分别比CK提高了1.42、1.46和1.11倍,这3个处理的ΔOD600均显著高于蔗糖、半乳糖和麦芽糖,表明海藻糖、棉籽 糖和葡萄糖是促进酿酒酵母JH301生长的适宜碳源。

图1 碳源种类及质量浓度对JH301生长的影响Fig. 1 Effects of C sources and concentrations on growth of JH301
2.2 氮源对酿酒酵母JH301生长的影响
由图2可知,不同氮源对酵母的增殖效果存在差异,以添加量为0 g·L−1氮源的试验组为CK,随着培养基中氮源质量浓度的增加,添加胰蛋白胨的处理ΔOD600呈现先升高后降低的趋势,在添加30 g·L−1时达到最高,比CK的ΔOD600提高了1.28倍,添加氨水、硝酸钾、硫酸镁、牛肉膏的最高ΔOD600增量均显著低于添加30 g·L−1胰蛋白胨的处理,表明胰蛋白胨是促进酿酒酵母JH301生长的适宜氮源。

图2 氮源种类及质量浓度对JH301生长的影响Fig. 2 Effects of N sources and concentrations on growth of JH301
2.3 无机盐对酿酒酵母JH301生长的影响
由图3可知,以添加量为0 g·L−1无机盐的试验组为CK,随着培养基中无机盐质量浓度的增加,添加硫酸镁、磷酸氢二钾、磷酸二氢钾的处理ΔOD600均呈现先升高后降低的趋势,分别在添加1 g·L−1硫酸镁、3 g·L−1磷酸氢二钾、5 g·L−1磷酸二氢钾 时 有 最 大 值,其 中 添 加5 g·L−1磷 酸 二 氢 钾的ΔOD600最大,与前两个处理差异均达显著水平,是促 进酿酒酵母JH301生长的适宜无机盐。

图3 无机盐种类及质量浓度对JH301生长的影响Fig. 3 Effects of inorganic salts and concentrations on growth of JH301
2.4 天然产物增殖因子对酿酒酵母JH301生长的影响
由图4可知,以添加量为0 g·L−1天然产物增殖因子的试验组为CK,随着培养基中天然产物增殖因子质量浓度的增加,添加大米糖化液、大豆多糖、酒糟多肽、菊粉、大蒜汁的处理ΔOD600均呈现先升高后降低的趋势,且差异显著,分别在添加50 g·L−1大米糖化液、50 g·L−1大豆多糖、50 g·L−1酒糟多肽、30 g·L−1菊粉、10 g·L−1大蒜汁时有最大值。大米糖化液、大豆多糖和酒糟多肽的ΔOD600分别比CK提高了0.82、0.96和1.22倍,均显著高于菊粉、大蒜汁。因此选择酒糟多肽、大豆多糖、大米糖化液作为 适宜增殖因子进行后续试验。

图4 天然产物增殖因子及质量浓度对JH301生长的影响Fig. 4 Effects of natural growth promoters and concentrations on growth of JH301
2.5 增殖培养基的优化
用均匀设计法考察培养基各成分磷酸二氢钾(x1)、胰蛋白胨(x2)、海藻糖(x3)、葡萄糖(x4)、棉籽糖(x5)、酒糟多肽(x6)、大豆多糖(x7)、大米糖化液(x8)对酿酒酵母JH301菌体密度的影响 ,结果见表1。
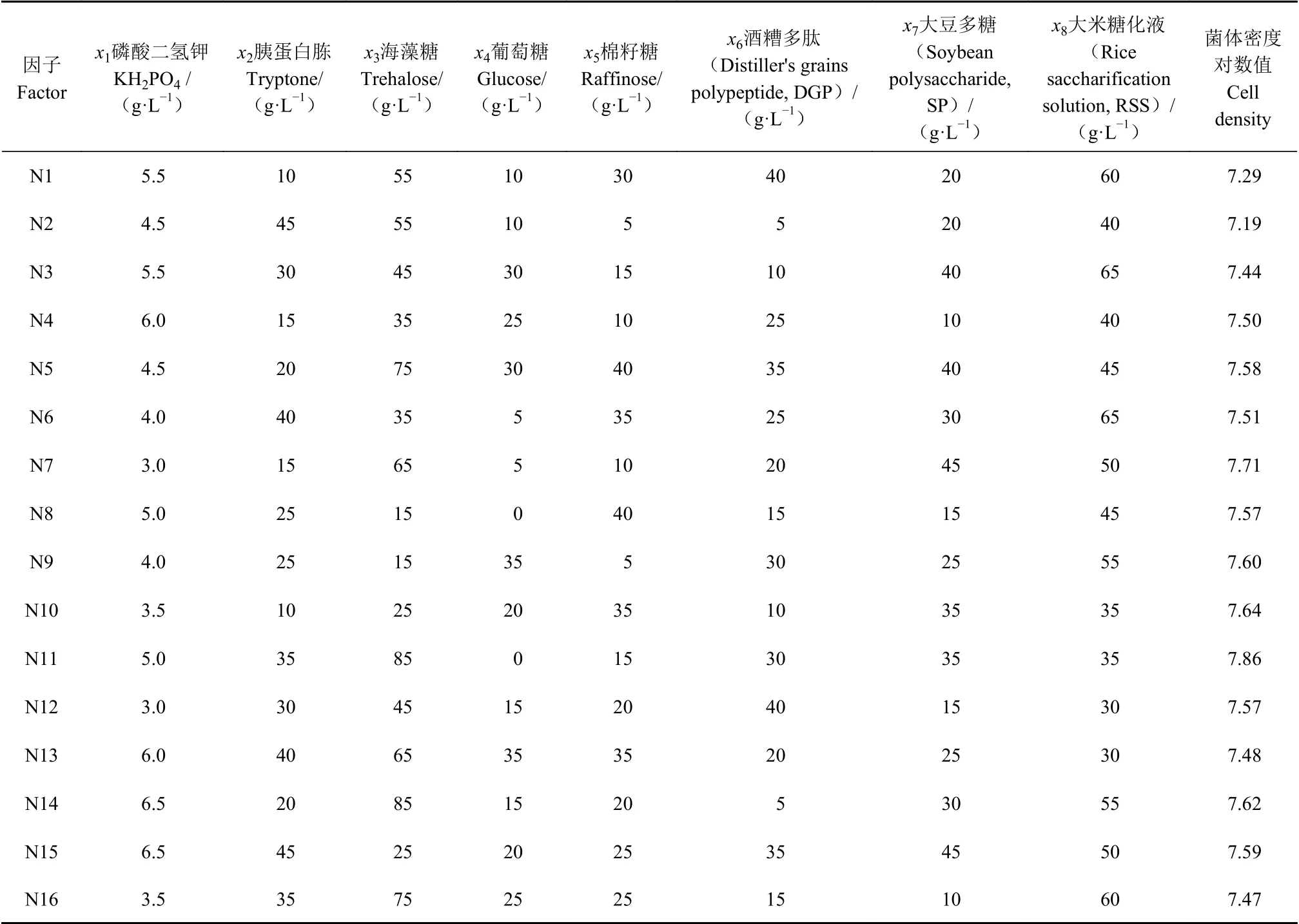
表1 U16(88)均匀试验结果Table 1 Results of U16(88) uniform test
2.5.1 多因子及平方项逐步回归分析 以菌体密度对数值为目标值进行多因子及平方项逐步回归分析,得到回归方程:

回归方程系数R2=0.9996,P<0.01。由回归方程可知,酿酒酵母JH301的增殖与胰蛋白胨(x2)、葡萄糖(x4)、棉籽糖(x5)、酒糟多肽(x6)、大豆多糖(x7)、大米糖化液(x8)呈开口向下的抛物线关系,与海藻糖(x3)呈负相关关系。模型1寻优后得到最优培养基组合见表2,预测酿酒酵母JH301培养的最高菌体密度对数值为8.19。

表2 模型1优选培养基组合Table 2 Medium formulation optimization by stepwise regression of multiple factors and square terms
2.5.2 多因子及互作项逐步回归分析 以菌体密度对数值为目标值通过偏最小二乘法考虑互作项的回归方法,建立回归模型:
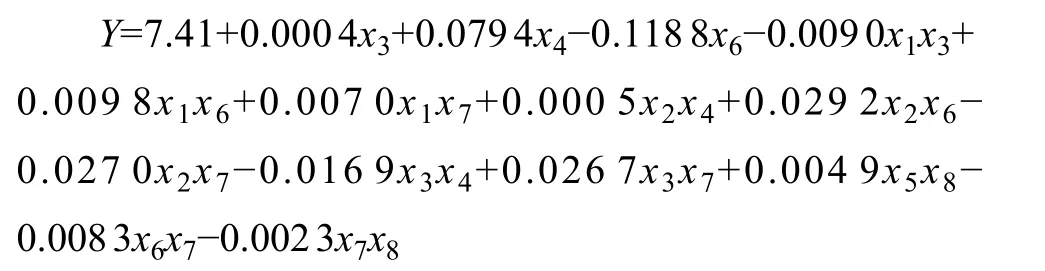
回归模型R2=1.0000,P<0.01。模型2寻优后得到最优培养基组合见表3,模型预测酿酒酵母JH301培 养的最高菌体密度对数值为9.51。

表3 模型2优选培养基组合Table 3 Medium formulation optimization by stepwise regression of multiple factors and interaction
2.5.3 二次多项式逐步回归分析 以菌体密度对数值为目标值,进行二次多项式逐步回归分析,建立回归模型:

回归模型R2=1.0000,P<0.01。模型3寻优后得到最优培养基组合见表4,模型预测酿酒酵母JH301培 养的最高菌体密度对数值为8.79。

表4 模型3优选培养基组合Table 4 Medium formulation optimization by quadratic polynomial stepwise regression analysis
2.5.4 验证试验 根据各模型的优选培养基成分组合配制培养基,调节pH为4.5±0.2,测定酵母菌生物量。根据模型2和模型3的培养基最优组合进行验证培养,18 h后菌体密度对数值分别为7.23和7.65,与对应模型预测结果差异均达极显著水平(P<0.01);而模型1的培养基最优组合培养酿酒酵母的菌体密度对数值可达8.17(生物量为1.48×108cfu·mL−1),与该模型预测结果差异不显著(P>0.05),显著高于对照组基础培养基培养18 h后活菌密度7.08(生物量为1.23×107cfu·mL−1),生物量提高1个数量级以上。因此,选择模型1的数学模型:Y=5.93+0.18x2−0.010x3+0.06x4+0.21x5+0.21x6+0.18x7+0.16x8−0.021x22−0.009x42−0.023x52−0.022x62−0.016x72−0.021x82为 酵 母 增 殖 数 学模型,寻优的培养基组合即为酿酒酵母增殖培养基配 方。
3 讨论与结论
培养基中添加额外营养成分在酵母发酵生产研究和应用中已经很常见,如在啤酒高浓酿造中补充营养物质可以促进酵母的生长代谢和发酵性能,补充适量的氮源不仅可供酵母繁殖同化之用,而且有助于酵母抵抗高渗透压和乙醇浓度[19]。应用于酵母发酵中的氮源主要是氨基酸、蛋白胨、铵盐以及植物蛋白水解物等,而近年来的很多研究发现,植物蛋白水解物中能分离出各种生物活性肽。奚宽鹏等[20]发现小麦面筋蛋白水解物中的小分子肽可以调节酵母生长、改善酵母的渗透压耐受性,其中促进酵母的生长和发酵的主要是小于3 kDa的活性肽;刘梦兰等[21−22]明确了大豆多肽能够促进酵母细胞增殖、增强酵母细胞的耐冻性、提高面团的发酵效果;Kitagawa等[23]发现添加0.5%的大豆肽能够有效促进酵母生长,提髙发酵速率,而且同时也证明酵母对小分子肽的代谢优于游离氨基酸。前期研究发现酒糟经复合酶分解得到的多肽成分多达18种氨基酸,其构成的多肽成分种类组成上要高于已有报道其他植物蛋白酶解物,其中天门冬氨酸、谷氨酸、苯丙氨酸、缬氨酸、亮氨酸等构成的有助于酵母生长的小分子多肽含量达到了53.5%[14],这些活性肽成分在酵母增殖过程中可被优先吸收利用,为酿酒酵母快速增殖奠定基础,除此之外还含有精氨酸、亮氨酸等作为调节因子,增强酵母细胞对小分子肽的感应能力,促进细胞对小分子肽的吸收[20],因而酒糟多肽可作为酿酒酵母增殖的优良复合营养剂。
目前,对酿酒酵母培养基的优化研究多集中于实验室培养模式的优化,如王颖等[24]优化葡萄糖组成后可提高菌量22%;汪芳等[25]优化碳源、氮源用量使细胞干重达到30.62 g·L−1;陈雪等[26]将酵母浸粉作为活性增殖因子加入培养基,使酵母菌干质量较优化前提高了23.3%,等等。采用糖蜜进行酵母培养时,往往需要额外添加碳源、氮源、无机盐等对其进行营养强化,同时添加植物源多肽等增殖因子以达到促进酵母菌增殖的作用。相比其他已有的对酵母增殖培养的研究,本文采用酒糟多肽作为酿酒酵母天然增殖因子,其与常规的葡萄糖、海藻糖、胰蛋白胨等营养物质进行培养基的优化,经优化后配方培养,可使酿酒酵母菌量提高了91.6%,酵母菌干质量提高了30%,增菌效果显著,达到了高密度培养的目的。红曲酒糟是红曲黄酒生产的主要副产物,生产1 t红曲黄酒可产生200 kg左右的酒糟,目前其主要作为普通的饲料出售,附加值低[27]。红曲酒糟中含有30%~40%的粗蛋白[28],经酶解处理成为酒糟多肽,酒糟多肽含有丰富的小分子肽成分,可作为酿酒酵母的生长营养因子及优良的增殖营养剂。将红曲酒糟经酶解后制备为酒糟多肽,作为酵母增殖培养的营养剂,原料来源丰富,又提高其附加值,实现了酒糟废弃资源的高值化利用。
本研究以酿酒酵母JH301为对象,在糖蜜基础培养基的基础上,通过均匀试验,获得酿酒酵母高密度增殖培养基最优组合为:在可溶性固形物10%的糖蜜中分别添加酒糟多肽23.72 g·L−1、大米糖化液44.15 g·L−1、大豆 多 糖31.88 g·L−1、棉 籽糖22.45 g·L−1、葡萄糖13.97 g·L−1、海藻糖15.00 g·L−1、胰蛋白胨27.25 g·L−1、磷酸二氢钾3.00 g·L−1,调节pH为4.5±0.2。菌体增殖密度对数值可达8.17(生物量为1.48×108cfu·mL−1)。据测算,糖蜜基础培养基经优化后,使得酵母菌的菌量提高了1个数量级以上,生产每kg菌量达1.0×1010cfu·g−1的鲜酵母可降低成本84.25%,具有低成本高密度增殖特点。

