2018—2020年福建省稻瘟病菌无毒基因型鉴定与分析
邓 云
(福建省南平市农业科学研究所,福建 南平 354200)
0 引言
【研究意义】由稻瘟病菌(Magnaporthe oryzae,无性世代为Pyricularia oryzae)引起的稻瘟病是水稻上最具毁灭性的真菌病害,也是福建省水稻生产中最严重的真菌性病害之一[1−6]。目前,全国因稻瘟病引起的水稻产量损失已经达到每年10亿kg,给我国粮食安全带来了严重隐患[7−8]。培育和种植抗病品种不仅能有效解决因农药造成的残毒和环境污染问题,同时能够遏制稻瘟病流行,是防治稻瘟病最安全、经济和有效的途径。然而,稻瘟病菌生理小种的专化性、遗传复杂性和频繁变异,导致抗病水稻品种在连续推广3~5年后抗性降低甚至丧失。【前人研究进展】优质抗原主要来源于稻瘟病多发区域内经长时间自然选择留下的品种及野生稻和栽培稻等稻种资源中表现出抗稻瘟病的品种[6]。根据Flor[9]的基因对基因学说,水稻在抵抗稻瘟病菌侵染过程中,寄主的抗病基因与稻瘟病菌的无毒基因间编码产物可互作识别,引发过敏性坏死反应(HR),抑制稻瘟病菌在植株中的扩展,从而产生抗病效应[10],李宏宇等[11]认为水稻与稻瘟病菌之间的特异互作符合“基因对基因”假说,即水稻品种有一种抗病基因R,稻瘟菌中就会有一个与之对应的无毒基因。福建省是稻瘟病多发地区,国内已有不少学者对福建省的稻瘟病菌小种组成、分布和消长动态、稻瘟病菌无毒基因在地区和年份间差异情况进报道[12−21]。【本研究切入点】随着福建省主栽品种的变化,稻瘟病菌的无毒基因出现频率也随之改变,因此有必要分析稻瘟病菌近年来无毒基因年份间的动态变化情况。【拟解决的关键问题】本研究通过采集、分离2018—2020年福建省各主要稻区的稻瘟病生理小种,筛选出具有抗性频率高、广谱抗性的抗瘟基因,为今后根据不同地区流行菌株的无毒基因型和变化趋势选择培育具有相应广谱抗病基因的水稻品种并进行合理布局,为提高水稻品种的抗性水平、延长抗性周期、防治稻瘟病奠定基础[22−27]。
1 材料与方法
1.1 试验材料
24个近等基因水稻(NILs)和对照高感品种丽江新团黑谷(LTH)由福建省农业科学院生物技术研究所田大刚转赠。供试的稻瘟病菌单孢分别于2018—2020年采集自福建省南平、三明、龙岩等26个水稻种植地,每年9月中下旬(中稻黄熟期)随机采集稻瘟病发生区域的穗颈部样本,标明采集日期和地点,共计样本179份(表1)。每年分离的稻瘟病菌单孢培养于滤纸片上并放−20 ℃冰箱保存备用。

表1 2018—2020年福建省稻瘟病菌供试菌株Table 1 M. oryzae sample collection, 2018-2020
1.2 试验方法
致病性测定方法参照陈福如等[20]的方法以及稻瘟病苗期鉴定标准,病情调查方法参照辛威等[5]的方法。单个稻瘟病菌株的致病力(Pathogenic frequency,PF)、致病力类型划分等参考杨秀娟等[21]的方法。致病力PF(%)=(感病水稻资源材料数量/所有供试水稻资源材料总数)×100。当PF≥ 70.0%时为强致病力,70.0%>PF≥50.0%时为较强致病力,50.0%>PF≥20.0%时为中等致病力,PF<20.0%时为弱致病力。
单个抗病基因的抗性频率(Resistance frequency,RF)RF(%)=(对测试抗病基因无致病力的菌株数/所有菌株数)×100。
稻瘟病菌培养基为淀粉培养基,配方:可溶性淀粉10 g,酵母膏2 g,CaCo33 g,琼脂粉16 g,蒸馏水1 000 mL,pH6.5。
1.3 统计分析
根据供试菌株对NILs的致病情况建立0-1数据库,抗病记为1,感病记为0。用IBM SPSS Statistics19数据处理系统进行系统聚类分析,对供试菌株进行分类划分并综合衡量其遗传差异大小,构建其遗传关系树状,参考刘翔[1]的方法。
2 结果与分析
2.1 福建省稻瘟病菌株对已知抗病基因水稻品种的致病性
供试的179个稻瘟病菌株对24个含单个抗病基因水稻品种的致病性显示,强致病力菌株占比26.81%,较强致病力菌株占比36.31%,中等致病力菌株占比27.37%,弱致病力菌株占比9.51%,较强致病力菌株占优势,说明福建省的大多数稻瘟病菌株对供试24个抗病基因表现较强的致病力。
2.2 单个抗稻瘟病基因对福建省稻瘟病菌的抗性频率
表2显示,24个含单个抗病基因的近等基因系对福建省的稻瘟病菌群体的抗性频率为19.32%~91.49%,其中Pi-z5和Pi-9(t)两个抗病基因的抗性频率最高,分别为91.49%和91.25%,Pi-kh和Pi-1两个抗病基因的抗性频率也较高,在80%~90%,Pi-7(t)、Pi-5(t)、Pi-k、Pi-12(t)等4个抗病基因的抗性频率在70%~80%,Pi-ta和Pi-b的抗性频率较低,低于20%。
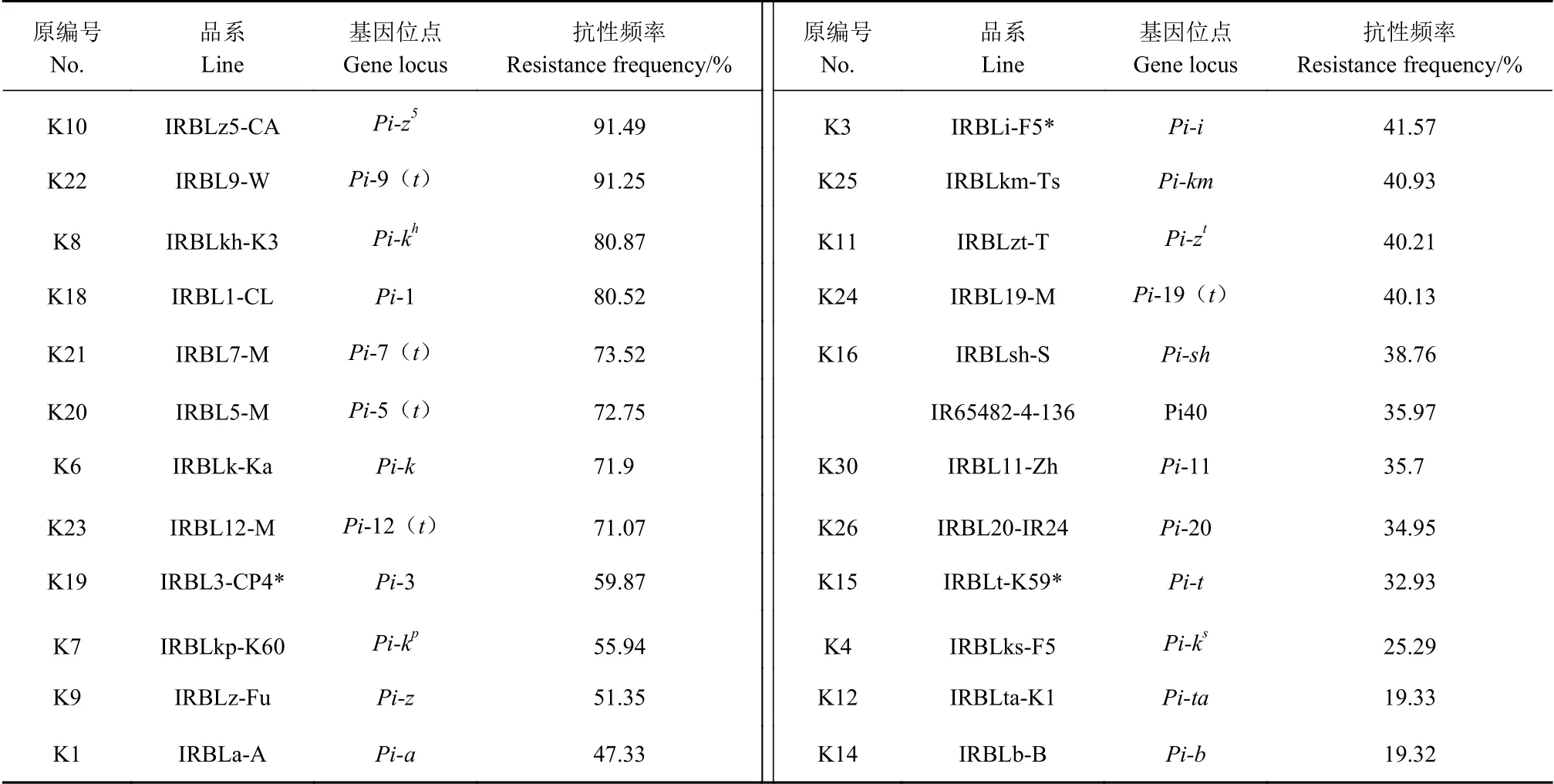
表2 抗稻瘟病基因对福建省稻瘟病菌的抗性频率Table 2 Effect of blast resistant genes on frequency of resistance to M. oryzae isolated in Fujain
2.3 福建省稻瘟病菌无毒基因在2018—2020年间的分布
表3中24个福建稻瘟病菌的无毒基因在2018—2020年的分布变化情况可以看出,2018—2020年24个无毒基因出现的总的平均频率逐年下降,由2018年的49.57%下降至2020年的38.01%,Avr-Z5,Avr-9(t)这2个无毒基因在3个年度中出现的频率都在80%以上,平均出现频率分别为88.95%和87.37%,年度间变化不大且稳定;Avr-1、Avr-kh、Avr-k、Avr-12(t)、Avr-7(t)、Avr-5(t)、Avr-3等7个无毒基因出现的平均频率在50%~80%;无毒基因在2018—2020年出现频率下降20%的有9个,分别为Avr-kh、Avr-7(t)、Avr-5(t)、Avr-3、Avr-kp、Avr-19(t)、Avr-km、Avr-z和Avr-ks,无毒基因在2018—2020年出现频率上升20%有1个,Avr-20的频率由16.67%上升至50.00%。平均出现频率低于20%的3个无毒基 因为Avr-ks、Avr-b、Avr-ta,应用中应谨慎使用。

表3 福建省稻瘟病菌无毒基因在2018-2020年间的分布Table 3 Distribution of avirulent genes of M. oryzae in Fujian, 2018-2020
2.4 2018—2020年福建省稻瘟病菌的无毒基因的数量
表4的结果显示,检测的179个稻瘟病菌株分别含有0~22个数目不等的无毒基因,在数目上共出现了23种类型,含有6、7、8、9、11个无毒基因的病菌最多,在群体中的频率分别为10.06%、8.94%、8.94%、7.82%和8.38%,其中含有6个无毒基因的频率 最高。
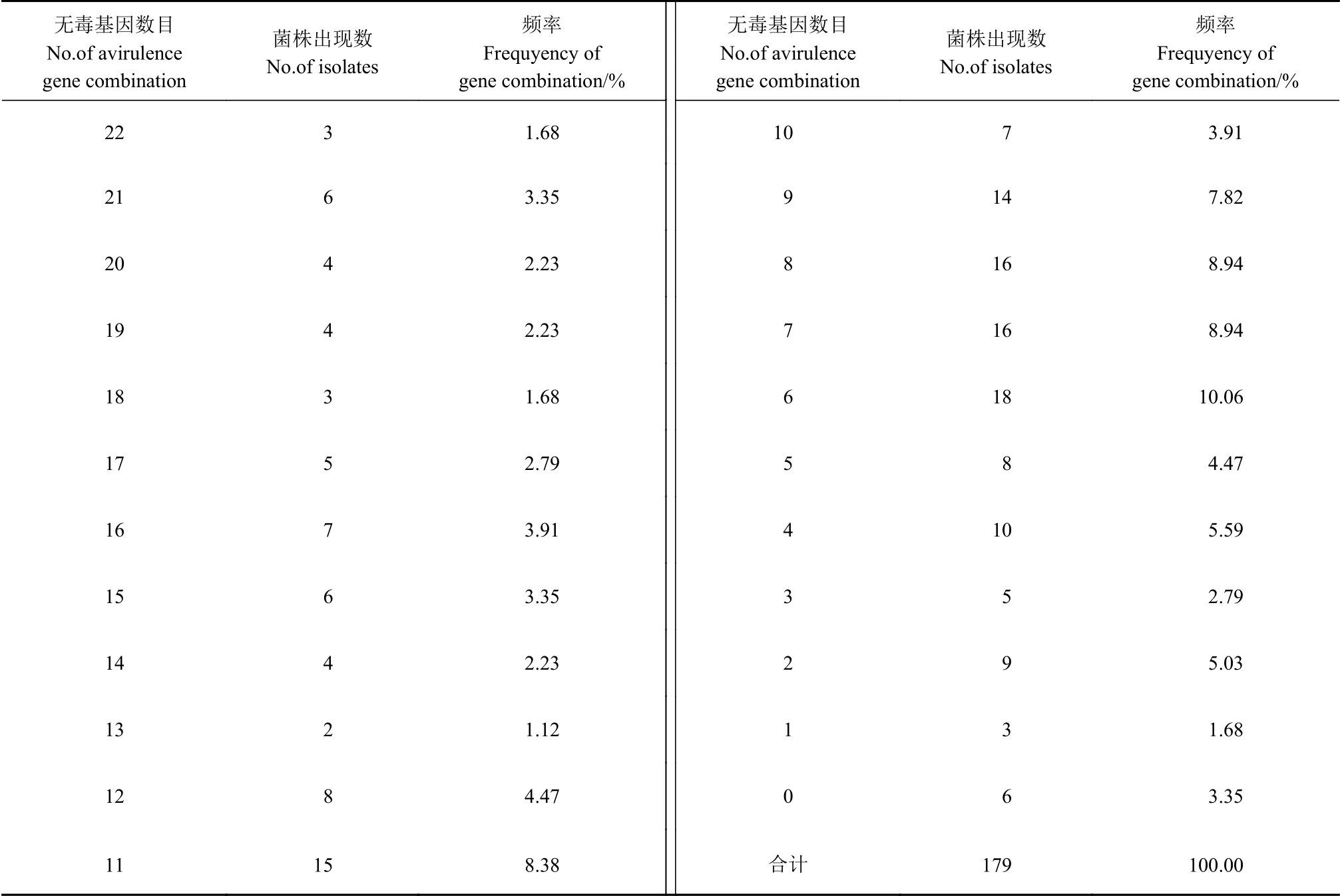
表4 2018—2020年福建省稻瘟病菌的不同数量无毒基因出现频率Table 4 Occurrence frequency of avirulent gene combinations of M. oryzae in Fujian, 2018-2020
2.5 稻瘟病菌无毒基因在福建省9个地区的分布
表5的结果显示,武夷山、松溪、邵武、浦城、光泽、建阳、宁化、将乐和上杭等9个地区都分布有24个无毒基因,无毒基因分布数量和出现频率较高为上杭(49.19%),光泽次之(48.18 %),武夷山最低(41.23%)。在各地区中出现频率达到90%以上的无毒基因有6个,分别为Avr-1、Avr-5、Avr-7、Avr-Z5和Avr-9、Avr-kh,其中Avr-1出现频率最高的地区为宁化(94.74%),Avr-5出现频率最高的地区为浦城(95.66%),Avr-Z5在武夷山、松溪、邵武、光泽、建阳和宁化等出现频率都达到了90%以上,Avr-7出现频率最高的地区为邵武(98.50%),Avr-9在武夷山、邵武和上杭的出现频率都达到了90%以 上,Avr-kh出现频率最高的地区为将乐(90.91%)。

表5 稻瘟病菌无毒基因在福建省9个地区的分布Table 5 Distribution of M. oryzae avirulent genes in 9 regions in Fujian
2.6 179个菌株的抗性鉴定数据聚类分析
利用IBM SPSS Statistics19软件聚类分析179个菌株对24个含单个抗病基因近等基因系的鉴定结果(图1)表明,欧式距离(Euclidean distance)越小,菌株的遗传距离越近,在欧式距离20遗传相似水平处,不同抗病基因对不同菌株的抗感差异可以把179个菌株划分为7个遗传谱系(遗传相似组)。在7个遗传谱系中,第Ⅰ谱系为优势谱系,含有124个菌株,占总数的69.27%;第Ⅱ谱系含有3个菌株;第Ⅲ谱系含有2个菌株,第Ⅳ谱系含有5个菌株,第Ⅴ谱系含有2个菌株,第Ⅵ谱系含有20个菌株,第Ⅶ谱系含有23个菌株。不同地区不同年份的菌株存在一定的遗传相似性,但是大多数的遗传相似程度并不与地区和年份的变化而呈现出很大的关联性,例如欧式距离为1的相似菌株为4组,图中由上至下依次为:第一组25号和75号菌株分别为2018年和2019年采集的光泽地区的稻瘟病菌单孢,第二组的57号和69号菌株分别为2018年采集的上杭地区的稻瘟病菌单孢和2018年松溪地区采集的稻瘟病菌单孢,第三组的2号和112号菌株分别为2018年采集的光泽地区的稻瘟病菌单孢和2019年建阳地区采集的稻瘟病菌单孢,第四组的84号和99号菌株都为2019年采集的将乐地区的稻瘟病菌单孢。从谱系的结果看稻瘟病菌的无毒基因在同一地区的种群丰富,在演变上随机性较强且演变速度较快。
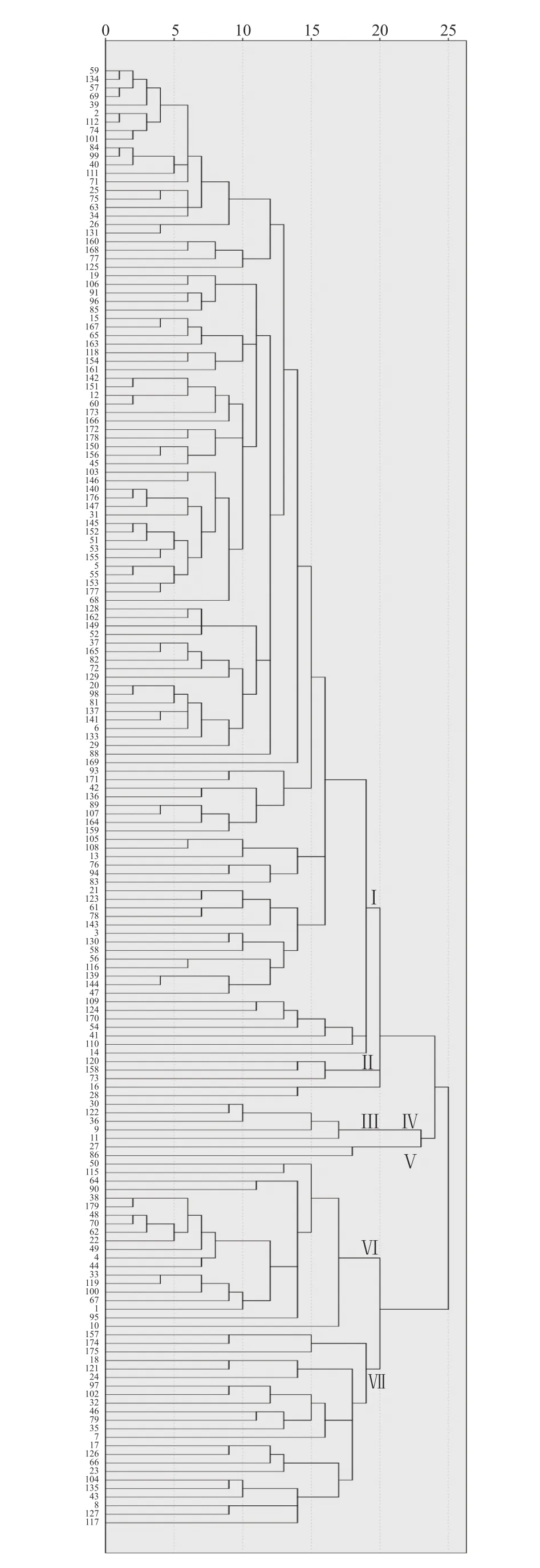
图1 179个稻瘟病菌菌株对24个NILs亲和反应型的聚类分析结果Fig. 1 Dendrogram on compatible response of 179 M. oryzae isolates to 24 NILs
3 讨论与结论
目前国内外学者对于无毒基因与寄主之间的作用原理提出了以下几点假说:Hammone-kosack K E等认为病原物侵染寄主时,无毒基因(Avr)编码蛋白会被寄主细胞内对应的抗病基因产物识别,信号分子将局部性侵染反应迅速传递到整个植株,从而激活被侵入点细胞发生过敏性反应(hypersensitive response,HR)即防卫抗性机制,最终导致寄主细胞程序性死亡(PCD),病原物也因失去寄生繁殖生长受到抑制[27]从而获得系统性抗性(systemic acquired resistance,SAR)。Mayank等[28]提 出 保 卫 假 说(guard hypothesis),该假说认为病原物的无毒基因的毒性因子Avr蛋白先与寄主体内相应的毒性靶向物接触,并结合一起形成感受信号复合体,从而启动防卫基因的表达激发植株产生抗性。Flor[9]提出“基因对基因”假说(gene-for-gene hypothesis),该假说认为病原的无毒基因编码特异的激发子,引起细胞程序性死亡即过敏性反应;本试验开展的理论基础就是基于基因对基因假说以及稻瘟病菌与寄主水稻之间的互作效应。
本试验于2018—2020年收集并分离福建省9个水稻主产区的中稻穗颈瘟单孢菌株179份,分别接菌鉴定24份含单个抗病基因的近等基因系。结果表明福建省较强致病力菌株占优势。抗病基因的抗性频率较高的有4个,其中Pi-z5和Pi-9(t)两个抗病基因的抗性频率最高,分别为91.49%和91.25%,Pi-kh和Pi-1两个抗病基因的抗性频率在80%-90%,Pi-7(t)、Pi-5(t)、Pi-k、Pi-12(t)等4个抗病基因的抗性频率在70%-80%,这些抗病基因在育种中可以重点采用。出现频率低于20%的3个无毒基因Avr-ks、Avr-b、Avr-ta应用中需注意观察,谨慎使用。杨秀娟等[21]利用41个已知抗病基因水稻品种测定2003-2006年从福建省主要稻区采集分离的87个稻瘟病单胞菌株的致病性,结果表明:病菌群体对水稻抗病基因Pi-d2、Pi-k(1)、Pi-km、Pi-kh、Pi-1(1)、Pi-z5(1)、Pi-z5(2)、Pi-1(2)的毒力频率均低于10%,提示这些抗病基因在福建省可作抗原使用;阮宏椿等[3]利用CO39近等基因系来鉴定2012-2015年间从福建省各稻区种植的普感品种丽江新团黑谷上采集的347株稻瘟病菌单孢菌株,结果表明:Pi-km、Pi-7(t)、Pi-9(t)、Pi-kp、Pi-k、Pi-kh、Pi-z5、Pi-ta等8个抗病基因的抗病性较强,抗谱均高于70%;本试验的鉴定结果与前人成果大致相同,主要区别为本研究结果中的抗病基因Pi-ta和Pi-km的抗性频率较前人研究结果下降幅度较大,应用时需谨慎,Pi-12(t)的抗性频率有所上升,可以考虑采用,这也同时说明随着福建省水稻主栽品种的布局变化,稻瘟病菌的无毒基因优势基因型也随之改变。因此,持续监测近年来的稻瘟病菌无毒基因型的组成和变化是抗病育种和抗病品种布局的关键依据。
Pi-z5和Pi-9(t)这两个抗病基因是本研究结果中对福建省的稻瘟病菌抗性频率最高的。Pi9基因定位于第6号染色体上,是一个广谱的稻瘟病抗病基因。Qu等[29]研究发现Pi9的cDNA全长为4 009 bp,包括一段3 099 bp的编码区和910 bp非编码区,Pi9编码一个羧基端含有富亮氨酸重复域(LRRs)的1 032个氨基酸组成的蛋白产物。在水稻中,Pi9基因是组成型表达,不受病原菌的诱导。Piz5基因也是定位在水稻第6号染色体上(又名Pi2),与Pi9基因复等位,也是一个广谱的稻瘟病抗病基因。其最先被定位在标记RG64和RZ612之间[30−31]。而后被精细定位在分子标记RG64和AP22之间[32],Zhou等采用与克隆Pi9基因相同的方法克隆了Piz5基因,证明Piz5基因也属于NBS-LRR类基因,与Pi9相同也含有2个内含子,其cDNA全长3332 bp,Piz5编码由1个核苷酸结合位点(NBS)和3个富亮氨酸重复区(LRR)组成的包含1032个氨基酸的蛋白产物[33−37]。
本研究菌株的采样方式为每年福建省中稻生产中稻瘟病发生地随机采样,不同于前人研究中的从单一的感病品种上采样,随机采样存在如遇某地某年稻瘟病不发生则缺少样本的情况,存在连续性不强的缺点,但是随机采样的样本更能反映生产中主栽品种上正在流行的菌株,笔者认为随机采样更具有代表性。另外,稻瘟病菌群体的聚类分析结果显示,同一地区的稻瘟病菌的菌群丰富且具有多样性,今后应扩大采样群体,加大分离稻瘟病菌单孢的数量,扩大群体进行研究以便得到更加完善的结论。

