赤芍桃仁颗粒微生物限度检查方法适用性试验研究
黄燕 戴余雯 周素琴 袁丽 徐丽波 李待军
1.兰州大学第二医院,甘肃 兰州730030;2.兰州大学药学院,甘肃 兰州730000;3.甘肃中医药大学附属医院,甘肃 兰州730000
赤芍桃仁颗粒是我院院内制剂,批准文号为甘药制字Z04000822,由赤芍、桃仁等6味中药组成,具有清热凉血、散风解表、活血通经、通窍止痛等功效,主要用于治疗扁平疣、传染性软疣、尖锐湿疣等病毒性皮疣及带状疱疹后神经痛、斑秃等,经多年临床应用,疗效显著[1-2]。方中赤芍、桃仁清热凉血,散瘀止痛;白芷消肿排脓,解表散寒,通鼻窍;川芎活血行气,祛风止痛。本文根据赤芍桃仁颗粒的给药途径和处方[3],对该制剂进行微生物限度检查方法适用性研究,希望建立可靠的赤芍桃仁颗粒的微生物限度检查方法,以期为质检部门提供微生物限度检查和质量控制的依据。
1 材料与仪器
1.1 供试品 赤芍桃仁颗粒共三个批号,1∶20181015、2∶20181110、3∶20181112,规格10g×10袋/盒。
1.2 培养基及试剂 0.9%无菌氯化钠溶液(C18072011-2),pH7.0氯化钠-蛋白胨缓冲液(20180315)、沙氏葡萄糖液体培养基(SDB,20181018)、胰酪大豆胨琼脂培养基(TSA,20180125)、肠道菌增菌液体培养基(20180818)、RV沙门增菌液体培养基(20180916)、沙氏葡萄糖琼脂培养基(SDA,2018 0115)、紫红胆盐葡萄糖琼脂培养基(20190308)、胰酪大豆胨液体培养基(TSB,20190124)、麦康凯液体培养基(Mac B,20190118)、麦康凯琼脂平板(Mac A,2010111)、木糖赖氨酸脱氧胆酸盐琼脂培养基(20190129),培养基购自青岛海博科技生物公司。
1.3 菌种 白色念珠菌[CMCC(F)98001]、乙型副伤寒沙门菌[CMCC(B)50094]、大肠埃希菌[CMCC(B)44102]、黑曲霉菌[CMCC(F)98003]、枯草芽孢杆菌[CMCC(B)63501]、铜绿假单胞菌[CMCC(B)44104]、金黄色葡萄球菌[CMCC(B)26003],以上菌种购自中国食品药品检验研究院。
1.4 仪器 XSZ205型电子天平(梅特勒)、BSC-1304II A2型生物安全柜(苏州安泰)、SPX-80B型生化培养箱(上海跃进)、AE2000型显微镜(麦克奥迪)、YX280A型压力消毒器(上海三申)。
2 微生物计数方法适用性试验
2.1 菌液制备 选pH7.0无菌氯化钠-蛋白胨缓冲液将金黄色葡萄球菌、铜绿假单胞菌、大肠埃希菌、乙型副伤寒沙门菌、枯草芽孢杆菌分别制成浓度为104、103、102cfu/mL的菌悬液;选0.9%无菌氯化钠溶液将白色念珠菌、黑曲霉菌制成浓度为104、103、102cfu/mL的菌悬液。菌种为第3代,菌悬液为第4代[4-5]。
2.2 菌悬液数量[3]取“2.1”项下各菌悬液1mL,置无菌平皿中,分别加TSA、SDB,平行制备2组,混匀,凝固,倒置培养。测定菌数。
2.3 供试液的制备 取赤芍桃仁颗粒10g,加pH7.0无菌氯化钠-蛋白胨缓冲液100mL,溶解,混匀,制成1∶10供试液。
2.4 回收比值

判断方法:结果在0.5~2.0范围内,表明该计数方法适用性通过[6-7]。
2.5 计数方法适用性试验[8-9]。
2.5.1 试验组。平皿法:分别取1∶10供试液10mL,加入已灭菌的7个三角瓶中,分别加入0.1mL“2.1”项下的金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌、黑曲霉菌菌悬液,制成每mL供试液含菌数小于100cfu,摇匀,取样1mL,置无菌平皿中,平行制备2组,加TSA,混匀,凝固,倒置培养,测定菌数。取含白色念珠菌、黑曲霉菌样品溶液各2mL,置无菌平皿中,加SDA,混匀,凝固,倒置培养,测定菌数。
培养基稀释法:取“2.3”项下供试液10mL 3份,分别加0.1mL“2.1”项下白色念珠菌、金黄色葡萄球菌、枯草芽孢杆菌菌悬液,制成每mL供试液含菌数小于100cfu,摇匀,取样0.2、0.5mL,置无菌平皿中,平行制备2组,分别加TSA、SDA,混匀,凝固,倒置培养,测定菌数。
供试液稀释法:取“2.3”项下供试液10mL加入无菌氯化钠-蛋白胨缓冲液,制成1∶100供试液,取10mL,加入白色念珠菌0.1mL菌悬液(103cfu/mL),制成每mL含菌数小于100cfu,取1mL,置无菌平皿中,平行制备2组,加SDA,混匀,凝固,倒置培养,测定菌数。
2.5.2 菌液对照组。取“2.1”项下的菌悬液(104cfu/mL)进行100级稀释,取1mL注皿,金黄色葡萄球菌、枯草芽孢杆菌、铜绿假单胞菌加TSA,白色念珠菌、黑曲霉菌加SDA,混匀,凝固,倒置培养,测定菌数。
2.5.3 供试品对照组。取赤芍桃仁颗粒1∶10、1∶100供试液按表1取样注皿,其他操作同试验组,测定菌数。
2.5.4 阴性对照组。用同批配制、灭菌的TSB1mL替代样品溶液注皿,其他操作同试验组,测定阴性对照菌数。
2.5.5 不同计数法比较[10]。采用1∶10供试液平皿法,铜绿假单胞菌、黑曲霉回收比值高于0.5,白色念珠菌、枯草芽孢杆菌、金黄色葡萄球菌回收比值低于0.5,证明该方法不可行。采用1∶10供试液培养基稀释法0.2mL注皿,对应试验菌回收比值高于0.5,证明该方法可消除赤芍桃仁颗粒对需氧菌的抑菌作用。采用供试液稀释法(1∶100,1mL/皿),白色念珠菌、黑曲霉菌回收比值高于0.5,表明该方法可消除赤芍桃仁颗粒对霉菌和酵母菌的抑菌作用。结果见表1。

表1 不同计数法适用性试验结果(n=2)
2.6 控制菌检查[11,12]
2.6.1 大肠埃希菌。取4份100mL TSB,1瓶加大肠埃希菌菌悬液1mL(102cfu/mL)和“2.3”项下供试液10mL,作为试验组;2瓶加“2.3”项下供试液10mL,作为供试品组;3瓶加大肠埃希菌菌悬液1mL(102cfu/mL),作为阳性对照组;4瓶以pH7.0无菌氯化钠-蛋白胨缓冲液替代供试液,作为阴性对照组。上述4组,35℃培养24h。取各培养物1mL,接种至100mLMac B中,44℃培养48h。取麦康凯液体培养物划线接种于MacA平板上,35℃培养72h。
2.6.2 耐胆盐革兰氏阴性菌。取赤芍桃仁颗粒10g,加100mL TSB,制成1∶10供试液,混匀,25℃培养2h(不增值)。取上述培养物2份各10mL,接种至肠道菌增菌液体培养基,1瓶加大肠埃希菌菌悬液1mL(102cfu/mL),2瓶加铜绿假单胞菌菌悬液1mL(102cfu/mL),均为试验组;3瓶加“2.3”项下供试液10mL和100mL TSB,作为供试品对照组;4瓶、5瓶分别加入大肠埃希菌菌悬液(102cfu/mL)、铜绿假单胞菌菌悬液(102cfu/mL)1mL,分别加入100mL TSB中,作为阳性对照组;6瓶以pH7.0无菌氯化钠-蛋白胨缓冲液替代供试液,作为阴性对照组。将上述35℃培养48h,接种于紫红胆盐葡萄糖琼脂培养基上,35℃培养24h。
2.6.3 沙门菌。取2份赤芍桃仁颗粒10g,分别加100mL TSB,制成赤芍桃仁颗粒1∶10供试液,其中1瓶加沙门菌菌悬液1mL(102cfu/mL)作为试验组;2瓶作为供试品组。3瓶只加沙门菌菌悬液1mL(102cfu/mL),作为阳性对照组;4瓶以pH7.0无菌氯化钠-蛋白胨缓冲液替代供试液,作为阴性对照组。上述4组,35℃培养24h,取0.1mL培养液接种于10mL RV沙门菌增菌液体培养基中,35℃培养24h,划线接种于木糖赖氨酸脱氧胆酸盐琼脂培养基平板上,35℃培养48h,观察菌落形态。
3 结果
3.1 计数方法 三批赤芍桃仁颗粒,需氧菌总数、霉菌和酵母菌总数计数分别按培养基稀释法和供试液稀释法进行验证回收试验。见表2。

表2 赤芍桃仁颗粒验证回收比值
采用培养基稀释法(1∶10,0.2mL/皿)和供试液稀释法(1∶100,1mL/皿)测定需氧菌总数、霉菌和酵母菌总数,各试验菌回收比值均在0.5~2.0范围内,表明该微生物计数方法适用性验证试验结果确认。
3.2 大肠埃希菌 三批赤芍桃仁颗粒,阳性对照组均有菌落生长,经镜检,确定该菌为大肠埃希菌,而阴性和供试品对照组无菌落生长,说明该方法可用于控制大肠埃希菌。见表3。
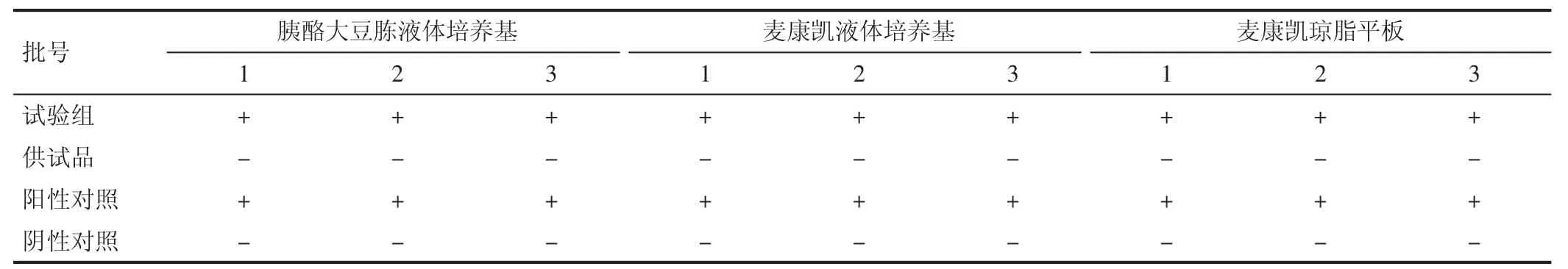
表3 大肠埃希菌验证试验结果
3.3 耐胆盐革兰氏阴性菌 三批赤芍桃仁颗粒,阳性对照组均有菌落生长,经鉴定,该菌为所加阳性菌,而阴性和供试品对照组未见菌落生长,说明该方法对大肠埃希菌和铜绿假单胞菌的选择性良好,可用于控制耐胆盐革兰氏阴性菌。见表4。

表4 耐胆盐革兰氏阴性菌验证试验结果
3.4 沙门菌 三批赤芍桃仁颗粒,试验组有菌落生长,镜检确认为该阳性菌,而阴性和供试品对照组未见菌落生长,说明该方法可用于沙门菌的检验。见表5。

表5 沙门菌验证试验结果
4 讨论
医院自制制剂因其生产工艺、设备相对简单,且当制剂中含有抑菌成分药材时,检测的结果常常会出现异常现象,因此进行微生物限度检查方法适用性验证至关重要。赤芍桃仁颗粒为含有药材原粉的中药复方制剂,成分复杂,若要保证检查方法的有效性和准确性,必须验证其微生物限度方法的适宜性。处方中赤芍、白芷、川芎等均具有抑菌作用。有文献报道[13],赤芍的不同提取物具有明显的抑菌活性,且可与抗生素产生协同作用。白芷不仅对白色念珠菌具有明显的抑制作用,而且对白色念珠菌毒力因子CPH1、EFG1表达过程产生抑制作用,有文献资料报道,白芷对白色念珠菌、金黄色葡萄球菌和大肠杆菌的抗菌活性显著[14-15]。川芎取物在浓度为1g/mL时对受试病原细菌大肠杆菌、沙门氏菌、青枯菌、白色葡萄球菌、金黄色葡萄球菌、肺炎双链菌均表现较强的抑制活性,其中以沙门氏菌对提取物最敏感,其次是青枯菌、金黄色葡萄球菌、大肠杆菌和肺炎双链菌对提取物的敏感性相对较弱[16]。
在预实验中,赤芍桃仁颗粒首先采用1∶10稀释并吸取1mL、0.5mL分别计数,但试验结果回收比值均不在规定范围。本文改善了样品处理方法,供试液稀释法和培养基稀释法很好的消除了赤芍桃仁颗粒处方组分中的抗菌活性。
综上所述,赤芍桃仁颗粒的微生物限度检查方法适用性实验合格,符合2020年版《中国药典》四部的要求[17],可以为赤芍桃仁颗粒更好的控制质量提供有力依据。

