梅花鹿CDKN2C基因cDNA的克隆及生物信息学分析
李金跃,刘嫣然,赵晨曦,于梦佳,刘泳彤,黄雨馨,夏彦玲
(东北林业大学 野生动物与自然保护地学院,哈尔滨 150040)
CDKN2C基因又被称INK4C基因或P18基因[1],属于INK4家族,INK4家族共包括4个成员,按分子质量大小及发现顺序依次命名为P16INK4A、P15INK4B、P18INK4C和 P19INK4D[2]。由 于INK4家族各成员的功能单位均由4~5个锚蛋白重复序列构成,具有共同的生物学特性,即都可以通过与CDK4/6结合,使cyclinD-CDK4/6复合物激酶的活性被抑制,从而起到控制细胞周期G1进程的作用[3]。以磷酸化和去磷酸化为基础的细胞内源性调控就是在cyclin-CDK -CKI途径中实现的,在cyclin-CDK-CKI途径中,cyclin和CKI可对CDK进行正调控或反调控,在这种调控机制正常时保持动态平衡的状态,若这种动态平衡的正负调控机制一旦不再平衡,细胞就可能会有增殖异常的情况出现[4]。CDKN2C在正常细胞周期中发挥抑癌基因的作用,特异性抑制Cyclins和CDKs的磷酸化活性,从而通过一系列途径来抑制细胞癌变,有CDKN2C基因敲除的相关试验研究表明,该基因在抑制肿瘤发生中起到重要作用[5]。
鹿茸的生长发育速度十分迅速,其顶部组织最快生长时期的分裂速度远超恶性肿瘤细胞,但在快速生长期仍然能保持有序的组织结构而不发生癌变,这种生物学现象是当今研究的热门。其分子机制尚不明确,因此在生物学领域的科学家们致力于研究鹿茸的生长发育机制,并且找寻其与细胞癌变机制的关联,试图由此解决癌症的相关问题。细胞周期阻滞可以保护损伤细胞,它有利于损伤后DNA的修复,从而减少损伤导致的致死性和致畸性。CDKN2C基因可以调控细胞周期的进行,这与肿瘤细胞的增殖等具有密切的联系。本试验以鹿茸组织cDNA 为模板,对鹿茸的CDKN2C基因进行克隆、转化、测序及蛋白质结构和功能预测,以期为今后鹿茸生长发育机制及CDKN2C基因在鹿茸生长发育中所发挥的重要功能研究提供理论依据和技术支持。
1 材料与方法
1.1 样品来源
健康成年二杠型东北梅花鹿鹿茸,来自内蒙古根河林业局,采样时间为2020年2月份,由东北林业大学野生动物与自然保护地学院实验室保存。在无菌环境下迅速采集鹿茸约5 cm的顶端组织为试验样品,迅速对其表面进行消毒,垂直鹿茸生长轴方向切断,置于液氮中保存,以备后续使用。
1.2 主要仪器
见表1。

表1 主要仪器
1.3 主要试剂的配制
50×TAE:称取Tris-Base 242 g置于烧杯中,加入冰乙酸57.1 mL、0.5 mol/L EDTA(pH值8.0)100 mL,加入去离子水定容至1 000 mL,于4℃条件下保存。
氨苄青霉素(100 mg/mL):用超纯水将氨苄青霉素配制成100 mg/mL存储液,使用0.22μm滤器过滤除菌,分装成每管1 mL体积,于-20℃条件下保存。
卡那霉素(50 mg/mL):用超纯水将卡那霉素配制成50 mg/mL存储液,使用0.22μm滤器过滤除菌,分装成每管1 mL体积,于-20℃条件下保存。
X-gal:将粉状X-gal溶解到二甲基酰胺溶液(DMF)中,制成20 mg/mL溶液,分装成每管100μL体积,每管外包有铝箔纸保持遮光,于-20℃条件下保存。
IPTG:称取2.0 g粉状IPTG,用无菌去离子水将其定容至10 mL,使用0.22μm滤器过滤除菌,分装成每管50μL体积,于-20℃条件下保存。
10 mmol/L NaOH:称取4.0 g粉状NaOH,用无菌去离子将其定容至10 mL,于4℃条件下保存。
LB液体培养基:称取胰蛋白胨2.0 g,酵母浸粉1.0 g,NaCl 2.0 g,用去离子水将其定容至100 mL,用10 mmol/L NaOH调节pH值至7.4~7.6之间,进行高压灭菌,于4℃条件下保存。
LB固体培养基:先配置100 mL LB液体培养基,再加入1.5 mg琼脂粉,进行高温灭菌,待灭菌后取出,轻轻摇匀,温度适宜时向培养基中相继加入IPTG 20μL、X-gal100μL、氨苄青霉素100μL(卡那霉素50μL),充分混匀后铺板于培养皿中然后封口,于4℃条件下保存。
1.4 RNA的提取和cDNA的合成
采用TRIzol法提取鹿茸组织中的总RNA,提取完成后,利用1%琼脂糖凝胶电泳和紫外分光光度计检测RNA的完整性和质量。以RNA为模板、Oligo-dT为引物,在反转录酶M-MLVⅢ的催化下反转录合成cDNA,反应结束后将cDNA置于-20℃冰箱中保存,备用。
1.5 梅花鹿CDKN2C基因引物的设计与合成
参照GenBank牛、羊的CDKN2C基因序列,运用Primer Premier 5.0软件设计同源引物,扩增片段包含该基因的CDS区,预期扩增片段大小为536 bp,引物序列为上游引物5′-CAGGACCCTAAAGAATGGC -3′,下游引物5′-GAGCCCTCCCCACATTC-3′。
1.6 梅花鹿CDKN2C基因cDNA的克隆
以1.5中合成的cDNA为模板,通过PCR技术获得CDKN2C 基因cDNA 序列。反应体系(25.0μL):10×PCR Buffer 2.5 μL,dNTPs 1.0μL,上下游引物各1.0μL,rTaq DNA聚合酶0.2μL,ddH2O 17.3μL,cDNA 2.0μL。具体反应条件:95℃预变性5 min,变性95℃30 s,退火57.0℃30 s,延伸72℃30 s,共35个循环,之后再72℃延伸10 min。用移液枪取6μL PCR产物,用1.0%琼脂糖凝胶电泳检测目的条带。再利用胶回收试剂盒(购自宝日医生物技术有限公司)回收PCR产物。将目的基因片段与pMD18-T载体连接并转化至大肠杆菌DH5α感受态细胞中,涂布LB固体培养基,利用蓝白斑筛选和PCR鉴定挑选阳性克隆菌落,送至库美生物科技有限公司进行测序。
1.7 梅花鹿CDKN2C基因的生物信息学分析
通过ORF Finder预测并分析梅花鹿CDKN2C基因序列的开放阅读框,应用NCBI中的BLAST程序对得到的CDKN2C基因编码序列进行同源性比对分析,并根据序列比对结果,运用MEGA X软件采取邻接法构建系统进化树,利用ProtParam、ProtScale、PSORTⅡPrediction以及SignalP 3.0 Server在线分析软件对CDKN2C蛋白的一级序列进行分析,运用NCBI中的CD-Search在线分析工具预测CDKN2C蛋白上的保守结构域,用GOR4和SWISS-MODEL在线软件分别对该蛋白的二级结构和三级结构进行预测分析,用CBS网站上的NetPhos 3.1 Server在线分析软件、NetOGlyc 4.0 Server在线分析软件以及NetNGlyc 1.0 Server在线分析软件预测CDKN2C蛋白的磷酸化位点、O-糖基化位点以及N-糖基化位点。
2 结果与分析
2.1 梅花鹿CDKN2C基因的克隆
以梅花鹿鹿茸组织cDNA为模板,进行PCR扩增。结果扩增出一条536 bp的特异性带,与预期片段大小相符,初步认定为CDKN2C基因的cDNA序列,见图1。
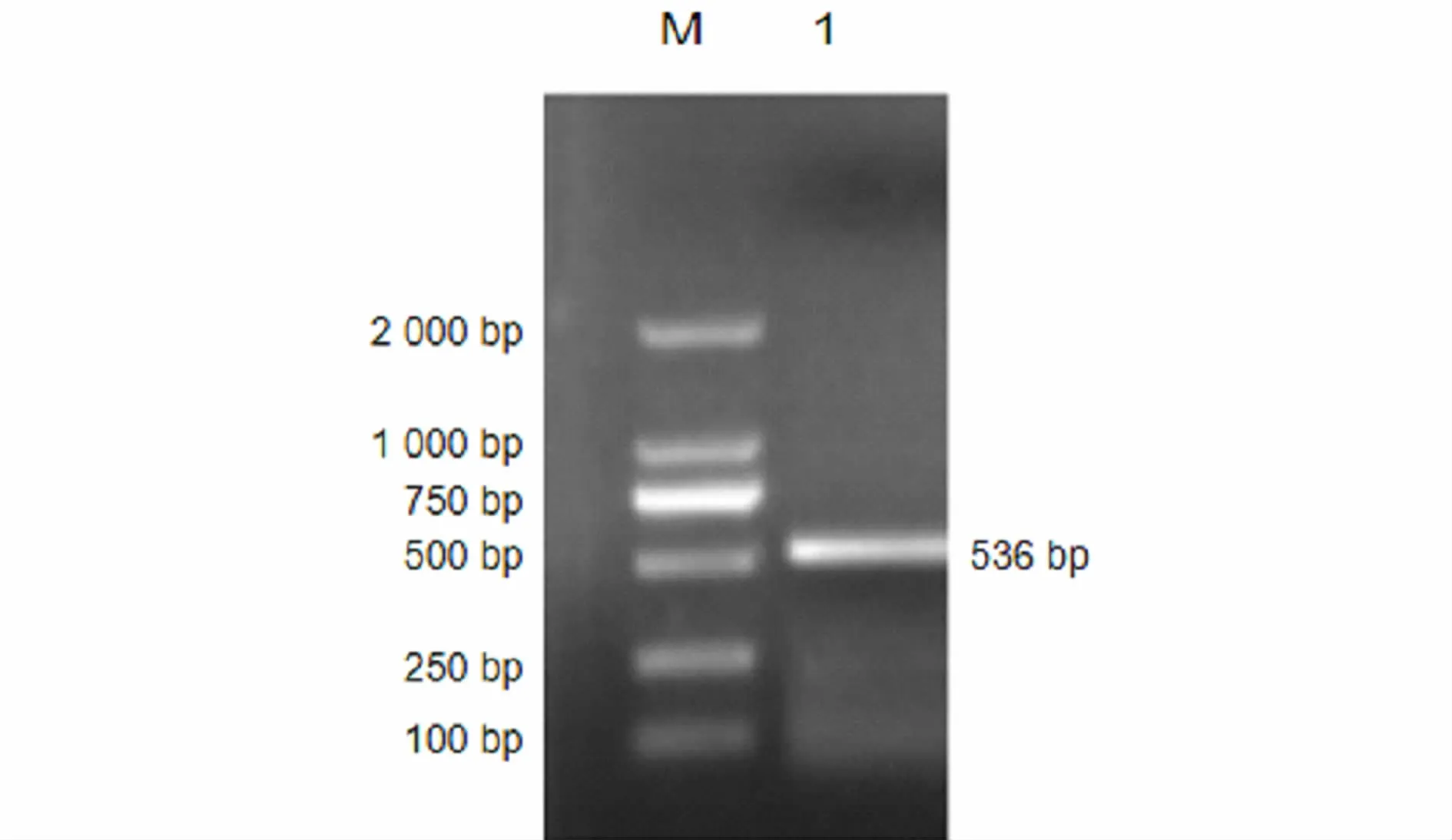
图1 梅花鹿CDKN2C基因的PCR扩增结果
2.2 梅花鹿CDKN2C基因的序列分析
将测序结果进行BLAST分析,确认为是梅花鹿CDKN2C基因后,通过ORF Finder序列分析工具进行分析,得出该基因的CDS区全长507 bp,编码168个氨基酸,具体的编码序列及对应氨基酸序列见图2。
2.3 梅花鹿CDKN2C基因编码序列进化树的构建
运用MEGA X软件构建的梅花鹿CDKN2C基因编码序列系统进化树见图3。梅花鹿与牛最先汇为一支,其与大羚羊、野骆驼、牛以及马的亲缘关系较近,与智人和长臂猿的亲缘关系较远。

图3 梅花鹿CDKN2C基因编码序列系统进化树
2.4 梅花鹿CDKN2C蛋白质的特性
2.4.1 蛋白质一级序列 ProtParam在线分析软件分析结果显示,该CDKN2C蛋白含168个氨基酸残基,亮氨酸和丙氨酸含量较高。通过ExPASy服务器ProtScale模块的Kyte&Doolittle算法在线分析软件对梅花鹿CDKN2C蛋白进行分析,结果见图4,显示梅花鹿CDKN2C蛋白为亲水蛋白。采用PSORTⅡPrediction程序分析其亚细胞定位,结果表明,梅花鹿CDKN2C蛋白89%位于细胞质,11%位于细胞核。用SignalP 3.0 Server在线分析软件预测梅花鹿CDKN2C蛋白的信号肽,结果见图5,显示SNRPB不具备信号肽。
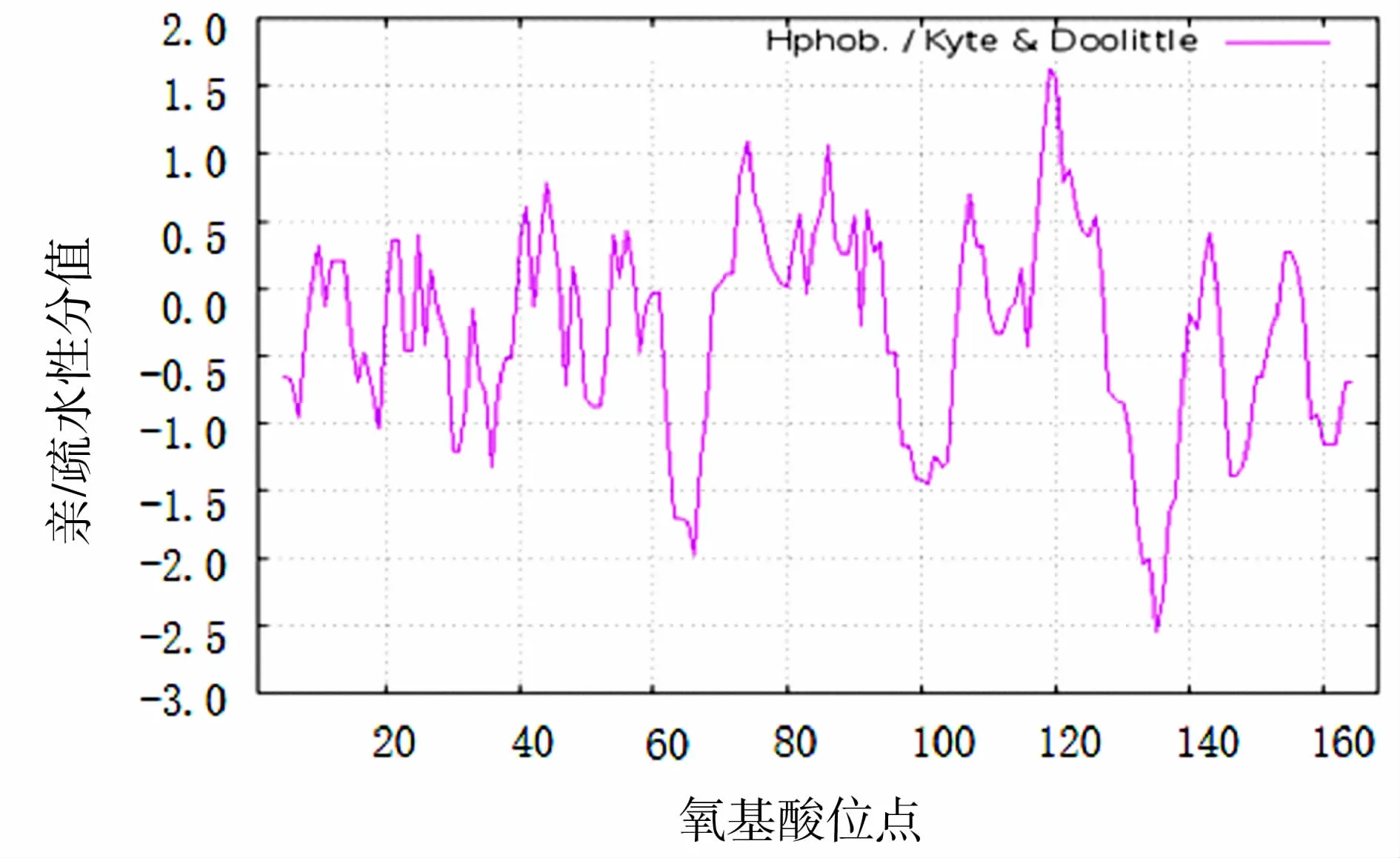
图4 梅花鹿CDKN2C蛋白亲/疏水性分析
图5 梅花鹿CDKN2C蛋白的信号肽预测
2.4.2 结构域预测 用CD-Search在线分析工具对梅花鹿CDKN2C蛋白的结构域进行预测,结果见图6,发现第46~127位氨基酸残基之间存在Ank_2结构域,此结构域包括多个β(2)-α(2)基序重复序列。

图6 梅花鹿CDKN2C蛋白的保守结构域预测
2.4.3 二级结构与三级结构预测 用GOR4在线软件对梅花鹿CDKN2C基因编码的蛋白质二级结构进行预测,结果表明,该蛋白α-螺旋占47.62%,延伸链占12.50%,自由卷曲占39.88%,见图7。用SWISS-MODLE在线软件分别模拟梅花鹿、牛和人的CDKN2C蛋白高级结构,结果得出三者结构较为相似,但其中梅花鹿的CDKN2C蛋白结构与牛更为相似,见图8。
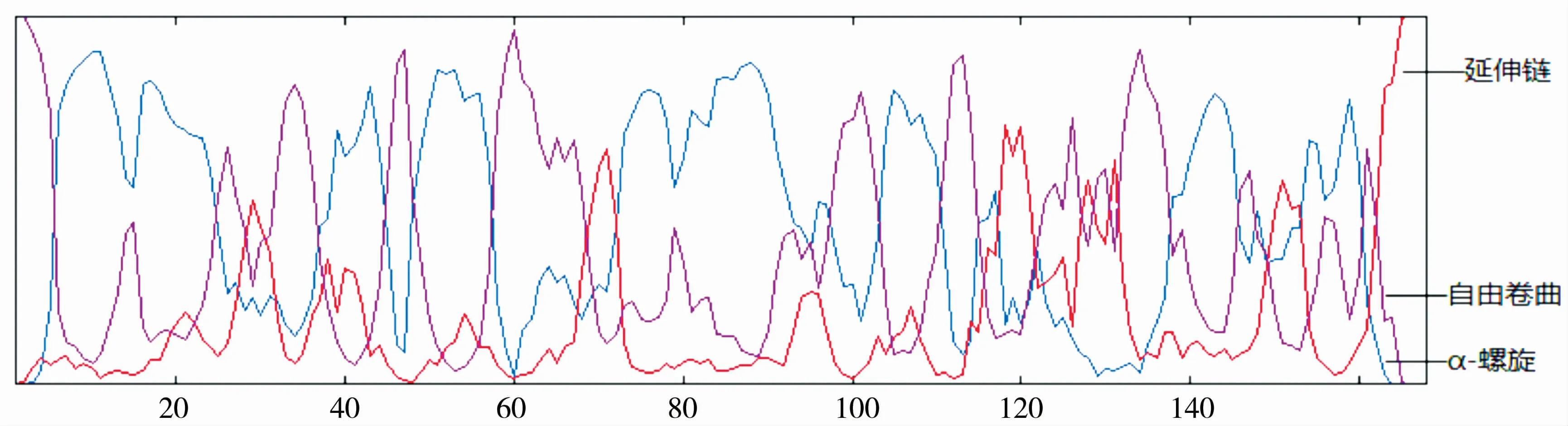
图7 CDKN2C基因编码的蛋白质二级结构
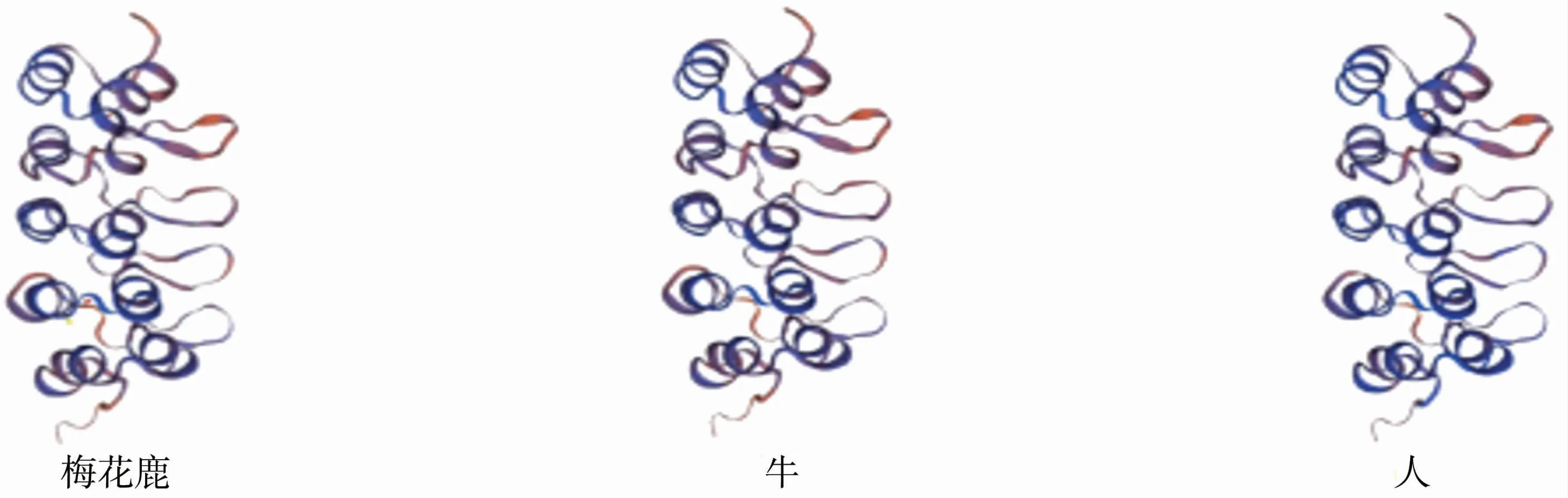
图8 梅花鹿、牛、人CDKN2C蛋白三级结构比较
2.4.4 蛋白翻译后位点修饰的预测 利用Net-Phos 3.1 Server、NetOGlyc 4.0 Server和NetNGlyc 1.0 Server等在线分析软件对梅花鹿CDKN2C蛋白翻译后磷酸化位点、O-糖基化位点和N-糖基化位点修饰进行预测,结果见图9,表明梅花鹿CDKN2C蛋白含有2个丝氨酸和3个苏氨酸磷酸化位点,分别位于氨基酸序列的第23,154位和第88,126,139位,没有发现N-糖基化位点以及O-糖基化位点。
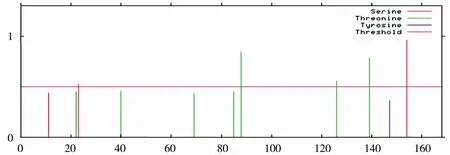
图9 梅花鹿CDKN2C蛋白的磷酸化位点预测
3 讨论
鹿茸角是鹿科动物的第二性征(驯鹿除外),其在快速生长期仍然能保持有序的组织结构而不发生癌变[6],所以科学家们一直致力于探寻鹿茸生长机制并希望寻找到其与细胞癌变机制的相似点,为癌症的治疗提供新的思路。有研究表明CDKN2C基因敲除与癌症患者总体生存期下降有关[7]。CDKN2C是一种重要的细胞周期调节剂和细胞周期蛋白依赖性激酶抑制剂[8],这可能与鹿科动物茸角的快速生长机制相关。国内外对CDKN2C基因的研究少见报道,因此,研究鹿茸顶端组织的CDKN2C基因及其编码蛋白可为癌症治疗提供新的思路。
本试验利用PCR技术成功扩增了梅花鹿的CDKN2C基因,获得的CDKN2C基因CDS区全长507 bp,编码168个氨基酸,无信号肽。将梅花鹿鹿茸组织的CDKN2C基因的CDS序列与智人、长臂猿、土豚、家猫、马、野骆驼、大羚羊、牛以及抹香鲸等几个物种的序列进行分析并构建系统进化树,结果发现其与牛的亲缘关系最近,这与进化规律相符。应用PSTORⅡ程序预测结果表明,89%分布在细胞质,11%在细胞核,说明CDKN2C蛋白可能在细胞质内对鹿茸细胞的生长发育进行调控。SignlP程序预测该蛋白无信号肽,为非分泌性蛋白。预测该蛋白二级结构发现,其α-螺旋占47.62%,延伸链占12.50%,自由卷曲占39.88%,预测该蛋白二级结构发现梅花鹿的CDKN2C蛋白结构与牛相似,这与系统进化树的构建结果相呼应,符合进化规律。
使用NCBI中Conserved Domain Search程序分析该蛋白结构域,结果表明,第46~127位氨基酸为ANK-2结构域。ANK结构域是自然界最常见的蛋白质-蛋白质相互作用模式之一,来源于真核生物,存在于许多功能多样的蛋白质中。张富军[9]在文章中就曾表明ANK重复序列是最常见的保守蛋白结构域之一。在许多功能蛋白中,ANK结构域可以充当蛋白质相互作用的支架,并在多种细胞学和生物学过程中发挥关键作用,例如细胞间信号转导、细胞骨架完整性、转录和细胞周期调控、炎症反应等。而且ANK结构域包括多个β(2)-α(2)基序重复序列,该结构域的这种重复主要出现在具有多种功能的蛋白质中,如转录启动子、细胞周期调节因子等[10],说明CDKN2C基因可能具有细胞周期调节作用,这与肾癌相关研究结论一致[11]。
梅花鹿的CDKN2C蛋白翻译后位点修饰的预测分析显示,其氨基酸序列上有含有2个丝氨酸和3个苏氨酸磷酸化位点。蛋白质磷酸化是生物界最普遍、最重要的翻译后修饰之一,几乎参与细胞所有的生命活动,尤其是基因表达调控和信号传导[12],磷酸化还对蛋白翻译和细胞增殖等方面有推动作用[13],可能与信号传导、细胞周期、生长发育以及癌症机制等有关。梁积峰等[14]的研究表明,当癌细胞磷酸化水平显著增加之后,癌细胞活力显著降低,癌细胞凋亡显著增加。由此可见,CDKN2C基因可能在抑癌方面发挥重要作用。本试验成功克隆了梅花鹿CDKN2C基因序列,并对其表达的蛋白质理化性质及结构进行预测,以期为今后鹿茸的生长发育机制的研究,并为CDKN2C基因在鹿茸生长发育中所扮演的角色功能研究提供理论依据和技术支持。

