犊牛睾丸支持细胞稳定转染pEGFP-N3的研究
秦 雪,李 琦,冯 瑞,赵 骞,郑 鹏
(东北农业大学 动物科学技术学院,哈尔滨 150030)
支持细胞(sertoli cell)是睾丸曲细精管内唯一的体细胞,在生精过程中具有提供物理和代谢支持、稳定微环境、释放和分泌激素和营养物质等多种功能[1-5]。为了研究睾丸支持细胞在特定条件下的反应和功能,分离提纯支持细胞并获得稳定转染表达绿色荧光蛋白的支持细胞系是目前研究的重点。增强型绿色荧光蛋白(enhanced green fluorescent protein-N3 plasmid,pEGFP-N3)是一种用于检测细胞基因表达和蛋白定位的一种小分子蛋白,荧光强度高、不需反应底物和辅助蛋白质的修饰即可产生荧光,且对宿主细胞毒副作用小,转化后细胞可连续传代,对受体的生长发育及功能等均无明显影响[6-7];蛋白序列也已经明确可以在活细胞和生物体中对目的基因实时示踪和筛选[8-9],在研究特定蛋白的定位、转运及其与宿主间的相互作用等方面均起着重要作用[10]。
试验分离纯化犊牛睾丸支持细胞,利用Lipofectamine2000转染和G418筛选,希望得到稳定整合pEGFP-N3的支持细胞,为进一步研究血睾屏障的形成和支持细胞的生理功能奠定基础。
1 材料与方法
1.1 样品来源和主要试剂
犊牛睾丸来源于双城血清厂。犊牛屠宰放血后,立即无菌操作,割取睾丸,置于4℃生理盐水中,3 h内运回实验室。
0.1%胶原酶,Sigma公司产品;0.25%胰酶,Amresco公司产品;基础培养液:DMEM +10% 胎牛血清(FBS)+1% 双抗;DMEM、FBS,Gibco公司产品;双抗(每毫升含10 000 U青霉素和10 mg链霉素),Biosharp公司产品;兔抗Vimentin多克隆抗体、FITC标记的羊抗兔IgG,Proteintech公司产品;Lipofectamine 2000、G418,Invitrogen公司产品;pEGFP-N3质粒,东北农业大学家畜繁殖实验室保存。
1.2 犊牛睾丸支持细胞的分离纯化
将收集的睾丸置于磷酸盐缓冲液(PBS)中洗涤,取睾丸实质组织移入盛有PBS的玻璃皿中拨散,清洗,尽量去除血细胞和间质细胞;将获得的曲精细管移入离心管中,加入10倍体积的胶原酶消化液,室温消化3~5 min,期间轻轻吹打2~3次,至曲细精管彼此分散开为止,加入5~10 mL PBS,轻轻吹匀后于600 r/min离心2~3 min,去除上清 液,重 复 上 述 消 化 5 ~10 min;然 后1 000 r/min离心5 min,去除上清液,获得纯净的曲细精管;加入10倍体积的胰酶消化液,室温消化3~5 min,期间轻轻吹打2~3次,待悬液中看不到微小的曲细精管片段时加入等量的基础培养液终止消化;用100μm和74μm筛网分别过滤,将过滤后的细胞悬液以1 000 r/min离心5 min,去除上清液,将细胞沉淀重新以基础培养液悬起,获得含有生精细胞和支持细胞两种细胞的生精上皮细胞悬液。
将生精上皮细胞悬液调整密度为(1~5)×106个/mL,接种到培养瓶中培养,4~6 h后支持细胞已大部分贴壁,用吸管轻轻吹打,悬起尚未紧密贴壁的生精细胞和部分支持细胞,弃掉培养液,添加新鲜培养液继续培养过夜,待细胞生长至90%融合时,用PBS清洗2次,用胰酶消化细胞后重新接种培养。
1.3 免疫荧光染色
待细胞生长至90%融合时,用4%多聚甲醛固定15 min,用含0.1%牛血清白蛋白(BSA)的PBS清洗2次,每次5 min,滴加5% BSA封闭液室温封闭40 min,弃掉封闭液,加1∶500倍稀释(含1%BSA的PBS溶液)的兔抗Vimentin多克隆抗体,4℃孵育过夜,使用正常的IgG作为阴性对照。用含0.1% BSA 的PBS溶液清洗2次,每次5 min,加入1∶100稀释(含1% BSA的PBS溶液)的FITC标记的羊抗兔IgG,室温避光孵育1 h,再用含0.1% BSA的PBS溶液清洗2次,每次5 min,然后用DAPI复染5 min。PBS清洗3次后,在荧光显微镜下观察和照相。
1.4 转染pEGFP-N3载体
转染前24 h将细胞种植在6孔板中。待细胞生长至90%融合时,用无血清的DMEM冲洗细胞,再加入无血清的DMEM 2 mL。取Lipofectamine 2000 3μL和pEGFP-N3重组质粒(使用Omega公司的无内毒素质粒小提试剂盒提取后使用)1μg,分别加入100μL无血清的DMEM 混合均匀,室温孵育5 min;轻轻混合上述两种混合物,室温孵育20 min;均匀吸取混合物缓慢加入6孔板中,37℃、5% CO2孵育细胞6 h,再换成正常培养液;细胞转染48 h后,于倒置荧光显微镜下观察绿色荧光蛋白基因的表达情况;小心将细胞消化下来,以1∶5的比例稀释,接种到6孔板中过夜培养;第2天待细胞贴壁表达蛋白后,以确定好的筛选浓度加入500μg/mL G418,轻柔混匀,每天观察细胞状态,根据细胞状态更换培养基。1周后未转染的细胞大量死亡,更换维持浓度200μg/mL的G418培养基进行培养。
2 结果
2.1 犊牛睾丸支持细胞的分离纯化与鉴定
采用剥离和胰酶消化首先获得曲细精管,然后采用胶原酶法进行消化,获得支持细胞和生殖细胞的混合细胞;之后差速贴壁培养,获得较纯洁的支持细胞;更换新鲜培养液继续培养,获得原代支持细胞,见图1。支持细胞进行免疫组化染色,结果表明,培养的细胞表达波形蛋白,支持细胞的纯度达到95%以上,见图2。

图1 犊牛睾丸支持细胞的体外培养(Bar=50μm)
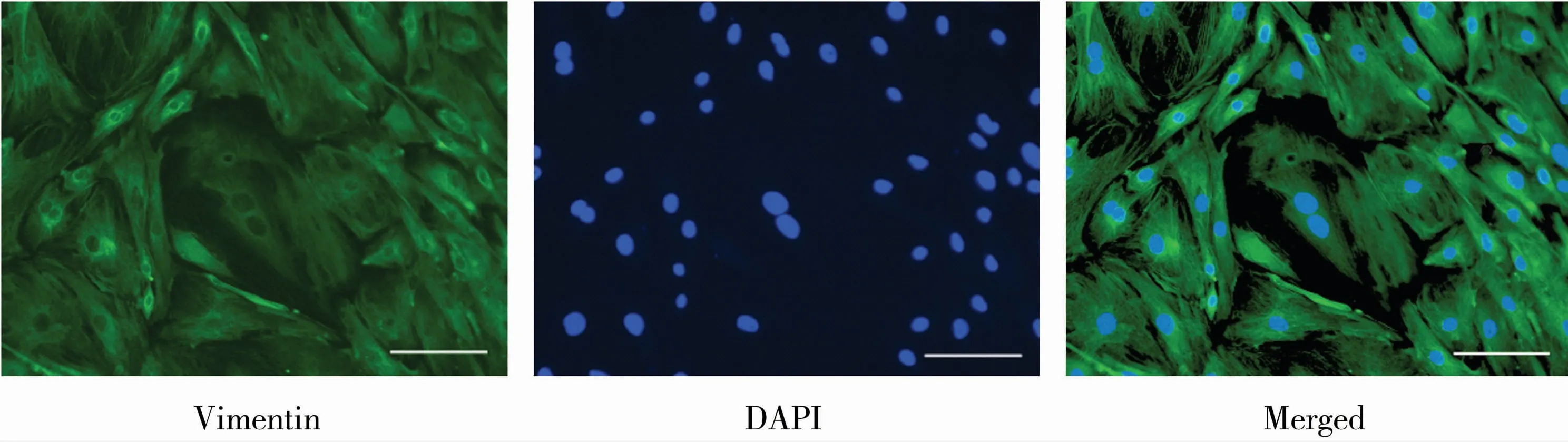
图2 犊牛睾丸支持细胞的免疫荧光染色鉴定(Bar=50μm)
2.2 犊牛睾丸支持细胞的转染
转染48 h后,将细胞以1∶5的比例传代到新的培养皿中培养;第2天加入筛选剂量的G418。1周后未转染的细胞大量死亡,剩余的为转染的细胞群,见图3;更换含维持剂量G418的培养基继续培养,2周后得到稳定整合有外源基因的支持细胞克隆,见图4。

图3 G418筛选1周的犊牛睾丸支持细胞(Bar=50μm)

图4 G418筛选2周的犊牛睾丸支持细胞(Bar=100μm)
3 讨论
随着对睾丸支持细胞生物学特性研究的逐渐深入,支持细胞的分离方法和程序要求既要操作简单还要适合在无菌条件下进行。本试验利用胶原酶和胰酶两种组合酶前后分别对细胞进行消化,根据支持细胞和精原细胞生长速度和贴壁时间不一致的特点分离纯化支持细胞。在培养4~6 h后将未贴壁的精原细胞去除,从而得到生长状态良好、较为纯化的犊牛睾丸支持细胞。由于简化了犊牛睾丸支持细胞的分离和纯化步骤,最大限度地避免了睾丸中其他体细胞与各级生精细胞的污染。
目前细胞转染系统主要有两大类型,一类是基因整合并持续稳定表达的细胞系,另一类是不产生基因整合的短暂转染细胞系。转染使用的方法有很多,如化学转染法(DEAE葡聚糖法和人工脂质体法等)、物理转染法(电穿孔法和基因枪法等)和病毒介导转染法[11-12]。每种转染方法都有各自的特点,转染效率也不一致,根据细胞特点以及试验实际情况可以自行选择。犊牛睾丸支持细胞是研究雄性动物血睾屏障的一个良好的研究体系。本试验利用Lipofectamine 2000转染pEGFPN3载体,转染48 h后EGFP蛋白仍在细胞中均匀表达,通过G418筛选后得到稳定整合有外源基因的犊牛睾丸支持细胞克隆。在试验中发现转染效率低是一个常见问题,这与细胞的生长特性和转染时的细胞状态有密切联系。因此,在转染中为了提高转染效率,选择了处于对数生长期且生长状态良好的睾丸支持细胞,尽可能减少细胞暴露时间,还要选择合适的细胞数量进行转染;其次EGFP蛋白在未正确折叠时也不会观察到荧光,且相对分子质量大小的改变可能会影响EGFP生色基团的形成和EGFP的功能,这可能是转染后少数细胞中没有观察到绿色荧光的原因之一。在今后的研究中,可根据上述影响外源基因转染效率的参数来进一步优化pEGFP-N3质粒转染犊牛睾丸支持细胞的条件。
本试验通过在犊牛睾丸支持细胞中转染pEGFP-N3载体,经过G418筛选后,初步建立了能够稳定表达EGFP的细胞系。然而这种原代细胞随着筛选次代的增多,细胞会出现衰老的特征,因此需要根据细胞自身的特质在合适的代次中开展研究,本试验成果将为目标蛋白质在犊牛睾丸支持细胞中的功能研究提供理论依据。

