维生素E对小鼠精子质量的影响研究
韩 奕,张 林,侯令欣,张鸿露,景文娟,温诏禹,张 杰,尉俊岭,莫显红
(赤峰学院 化学与生命科学学院,内蒙古 赤峰 024000)
随着社会经济的迅猛发展,人们对生活品质的追求不断提高。其中猪、牛、羊肉作为日常生活中肉类食品的主要来源,需求量不断增加,同时对其品质的要求也在提高。目前在家畜育种繁殖过程中仍然存在很多问题,如家畜精子品质差、存活率低,导致受精率低,甚至出现不育的现象,这是目前亟待解决的问题[1-3]。精子从发生到成熟的过程中,如果受到周围环境、生殖毒性以及机体内分泌调节紊乱等因素的影响,会引起精子质量下降、繁殖性能受损[4-5];精浆中抗氧化酶活性不足是导致男性不育的主要原因[6-8];此外,精液保存过程中产生的氧化应激现象,是导致精子损伤及受精能力下降的重要原因之一[9-10]。
维生素E是机体所必需的微量营养素,但它在体内不能自主合成,必须从相应的食物或营养强化剂中才能获得。相关试验结果证明,维生素E具有抗氧化活性,在生殖方面具有积极作用:它能够提高家畜生殖器官发育、精子活率以及精子品质,降低精子畸形率,从而提高生育能力[2-3];维生素E还可以防御辐射所致的氧化损伤,保护精细胞、卵细胞、肺部细胞、血红细胞和白细胞膜的完整性[11-12]。
本试验以昆明小白鼠为试验动物,探讨如何在体内对精子形成有效的保护。迄今为止,饲喂维生素E软胶囊对小鼠精液品质的影响及适宜浓度范围的研究较少。本试验主要通过检测精子活力、精子密度,综合评价维生素E对精子特性的影响;并将各组精液与卵母细胞进行体外受精,通过统计卵裂率和囊胚率评价维生素E对精子体外受精能力的影响,综合分析维生素E对改善小鼠精子品质和受精能力之间的相关性,以期为家畜动物育种生产提供参考。
1 材料
1.1 试验动物
昆明白系3~4周龄雄性小鼠、7~8周龄成熟雌性小白鼠各36只,购自斯贝福生物技术有限公司。
1.2 主要试剂及操作液
试验所用试剂除特别说明外,均为Sigma公司产品。
1)M2液的配制。称取NaCl 2.767 g,KCl 0.178 g,KH2PO40.081 g,NaHCO30.168g,MgSO4(单溶)0.147 g,CaCl2(单溶)0.125 g,乳酸钠1.660 mL,葡萄糖0.500 g,丙酮酸钠0.011 g,谷氨酰胺0.073 g,青霉素G 0.030 g,加水混匀定容至500 mL,使用一次性无菌滤器过滤后放于冰箱4℃储存。使用前取适量液体加入3 mg/mL牛血清白蛋白(BSA),现用现配。
2)精子获能液和受精液。人类输卵管液(HTF液,M1130,购自南京爱贝生物科技有限公司),专为受精过程中精子和卵母细胞提供适宜的环境。该培养液采用碳酸氢盐缓冲系统,为促进卵母细胞和精子细胞进行有效的新陈代谢创建富含葡萄糖的环境。适用于在5% CO2环境中进行短时间或长时间受精操作。
3)胚胎培养液。小鼠胚胎培养液(KSOM液,Merck Millipore公司产品),包含低浓度NaCl、KCl、乳酸盐和葡萄糖,用于体外受精早期胚胎培养,支持各种品系小鼠的早期胚胎发育。
2 方法
2.1 小鼠的分组及饲养管理
选取3~4周龄健康雄性小鼠36只,随机分对照组和试验组,每组6只,对照组和试验1,2,3,4,5组分别灌服维生素E 0,20,40,60,80,100 mg/d,共处理30 d,每隔7 d测量1次体重并记录。试验小鼠均饲养于控光条件下(光照14 h,05:00—19:00),自由采食和饮水[13]。
2.2 维生素E剂量的换算
已知维生素E软胶囊400 mg/粒,每瓶100粒,每粒含维生素E 100.0 mg。
单位换算:m=ρV。式中:m为质量,ρ为密度,V为体积。
ρ(维生素E)=0.94 g/mL,则对照组和5个试验组饲喂维生素E的剂量分别为0,21,43,64,86,106μL。
2.3 精液的获取
饲养30 d后,采用颈部脱臼法处死小鼠,用剪刀剪取附睾和附睾尾,称重。随后在洁净无菌条件下将附睾尾剪3~4个切口,放入预先平衡的HTF液中,于37℃、饱和湿度、5% CO2培养箱中获能1.0~1.5 h。获能处理后的精子用于检测精子活力和精子密度,或用于体外受精。
2.4 精子密度与精子活力的测定
精子处理后直接送赤峰市妇产医院生殖中心检测精子活力和精子密度。
2.5 卵母细胞的获取方法
选用7~8周龄雌性小鼠36只,购入后适应性饲养3 d,腹腔注射孕马血清促性腺激素(PMSG,购自宁波第二激素厂)7.5 IU/只,48 h后注射人绒毛膜促性腺激素(hCG,购自宁波第二激素厂)7.5 IU/只。hCG注射14~16 h后,采用颈部脱臼法处死小鼠,解剖,获得输卵管壶腹部(见图1),于M2操作液中用1 mL注射器轻轻划开,收集卵丘卵母细胞复合体(COCs,见图2)。将COCs移入0.1%(W/V)的透明质酸酶中消化,脱去卵丘颗粒细胞,在体视显微镜下收集形态正常、胞质均匀、有第一极体排出的卵母细胞供体外受精试验用[14]。

图1 小鼠输卵管壶腹部

图2 小鼠卵丘卵母细胞复合体
2.6 体外受精及早期胚胎培养
吸取适量已获能的精子悬浮液加入含有卵母细胞的HTF微滴中。精卵结合4~6 h后,洗去多余精子,移入KSOM液微滴中发育。24 h后统计卵裂率,96 h后统计囊胚率。
2.7 数据的统计分析
试验中除体重变化采用“平均数”表示外,其余指标均采用“平均数±标准差(Mean±SD)”表示,使用SPSS16.0软件进行数据分析。
3 结果与分析
3.1 平均体重变化
见表1。
由表1可知,与对照组相比,试验1,2,3,4,5组小鼠各阶段平均体重均无显著差异(P>0.05)。说明脂溶性维生素E不会引起肥胖,从而影响精子质量。
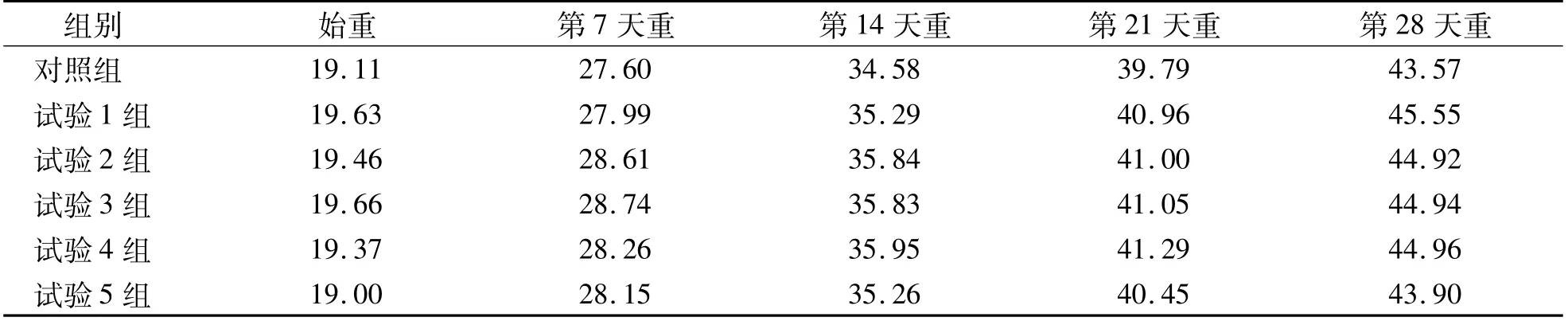
表1 各组雄性小鼠体重测定结果 g
3.2 睾丸和附睾尾重量
见表2。
由表2可知,试验1,2,3,4,5组小鼠睾丸和附睾尾重量与对照组相比均无显著差异(P>0.05)。

表2 各组雄性小鼠睾丸和附睾尾重量测定结果g
3.3 精子品质
见表3。
由表3可知,试验2,3组精子活力、精子密度显著高于对照组和其他试验组(P<0.05),试验1,4,5组与对照组相比无显著差异(P>0.05)。

表3 各组雄性小鼠精子活力和密度测定结果
3.4 精子受精能力
见表4。

表4 各组精子受精能力测定结果
由表4可知:经过体外受精,卵裂率各组之间均无显著差异(P>0.05);试验2,3组囊胚率显著高于对照组(P<0.05),试验1,4,5组与对照组相比无显著差异(P>0.05)。
4 讨论
本试验结果表明,雄性小鼠饲喂维生素E可有效提高精子质量。维生素E 剂量为40~60 mg/d的试验2,3组精子密度、精子活力均显著高于对照组;而维生素E剂量再增加,精子密度、精子活力则呈下降趋势。在体外受精试验中发现,维生素E剂量为40~60 mg/d的试验2,3组受精后卵裂率与对照组和其他试验组无显著差异,但囊胚率显著高于对照组。可见,精子活力、精子密度与受精能力息息相关。
维生素E为机体内重要的微量营养素,又称生育酚,具有抗氧化活性,可有效阻止活性氧化物的形成,改善精液品质。2018年,曲扬华[2]在维生素E对绵羊精子发生的影响机制研究中发现,维生素E可通过提高绵羊睾丸细胞活力,参与调控绵羊生精过程中关键基因的表达,进而促进精子发生。然而,高剂量维生素E又会导致生精细胞数量减少与凋亡增加,这与本试验结果一致,即灌服高浓度(80~100 mg/d)维生素E的试验4,5组精子活力、精子密度低于灌服40~60 mg/d维生素E的试验2,3组。其影响机制可能与血清甲状腺激素(T4)水平下降与激素受体基因表达水平下调有关;还可通过睾丸细胞内TGF-β信号通路下调细胞外基质组分胶原蛋白的基因表达,导致细胞外基质含量减少,从而影响精子发生。
精子损伤还包括DNA断裂,这会导致受精后胎儿畸形或形成死胎,引起流产或无法受孕[10,15]。本试验中饲喂40 ~60 mg/d维生素E的试验2,3组体外受精后囊胚率显著高于对照组。这可能是因为在精子发生过程中,维生素E通过提高过氧化氢酶(CAT)、谷胱甘肽还原酶(GR)、谷胱甘肽过氧化物酶(GSH-PX)和超氧化物歧化酶(SOD)活性,抵抗氧化应激,有效保持了精子DNA的完整性[9]。
本试验采用不同浓度的维生素E饲喂雄性小鼠,饲喂40~60 mg/d范围对小鼠精子密度、精子活力及提高体外受精能力具有积极作用。维生素E发生作用的浓度存在物种差异,小鼠与猪、羊等动物的有效剂量不同;另外维生素E的剂型对动物有效作用也是有影响的,本试验中所用的维生素E为油状软胶丸,纯度与粉末状维生素E存在差异。
5 结论
灌服维生素E 40~60 mg/d可有效提高小鼠精子活力和精子密度,对小鼠精子的保护作用较好,同时也提高了体外受精效果。

