基于SOCS1/STAT3信号通路探讨miR-155对川崎病幼鼠心肌损伤的影响
李海洲,张 琳,王 瑾,郭玉梅,张金盈
川崎病多发生于5岁以下儿童,是一种以全身血管炎症为主要病理特征的急性发热性、出疹性自身免疫性疾病,临床表现为持续发热、皮肤出疹、黏膜充血、淋巴结肿大、手足水肿等[1]。川崎病除引起冠状动脉病变外,也可引起心肌损伤,50%~70%的川崎病患儿存在心肌炎或心肌损伤,导致部分川崎病患儿心脏收缩和舒张功能异常,严重危害生命健康,是后天性心脏病的主要病因[2]。川崎病发病机制尚不明确,临床研究显示,川崎病的发生与感染引起自身免疫功能异常有关[3]。微小RNA(miRNA)是一种非编码的小分子RNA,参与细胞增殖、分化及凋亡等多种生物学过程,miRNA表达异常与多种心血管疾病有关,川崎病患儿存在血清多种miRNA异常表达,通过调控下游靶基因,参与川崎病发生、发展过程,探讨川崎病发病过程中异常表达的miRNA可能为治疗川崎病提供新思路和新方法[4-5]。miR-155是一种多功能miRNA,在多种肿瘤组织异常表达,且与机体免疫关系密切,参与炎症介导、T细胞分化等过程,与多种自身免疫性疾病有关[6]。miR-155在川崎病心肌损伤中的作用机制尚不明确,本研究通过建立川崎病幼鼠模型,探讨miR-155对川崎病心肌损伤的影响及可能机制,寻求川崎病治疗的分子标志物,旨在为临床治疗川崎病提供依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物、菌种 无特定病原体(SPF)级BALB/C雄性小鼠40只,4周龄,体质量(15.30±1.50)g,购自北京维通利华实验动物技术有限公司,动物许可证号:SCXK(京)2016-0001。小鼠饲养于清洁通风环境,温度(23±2)℃,湿度(50±5)%,明暗周期12 h/12 h循环标准,适应性饲养1周。干酪乳杆菌干菌种购自中国工业微生物菌种保藏管理中心。
1.1.2 实验试剂和仪器 含有miR-155抑制序列(miR-155-inhibitor)和无义随机序列(miR-155-inhibitor-NC)的pcDNA3.1质粒(上海吉玛制药技术有限公司),LipofectamineTM2000试剂盒(美国Invitrogen公司),小鼠CD4+T细胞分离试剂盒(德国Miltenyi公司),小鼠心肌肌钙蛋白I(cardiac troponin I,cTnI)、肿瘤坏死因子-α(tumor necrosis factor α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)酶联免疫吸附测定(ELISA)试剂盒(上海通蔚生物科技有限公司),肌酸激酶同工酶(creatine kinase isoenzyme-MB,CK-MB)ELISA试剂盒(上海谷研实业有限公司),兔抗小鼠细胞因子信号转导抑制因子1(suppressor of cytokine signaling,SOCS1)单抗、兔抗小鼠信号传导与转录激活因子3(signal transduction and activators of transcription 3,STAT3)多抗、兔抗小鼠STAT3磷酸化(p-STAT3)多抗(美国Abcam公司),羊抗兔二抗-HRP(中杉金桥生物技术有限公司),UT6100酶标仪(孚光精仪有限公司),DYY-6C电泳仪(北京六一仪器厂)。
1.2 实验方法
1.2.1 建立川崎病幼鼠模型 采用干酪乳杆菌胞壁成分(lacto bacillus casei cell wall extract,LCWE)诱导川崎病模型:将干酪乳杆菌菌种接种于肉汤培养基,置于体积分数5% CO2培养箱内37 ℃恒温培养48 h,常温下以5 000 r/min(离心半径10 cm)离心30 min,留取沉淀物,磷酸缓冲盐溶液洗涤,加入150 mL的SDS裂解液(40 g/L)过夜,沉淀物采用磷酸缓冲盐溶液洗涤10次,加入250 μg/mL的RNA酶、DNA酶、胰蛋白酶,分别于培养箱中37 ℃恒温孵育4 h,磷酸缓冲盐溶液洗涤2次,常温下以5 000 r/min(离心半径10 cm)离心5 min,弃上清液。1 g沉淀物加入5 mL 磷酸缓冲盐溶液,水浴超声裂解2 h,以15 000 r/min(离心半径12 cm)离心60 min,取上清液,即为LCWE。根据苯酚/硫酸比色法,测定上清液鼠李糖浓度,计算LCWE含量,采用磷酸缓冲盐溶液将LCWE浓度调整为1 mg/mL。
1.2.2 动物分组 取30只小鼠,按每只小鼠0.5 mL腹腔注射LCWE,剩余10只为正常对照组,按每只小鼠0.5 mL腹腔注射磷酸缓冲盐溶液,均注射1次。14 d后,将30只建模小鼠随机分为阴性对照组和模型组、抑制组。按照LipofectamineTM2000说明书制备质粒脂质体复合物,分别将含有miR-155-inhibitor、miR-155-inhibitor-NC的质粒脂质体复合物,抑制组、阴性对照组按每只小鼠200 μL经尾静脉注射入体内;正常对照组和模型组按每只小鼠200 μL注射磷酸缓冲盐溶液。干预第1天、第7天分别注射1次。
1.2.3 标本采集 干预7 d后,处死小鼠,腹主动脉采血,取2 mL加入乙二胺四乙酸(EDTA)抗凝;另取2 mL血液3 000 r/min(离心半径10 cm)离心5 min,取上清液保存于-70 ℃冰箱;摘取脾脏,放入冷Hanks液中;取心尖组织,一部分心肌组织置入4%多聚甲醛进行固定,一部分心肌组织保存于液氮中。
1.2.4 检测心肌组织miR-155表达 取液氮保存心肌组织70 mg,提取总RNA并检测RNA浓度和纯度,逆转录cDNA,进行实时荧光定量聚合酶链式反应(qPCR),反应体系:2 μL模板cDNA,2×qPCR Mix 10 μL,1 μL正向、反向引物,加双蒸水至总体积25 μL。反应条件:94 ℃预变性5 min,94 ℃变性10 s,50 ℃退火30 s,72 ℃延伸10 s,40个循环,以U6为内参基因,引物由上海生工合成,引物序列见表1。采用2-△△CT法计算目的基因相对表达量。

表1 miR-155引物序列
1.2.5 检测血清cTnI、CK-MB、TNF-α、IL-6水平 取保存血清,严格按照ELISA试剂盒说明书操作步骤,测定血清cTnI、CK-MB、TNF-α、IL-6水平,添加终止液结束反应后,在450 nm处采用酶标仪测定光密度值,根据标准品绘制标准曲线,计算待测样品cTnI、CK-MB、TNF-α、IL-6水平。
1.2.6 苏木精-伊红(HE)染色观察心肌组织病理学变化 取多聚甲醛固定的心肌组织,梯度浓度乙醇脱水,二甲苯透明,石蜡包埋后,切片机切片(厚度4 μm),脱蜡,常规HE染色,乙醇脱水、二甲苯透明、封片,于显微镜下观察心肌组织病理形态变化。
1.2.7 检测脾脏Th17/Treg细胞分化 取脾脏,研磨过滤后获得单细胞悬液,悬浮于含有10%胎牛血清的培养基中,采用磷酸缓冲盐溶液+BSA+EDTA缓冲液冲洗两次,根据CD4+T细胞分离试剂盒说明书采用磁珠分离法分离CD4+T细胞。流式细胞仪检测CD4+T细胞纯度>95%,台盼蓝染色,细胞存活率>93%。流式细胞仪检测Th17(CD3+CD4+IL-17A+)细胞和Treg(CD4+CD25+FoxP3+)细胞比例。
1.2.8 检测心肌组织SOCS1 mRNA、STAT3 mRNA表达水平 取液氮保存的心肌组织80 mg,实时荧光定量PCR检测SOCS1、STAT3 mRNA表达水平,方法同1.2.4。引物序列见表2。

表2 SOCS1 mRNA、STAT3 mRNA引物序列
1.2.9 检测心肌组织SOCS1、STAT3、p-STAT3蛋白水平 取液氮保存的心肌组织80 mg,加入预冷的磷酸缓冲盐溶液中,4 ℃条件下,以1 000 r/min离心10 min,弃上清液,加入RIPA裂解液,冰上充分研磨,裂解30 min;4 ℃条件下,以12 000 r/min离心30 min,弃上清液,采用免疫印迹法(Western Blotting)进行蛋白定量测定,配制凝胶,进行SDS-PAGE电泳,之后将蛋白转至PVDF膜,室温5%脱脂奶粉封闭2 h,分别将蛋白条带放入SOCS1(1∶2000)、STAT3(1∶2000)、p-STAT3(1∶2 000)、β-actin(1∶5 000)一抗中,4 ℃孵育过夜,TBST溶液洗膜,将蛋白条带加入HRP标记的山羊抗兔二抗(1∶4 000),室温孵育2 h,TBST溶液洗膜,加入ECL化学发光液显影、定影,采用Image J软件分析蛋白条带灰度值,计算目的蛋白相对表达量,目的蛋白相对表达水平以其与内参蛋白条带灰度比值表示。
2 结 果
2.1 各组心肌组织miR-155相对表达量比较 正常对照组、阴性对照组、模型组、抑制组miR-155相对表达量比较,差异有统计学意义(F=316.198,P<0.001)。与正常对照组比较,阴性对照组、模型组miR-155相对表达量升高(P<0.05),抑制组miR-155相对表达量降低(P<0.05);与阴性对照组、模型组比较,抑制组miR-155相对表达量降低(P<0.01),阴性对照组和模型组miR-155相对表达量比较,差异无统计学意义(P>0.05)。详见表3。
表3 各组心肌组织miR-155相对表达量比较(±s)
2.2 各组血清cTnI、CK-MB水平比较 各组血清cTnI、CK-MB水平比较,差异有统计学意义(P<0.001)。与正常对照组比较,阴性对照组、模型组、抑制组血清cTnI、CK-MB水平升高(P<0.05);与阴性对照组、模型组比较,抑制组血清cTnI、CK-MB水平降低(P<0.05);阴性对照组和模型组血清cTnI、CK-MB水平比较,差异均无统计学意义(P>0.05)。详见表4。
表4 各组血清cTnI、CK-MB水平比较(±s)
2.3 各组血清TNF-α、IL-6水平比较 各组血清TNF-α、IL-6水平比较,差异有统计学意义(P<0.001)。与正常对照组比较,阴性对照组、模型组、抑制组血清TNF-α、IL-6水平升高(P<0.05);与阴性对照组、模型组比较,抑制组血清TNF-α、IL-6水平降低(P<0.05);阴性对照组和模型组血清TNF-α、IL-6水平比较,差异无统计学意义(P>0.05)。详见表5。

表5 各组血清TNF-α、IL-6水平比较(±s) 单位:ng/L
2.4 心肌组织病理学变化 HE染色显示,正常对照组心肌纤维排列整齐,走向规则,未见病理形态学改变;模型组和阴性对照组心肌纤维排列混乱,出现萎缩、断裂,存在明显炎性细胞浸润;抑制组心肌纤维较模型组和阴性对照组明显改善,心肌纤维排列较整齐,炎性细胞浸润减少。详见图1。

图1 心肌组织病理学HE染色图像(×200)
2.5 各组脾脏Th17细胞、Treg细胞占CD4+细胞比例比较 各组脾脏Th17细胞、Treg细胞占CD4+细胞比例比较,差异均有统计学意义(P<0.001)。与正常对照组比较,阴性对照组、模型组、抑制组脾脏Th17细胞占CD4+细胞比例升高,Treg细胞占CD4+细胞比例降低(P<0.05);与阴性对照组、模型组比较,抑制组脾脏Th17细胞占CD4+细胞比例降低,Treg细胞占CD4+细胞比例升高(P<0.05);阴性对照组和模型组脾脏Th17细胞、Treg细胞占CD4+细胞比例比较,差异均无统计学意义(P>0.05)。详见表6。
表6 各组脾脏Th17细胞、Treg细胞占CD4+细胞比例比较(±s) 单位:%
2.6 各组心肌组织SOCS1 mRNA、STAT3 mRNA表达比较 各组心肌组织SOCS1 mRNA表达比较,差异有统计学意义(P<0.001)。与正常对照组比较,阴性对照组、模型组、抑制组心肌组织SOCS1 mRNA表达降低(P<0.05);与阴性对照组、模型组比较,抑制组心肌组织SOCS1 mRNA表达升高(P<0.05);阴性对照组和模型组心肌组织SOCS1 mRNA表达比较,差异均无统计学意义(P>0.05)。各组间STAT3 mRNA表达比较,差异均无统计学意义(P>0.05)。详见表7。
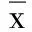
表7 各组心肌组织SOCS1 mRNA、STAT3 mRNA表达比较(±s)
2.7 各组心肌组织SOCS1、STAT3、p-STAT3蛋白水平比较 各组心肌组织SOCS1、p-STAT3蛋白水平比较,差异有统计学意义(P<0.001)。与正常对照组比较,阴性对照组、模型组、抑制组心肌组织SOCS1蛋白水平降低,p-STAT3蛋白水平升高(P<0.05);与阴性对照组、模型组比较,抑制组心肌组织SOCS1蛋白水平升高,p-STAT3蛋白水平降低(P<0.05);阴性对照组和模型组心肌组织SOCS1、p-STAT3蛋白水平比较,差异均无统计学意义(P>0.05)。各组间STAT3蛋白水平比较,差异均无统计学意义(P>0.05)。详见表8、图2。
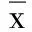
表8 各组心肌组织SOCS1、STAT3、p-STAT3蛋白水平比较(±s)

图2 Western Blotting检测p-STATS、STAT3、SOCS1蛋白表达电泳图
3 讨 论
川崎病是儿童的常见疾病,5岁以下儿童发病率为80%~85%,可累及心血管系统,引起后天性心脏病。目前川崎病的病因及发病机制尚未明确,有研究显示,遗传因素、感染性因素、免疫因素等均影响川崎病的发生,其中,患儿体内免疫失衡在川崎病发生发展过程中发挥重要作用,包括体内T细胞异常激活、细胞因子异常分泌及相关信号转导途径异常等[7-8]。由于川崎病常累及心脏,临床治疗川崎病具有一定局限性,因此,急需鉴定相关分子标记物,探讨川崎病的发病机制,为临床治疗提供一定的理论基础。
miRNA在天然免疫和获得性免疫中具有重要的调控作用,在多种炎症性疾病或类风湿性关节炎、自身免疫性肝炎等疾病中异常表达[9-10]。miR-155与免疫细胞发育和分化过程关系密切,其表达异常影响炎症及自身免疫性疾病的发生发展,miR-155过表达促进Th17细胞分化[11]。本研究结果显示,模型组小鼠miR-155水平显著升高,与崔萍萍等[12]研究结果一致,表明miR-155在川崎病过程中表达异常升高。cTnI、CK-MB是川崎病心肌损伤的特异性指标,具有较高的灵敏度和特异度,其水平异常与心肌损伤程度有关。TNF-α、IL-6参与川崎病心肌损伤的过程,TNF-α作用于血管内皮细胞,诱发血栓形成,IL-6是一种促炎因子,发生川崎病时,血清TNF-α、IL-6水平升高,促进炎症反应,血管内皮细胞受损,血栓形成,加快川崎病发生。Th17/Treg细胞失衡在川崎病发生发展过程中发挥重要作用。Treg细胞是一类具有免疫调节功能的T细胞亚群,可抑制机体病理性免疫反应,维持机体免疫系统稳态,Th17分泌的IL-17可诱导TNF-α、IL-6释放,对炎症及多种免疫性疾病具有促进作用。有研究表明,小鼠发生心肌梗死后心脏miR-155表达增加,抑制miR-155基因表达后,可减轻心肌炎症,同时心功能得到有效改善[13]。抑制病毒性心肌炎患儿高表达的miR-155,可改善Treg细胞失衡,促进免疫应答,减轻炎症损伤,改善心脏功能[14]。本研究结果显示,抑制miR-155表达后,抑制组血清cTnI、CK-MB、TNF-α、IL-6水平下降,心肌损伤显著改善,提示抑制miR-155表达对川崎病心肌损伤具有一定的改善作用,可能通过减少炎症反应,调节Th17/Treg细胞平衡,保护心肌组织免受损伤。
JAK/STAT信号通路广泛参与细胞增殖、分化和凋亡过程,并参与机体炎症反应和免疫调节。STAT3参与Th17细胞关键基因表达,降低STAT3表达可抑制Th17细胞分化。SOCS家族是一种免疫分子,是JAK/STAT通路的负向调节蛋白,可抑制p-STAT,从而抑制通路激活。SOCS1已证实是miR-155的靶基因,miR-155通过靶向抑制SOCS1,激活STAT3,促进CD4+细胞向Th17细胞分化[15]。本研究结果显示,抑制组SOCS1 mRNA及蛋白表达水平下降,p-STAT3蛋白水平升高,提示miR-155可改善川崎病小鼠心肌损伤,可能通过调控SOCS1/STAT3通路,调节Th17/Treg细胞平衡,发挥心肌保护作用。有研究显示,通过上调SOCS1表达,可下调Th17细胞相关因子,降低Th17/Treg比值,从而改善类风湿性关节炎病人Th17/Treg细胞失衡状态[16]。通过抑制自身甲状腺炎小鼠miR-155/SOCS1/STAT3通路,可减少Th17细胞分化,降低炎症反应,改善小鼠免疫失常[17]。川崎病发生过程中,miR-155表达水平显著升高,从而靶向抑制SOCS1表达,提高p-STAT3水平,促进Th17细胞大量分化,导致炎性因子聚集,加重炎症反应和心肌损伤,抑制miR-155表达后,可显著改善川崎病引起的心肌损伤。
综上所述,抑制miR-155可改善川崎病引起的心肌损伤,可能通过调控SOCS1/STAT3信号通路,调节Th17/Treg细胞平衡,发挥心肌保护作用,为临床治疗川崎病提供一定的参考。

