川芎嗪对感染性休克大鼠脑组织PI3K/AKT信号通路及热休克蛋白70的影响
陈世华,付绪华,袁丹桂,郭文涛
感染性休克是一种严重的疾病,常继发于感染、严重外伤、烧伤和大手术等。严重感染性休克可能发展为多器官功能障碍综合征,甚至死亡。感染性休克具有较高的死亡率[1]。目前,每年有超过100万例感染性休克新病例,死亡率为20%~40%[2]。感染性休克的快速发展和高死亡率对临床治疗提出了巨大挑战[3]。脑损伤是感染性休克的常见并发症,因此,研究感染性休克引起的脑损伤发病机制具有重要意义。
磷脂酰肌醇3-激酶(PI3K)/丝氨酸-苏氨酸激酶(AKT)信号通路是细胞内经典的信号通路之一,也是代谢和促分裂原信号(如能量、氨基酸、胰岛素或生长因子)的关键换能器,可调节基因表达、蛋白质翻译和细胞代谢,从而调节细胞生长和增殖[4]。PI3K/AKT信号通路在多种脑部疾病中有研究,如局灶性脑梗死[5]、缺血性脑损伤[6]等,但PI3K/AKT信号通路在感染性休克脑损伤中研究较少。热休克蛋白(heat shock protein,HSP)根据表观分子大小分为几个家族,包括HSP110、HSP90、HSP70、HSP60、HSP32和小型HSP[7]。所有HSP中,HSP70是分子伴侣蛋白和折叠催化剂细胞网络的核心组成部分,也是伴侣蛋白家族中高度应激的诱导成员[8]。高度保守的分子伴侣HSP70具有有效的抗凋亡特性及细胞保护作用[9]。
川芎嗪是从中草药川芎中提取的一种生物活性成分[10]。川芎嗪是常用的中成药之一,在我国已广泛用于心血管疾病的辅助治疗[11]。有研究发现,川芎嗪在多种分子靶标上具有调节能力,如抗炎、抗氧化剂、抗血小板和抗凋亡[12]。然而,关于川芎嗪在感染性休克脑损伤中的研究较少。本研究采用尾静脉注射川芎嗪复制感染性休克大鼠模型,探讨川芎嗪是否通过PI3K/AKT信号通路对感染性休克脑损伤有改善作用,是否与氧化应激水平、炎性因子表达和HSP70蛋白表达有关,进一步探讨其作用机制,以期为临床治疗感染性休克脑损伤提供依据。
1 材料与方法
1.1 实验动物 60只雄性SD大鼠,体重(180±20)g,购自武汉大学动物实验中心[实验动物许可证号:SCXK(鄂)2019-0001]。实验动物设计严格经过医院伦理委员会审查。实验大鼠饲养于标准动物房,适应环境1周,期间正常饮水饮食。
1.2 实验试剂 川芎嗪(HPLC≥98%)购自上海源叶生物科技有限公司;S-100β试剂盒均购自上海远慕生物科技有限公司;神经元特异性烯醇化酶(NSE)试剂盒均购自南京建成生物工程研究所;超氧化物歧化酶(SOD)试剂盒、丙二醛(MDA)试剂盒、一氧化氮(NO)试剂盒购自南京凯基生物科技有限公司;肿瘤坏死因子-α(TNF-α)试剂盒、白细胞介素-1β(IL-1β)试剂盒和白细胞介素-6(IL-6)试剂盒购自北京索莱宝生物科技有限公司;苏木精-伊红(HE)试剂盒购自武汉博士德生物工程有限公司;脱氧核苷酸转移酶标记法(TUNEL)染色试剂盒购自德国Roche公司;PI3K抗体、抗-AKT抗体、AKT抗体、GAPDH抗体和IgG抗体购自美国Abcam公司;HSP70抗体购自美国Cell Signaling Technology公司。
1.3 制备感染性休克大鼠模型 参照文献[13]制备感染性休克大鼠模型,SD大鼠经腹腔注射10%水合氯醛麻醉后,仰卧位固定于手术台上,右侧颈动脉置管监测生命体征。尾静脉缓慢注射5 mg/kg川芎嗪,构建感染性休克模型。血压降低为正常值的2/3,维持2~3 h以上,且伴有皮肤发绀、少尿等现象,提示感染性休克动物模型制备成功。
1.4 动物分组及给药 将60只SD大鼠分为假手术组(sham组)、感染性休克组(LPS组)、川芎嗪低剂量组(LPS+Lig-L组)和川芎嗪高剂量组(LPS+Lig-H组),每组15只。sham组大鼠同时间尾静脉注射相同体积的无菌生理盐水。sham组、LPS组:腹腔注射无菌生理盐水4 mL/kg;LPS+Lig-L组:60 mg/kg的川芎嗪,给药体积为4 mL/kg;LPS+Lig-H组:120 mg/kg的川芎嗪,给药体积为4 mL/kg。造模成功后腹腔注射相应剂量的生理盐水或川芎嗪溶液,24 h后经腹主动脉取血并迅速摘除脑组织。
1.5 观察指标
1.5.1 血清S-100β和血清NSE含量测定 实验结束后,各组大鼠经10%水合氯醛麻醉后,于腹主动脉采血,并置于离心管中,以3 000 r/min离心15 min,吸取上层血清,按照酶联免疫吸附法(ELISA)试剂盒说明书进行操作,采用酶标仪在450 nm波长依序测定各孔OD值,根据标准品OD值绘制的标准曲线将样品OD值代入,计算血清S-100β和NSE含量。
1.5.2 脑组织NO含量测定 将各组大鼠脑组织置于9倍体积磷酸缓冲盐溶液(PBS)中,采用匀浆器充分研磨脑组织,均匀分散到匀浆中,冻融3次,并于4 ℃条件下,以3 000 r/min离心15 min,收集上清液。采用硝酸还原酶法检测组织NO含量。
1.5.3 脑组织SOD、MDA、TNF-α、IL-1β和IL-6含量测定 将各组大鼠脑组织置于9倍体积PBS中,采用匀浆器分散到匀浆中,冻融3次,并在4℃条件下,以3 000 r/min离心15 min,收集上清液。按照ELISA试剂盒说明书进行操作,采用酶标仪在450 nm波长依序测定各孔OD值,根据标准品OD值绘制的标准曲线将样品OD值代入,计算脑组织SOD、MDA、TNF-α、IL-1β和IL-6表达。
1.6 HE染色 各组大鼠脑组织,经固定、常规脱水、透明、浸蜡、石蜡包埋,并制成4 μm的石蜡切片。切片置于苏木精染液中5 min,自来水清洗后,置于1%的盐酸酒精分化数秒,并以流水冲洗。切片放入伊红染液中染色3 min,流水稍洗。之后切片置于梯度乙醇(70%、80%、90%、100%)中脱水,各5 min,再放入二甲苯Ⅰ、Ⅱ中透明,时间为5 min。将切片取出,以滤纸轻轻拭干切片上残余的二甲苯,在组织上滴加中性树胶封片,使用莱卡显微镜进行拍摄。
1.7 TUNEL 各组大鼠脑组织经脱水、包埋、切片并于0.9%氯化钠注射液中孵育5 min。之后将切片以TdT反应混合物37 ℃孵育60 min。再用PBS洗涤后,将组织用0.3%H2O2封闭,加入50 μL TUNEL反应混合物,在黑暗中于湿润环境及37 ℃条件下孵育60 min。PBS洗涤切片3次。荧光显微镜下观察TUNEL阳性细胞数量并拍照。
1.8 免疫印迹法(Western Blotting) 各组大鼠脑组织使用RIPA裂解提取总蛋白,BCA法进行蛋白质定量。将上清液与6×样品缓冲液混合,95℃煮沸5 min,在10%SDS-PAGE上电泳,之后转移到聚偏二氟乙烯(PVDF)膜上。将膜在室温下使用脱脂牛奶封闭1 h,之后与PI3K抗体(1∶1 000)、AKT蛋白磷酸化(p-AKT)抗体(1∶1 000)、AKT抗体(1∶1 000)、HSP70抗体(1∶1 000)和GAPDH抗体(1∶2 000)在4 ℃条件下过夜。将膜用PBS洗涤3次以除去第一抗体,并与辣根过氧化物酶标记的二抗(1∶5 000)室温下温育1 h。使用PBS洗涤3次,并用ECL显色试剂盒显影曝光,采用Image-Pro Plus图像分析系统对蛋白条带的灰度值进行分析。
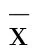
2 结 果
2.1 川芎嗪对各组大鼠血清S-100β和NSE含量的影响 与sham组比较,LPS组大鼠血清S-100β和NSE含量增加(P<0.001);与LPS组比较,LPS+Lig-L组和LPS+Lig-H组大鼠血清S-100β和NSE含量降低(P<0.05或P<0.01)。详见图1。
2.2 LPS对各组大鼠脑组织损伤的影响 HE染色结果表明,sham组大鼠脑组织海马区表现正常形态,具有清晰的边界和完整的细胞带;LPS组大鼠脑组织海马区细胞排列散乱,无明显边界;LPS+Lig-L组和LPS+Lig-H组大鼠脑组织海马区细胞排列较整齐,边界较LPS组清晰,具有完整的细胞带。详见图2。

图2 HE染色检测各组大鼠脑组织损伤情况(×200)
2.3 各组大鼠脑组织氧化应激水平比较 与sham组比较,LPS组大鼠脑组织SOD含量降低(P<0.001),MDA和NO含量增加(P<0.001);与LPS组比较,LPS+Lig-L组和LPS+Lig-H组大鼠脑组织SOD含量增加(P<0.05或P<0.01),MDA和NO含量降低(P<0.05或P<0.01)。详见图3。

与sham组比较,*P<0.001;与LPS组比较,#P<0.05,△P<0.01。图3 各组大鼠脑组织氧化应激水平变化(A为SOD;B为MDA;C为NO)
2.4 各组大鼠脑组织炎性因子表达水平比较 与sham组比较,LPS组大鼠脑组织TNF-α、IL-1β和IL-6含量增加(P<0.001);与LPS组比较,LPS+Lig-L组和LPS+Lig-H组大鼠脑组织TNF-α、IL-1β和IL-6含量降低(P<0.05或P<0.01)。详见图4。

与sham组比较,*P<0.001;与LPS组比较,#P<0.05,△P<0.01。图4 各组大鼠脑组织炎性因子表达水平比较(A为TNF-α;B为IL-1β;C为IL-6)
2.5 川芎嗪对各组大鼠脑组织细胞凋亡的影响 TUNEL染色结果表明,与sham组比较,LPS组大鼠脑组织TUNEL阳性细胞数量增加(P<0.001);与LPS组比较,LPS+Lig-L组和LPS+Lig-H组大鼠脑组织TUNEL阳性细胞数量减少(P<0.05或P<0.01)。详见图5。

与sham组比较,*P<0.001;与LPS组比较,#P<0.05,△P<0.01。图5 川芎嗪对各组大鼠脑组织细胞凋亡的影响(×200)(A为荧光显微镜下图像;B为各组阳性细胞数量比较)
2.6 各组大鼠脑组织PI3K/AKT信号通路相关蛋白表达水平比较 Western Blotting结果表明,与sham组比较,LPS组大鼠脑组织PI3K蛋白表达水平下调(P<0.001),p-AKT表达降低(P<0.001);与LPS组比较,LPS+Lig-L组和LPS+Lig-H组大鼠脑组织PI3K蛋白表达水平上调(P<0.01),p-AKT表达增加(P<0.05或P<0.01)。详见图6。
2.7 各组大鼠脑组织HSP70蛋白表达比较 Western Blotting结果表明,与sham组比较,LPS组大鼠脑组织HSP70蛋白表达水平上调(P<0.05);与LPS组比较,LPS+Lig-L组和LPS+Lig-H组大鼠脑组织HSP70蛋白表达水平上调(P<0.05或P<0.01)。详见图7。
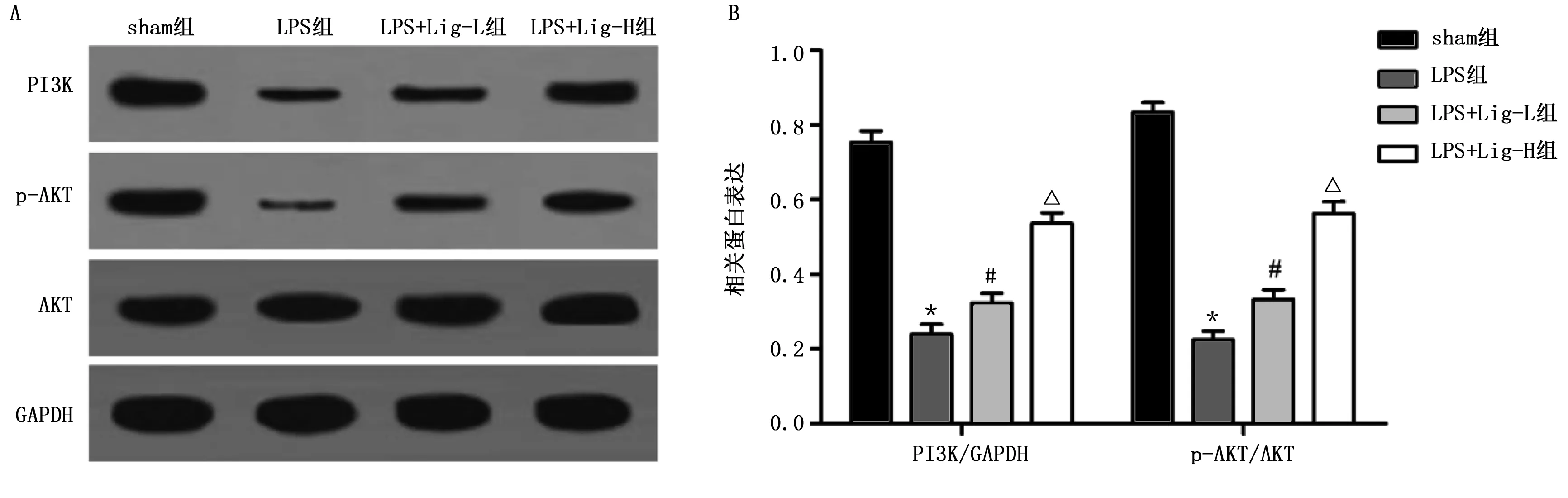
与sham组比较,*P<0.001;与LPS组比较,#P<0.05,△P<0.01。图6 各组大鼠脑组织PI3K/AKT信号通路相关蛋白表达水平比较(A为Western Blotting检测PI3K、p-AKT蛋白电泳图;B为PI3K、p-AKT蛋白表达)
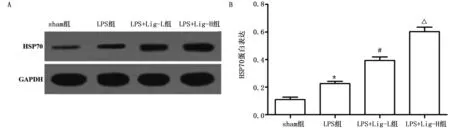
与sham组比较,*P<0.05;与LPS组比较,#P<0.05,△P<0.01。图7 各组大鼠脑组织HSP70蛋白表达比较(A为Western Blotting检测HSP70蛋白电泳图;B为HSP70蛋白表达)
3 讨 论
感染性休克也称脓毒性休克,是由细菌毒素等引起的,以低血压、低氧血症、代谢性酸中毒、多器官功能障碍甚至死亡为特征的全身反应性综合征,病死率高达50%[14]。其中细胞因子和炎症介质失调在感染性休克的发生和发展中发挥着重要作用[15]。感染性休克常见的动物模型包括盲肠结扎和穿刺、结肠提升支架腹膜炎及静脉内注射细菌或内毒素[16]。本研究通过腹腔注射川芎嗪构建大鼠感染性休克模型,是常用的稳定动物模型。有研究表明,95%以上感染性休克是由细菌引起的,其中50%是革兰阴性细菌。川芎嗪是革兰阴性细菌的外膜成分,广泛存在于具有强毒力的细胞中[17]。
川芎嗪是从中草药川芎中提取的重要活性成分之一。有研究发现,川芎嗪通过抗缺血(如扩张脑血管以增加脑血流量)、神经保护和抗炎作用缓解慢性脑灌注不足[18]。川芎嗪及其衍生物通过调节炎症、氧化应激和NO系统对脑中风后再灌注和脑出血具有保护作用[19]。因此,本研究进一步探讨川芎嗪对感染性休克大鼠脑损伤的影响。
S-100β和NSE是脑损伤的标志物,脑组织损伤时,S-100β和NSE表达显著升高[20-21]。有研究表明,SOD是一种源于生命体的活性物质,可消除体内新陈代谢过程产生的有害物质,如氧自由基,从而修复损伤组织,MDA是自由基活化的标志[22]。NO是一种自由基,其作为介质、信使或细胞功能调节因子参与机体病理过程,内毒素刺激星形胶质细胞,iNOS活性升高,NO含量增加[23]。本研究结果发现,大鼠经尾静脉注射川芎嗪后,血清S-100β和NSE含量增加,脑组织SOD含量下降,MDA和NO含量增加,炎性因子(TNF-α、IL-1β和IL-6)含量增加,与上述文献报道一致。给予川芎嗪治疗后,大鼠血清S-100β和NSE含量减少,脑组织SOD含量增加,MDA和NO含量减少,炎性因子(TNF-α、IL-1β和IL-6)含量减少,提示川芎嗪通过减轻氧化应激和炎症反应,缓解感染性休克大鼠脑损伤。PI3K/AKT信号通路是细胞内一条重要的信号通路,参与脑损伤环节。细胞凋亡在脓毒症相关神经元死亡中至关重要,其中PI3K/AKT发挥着重要作用[24]。有研究发现,姜黄素对大鼠脑缺血再灌注具有明显的保护作用,其可能与激活PI3K/AKT/mTOR信号通路,从而抑制炎症、凋亡和氧化应激相关[25]。本研究结果显示,大鼠经尾静脉注射川芎嗪后,脑组织细胞凋亡增加,PI3K蛋白表达水平下调,p-AKT表达降低;给予川芎嗪治疗后,大鼠脑组织细胞凋亡数量减少,PI3K蛋白表达水平上调,p-AKT表达增加,提示川芎嗪可能激活PI3K/AKT信号通路从而抑制凋亡。
HSP是一种应激蛋白,是由机体遭受应激刺激后产生的,其中HSP70是主要的一种。HSP70在正常大鼠脑组织一般不表达,脑组织受到各种损伤被迅速诱导产生。HSP70参与细胞内蛋白折叠、装配、降解、转移和修复等过程,具有维持细胞稳定、保护细胞内外环境稳定的作用[26]。乔小霞等[27]研究发现,氯胺酮可提高大鼠7 d存活率,具有抗感染性休克作用,可能与增加脑组织HSP70表达有关。本研究结果表明,川芎嗪可增加大鼠脑组织HSP70蛋白表达,对感染性休克具有一定的治疗作用,与上述文献结果一致。
综上所述,川芎嗪对感染性休克具有明显的治疗作用,可能与激活PI3K/AKT信号通路从而抑制氧化应激、炎症和凋亡,提高HSP70蛋白表达有关,具体机制有待进一步研究,从而为临床治疗感染性休克脑损伤提供新方法。

