三药化疗联合靶向治疗在转移性结直肠癌的临床研究进展*
李蓝星,张音洁,金永东
610054 成都,电子科技大学 医学院(李蓝星);610041成都,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学医学院 肿瘤内科(张音洁、金永东)
结直肠癌(colorectal cancer,CRC)在我国的发病率在所有恶性肿瘤中位居第3[1],且发病率逐年上升。CRC患者的首发症状常为便血、腹痛、腹泻、便秘、排便习惯改变等非特异性表现,发病较为隐匿[2-3],故多数患者首次就诊时已经发展为III~IV期,无法行根治性手术,其中IV期预后最差,常见转移部位包括肝脏、肺脏、腹膜等[4-5]。一旦确诊为IV期疾病,CRC患者5年的总体生存率就从65%下降至12%[6],由此可见转移性结直肠癌(metastatic colorectal cancer,mCRC)的治疗一直是困扰临床医生的一大难题,针对这一类患者国内外学者做了大量的研究,取得了一定的成就。2015年美国临床肿瘤学会(American Society of Clinical Oncology,ASCO)更新TRIBE研究结果[7]并发表在《柳叶刀》杂志,三药化疗(氟尿嘧啶+奥沙利铂+伊立替康,即FOLFOXIRI方案)联合贝伐珠单抗(bevacizumab,BEV)与传统两药化疗(氟尿嘧啶+伊立替康,即FOLFIRI方案)联合BEV相比较,患者的无进展生存期(progression free survival,PFS)及总生存期(overall survival,OS)都有显著改善,且毒副反应可控。由此,mCRC的治疗向前迈进了令人惊喜的一大步,同时奠定了FOLFOXIRI三药化疗联合BEV在mCRC一线治疗的地位。2019年ASCO公布TRIBE2最新研究结果[8],FOLFOXIRI三药化疗联合BEV治疗方案再次引起热议。作者主要探讨个体化、精准化医学理念指导下三药化疗联合靶向治疗的治疗模式在mCRC的应用范围及不良反应。
1 FOLFOXIRI联合靶向治疗成为mCRC一线治疗的发展历程
1.1 FOLFOXIRI在mCRC治疗中的首次亮相
2002年意大利Falcone教授团队在Journal of Clinical Oncology(JCO)发表FOLFOXIRI三药双周化疗治疗mCRC的初步研究结果[9],这是FOLFOXIRI三药化疗方案首次登上历史舞台。该研究是一项Ⅱ期临床研究,目的为探究FOLFOXIRI三药化疗抗肿瘤治疗的疗效、安全性和药物剂量。试验共入组42名患者,有5例患者(11.9%)治疗后达到完全缓解(complete remission,CR),25例患者(59.5%)部分缓解(partial remission,PR),客观有效率(overall response rate,ORR)为71.4%(95%CI:47%~83%),中位无进展生存期(median progression free survival,mPFS)为10.4个月,中位总生存期(median overall survival,mOS)达到26.5个月。主要毒副反应包括腹泻和粒细胞缺乏,21%患者出现3级腹泻,55%患者出现4级中性粒细胞减少。这项初步探索的结果在疗效方面令人鼓舞,在毒副反应方面主要表现为高发生率的腹泻以及粒细胞缺乏。这项小样本的前瞻性临床研究结果虽然仍需观望,但是为后续临床研究开展提供了三药化疗的科学性和安全性资料,开启了三药化疗在结直肠癌领域的探索之路。
1.2 GONO研究
时隔5年后,2007年Falcone教授再次牵头GONO研究[10]发表在JCO上,该研究是III期随机对照试验,对比了FOLFOXIRI三药化疗与FOLFIRI双药化疗在mCRC患者一线治疗的差异。共入组244例初治不可切除的mCRC患者,FOLFOXIRI三药化疗组和FOLFIRI双药化疗组的CR率分别为8%和6%,PR率分别为58%和35%,ORR分别为66%和41%(P=0.0002);在转移病灶R0切除率方面,三药组相较双药组增加了9%,分别为15%和6%(P=0.033);在仅有肝转移的患者中,R0切除率分别为36%和12%(P=0.017)。三药组和双药组mPFS分别为9.8月和6.9月(HR=0.63,P=0.0006);mOS分别为22.6月和16.7月(HR=0.70,P=0.032)。在毒副反应方面,三药组和双药组分别有19%和0%患者出现2~3级周围神经毒性;50%和28%患者出现3~4级中性粒细胞减少;20%和12%患者出现3~4级腹泻。
GONO研究进一步证实在mCRC一线治疗中,FOLFOXIRI三药化疗相比较FOLFIRI双药化疗而言有效率明显增高且可转化为OS获益。与2002年FOLFOXIRI三药初次研究相比较,GONO研究中下调了FOLFOXIRI三药剂量,毒副反应明显降低,疗效并未受太大影响。GONO研究结果发现FOLFOXIRI三药化疗在mCRC一线治疗中展现显著的优越性,且毒副反应可控,也为后续三药化疗联合靶向治疗临床研究的开展提供理论基础和安全保障。
尽管GONO研究已经坐实三药化疗在mCRC一线治疗的地位,但是研究入组的人群是欧美人群,对于中国人群而言可能会出现更多毒副反应,在国内多数相关临床研究中对5-FU 3 200 mg/m2剂量做出了下调。2020年CSCO结直肠癌指南推荐FOLFOXIRI三药方案中5-FU剂量为2 400~3 200 mg/m2,在临床实践中5-FU具体剂量仍需进一步探索。
1.3 TRIBE研究
随着分子靶向治疗的快速发展,新的问题不断产生,三药联合靶向治疗疗效是否同样优于双药联合靶向治疗呢?2014年底TRIBE研究[11]发表在新英格兰医学杂志,对比了FOLFOXIRI三药联合BEV与FOLFIRI双药联合BEV方案在mCRC一线治疗上的差异。共入组508名患者,三药联合BEV组和双药联合BEV组mPFS分别为12.1月和9.7月(HR=0.75,95%CI:0.62~0.90;P=0.003);ORR分别为65%和53%(P=0.006)。时隔近一年,TRIBE研究最新的OS及亚组分析结果[7]更新于柳叶刀杂志,三药联合BEV组和双药联合BEV组mOS分别为29.8月和25.8月(HR=0.80,95%CI:0.65~0.98)。在亚组分析中,RAS野生型,mPFS分别为13.7月和12.2月(HR=0.85,95%CI:0.55~1.3),mOS分别为41.7月和33.5月(HR=0.75,95%CI:0.45~1.24);RAS突变型,mPFS分别为12.0 月和9.5月(HR=0.82,95%CI:0.63~1.07),mOS分别为27.3 月和23.9月(HR=0.95,95%CI:0.71~1.27);BRAF突变型,mPFS分别为7.5月和5.5月(HR=0.56,95%CI:0.20~1.14),mOS分别为19.1 月和10.8月(HR=0.60,95%CI:0.27~1.33)。在毒副反应方面,三药化疗联合BEV组3~4级神经毒性、口腔炎、腹泻、中性粒细胞减少的发生率明显高于双药化疗联合BEV组,其余不良反应发生率两组相似。TRIBE研究结果认为FOLFOXIRI三药联合BEV与FOLFIRI双药联合BEV相比,改善了mCRC患者的预后,但增加了相关不良事件的发生率。
TRIBE研究在GONO研究基础上加入靶向治疗,首次在III期随机对照临床试验中证明了FOLFOXIRI三药化疗联合BEV方案在mCRC患者一线治疗中疗效明显优于FOLFIRI双药化疗联合BEV方案,中位生存期延长至29.8月。在亚组分析中可以看出,无论RAS及BRAF基因状态如何,三药联合BEV组获益率更高;在RAS野生型亚组中,三药联合BEV组mOS甚至达到41.7月,而在BRAF突变型亚组中,三药联合BEV组mOS只有19.1月。BRAF突变预示肿瘤高侵袭性和预后不良,且化疗效果不佳[12],BRAF抑制剂和MEK抑制剂联合是BRAF V600E突变后续治疗的可选策略[13-14]。
1.4 VISNú-1研究
三药联合BEV相较于双药联合BEV在mCRC患者一线治疗疗效更为显著,但是由于毒副反应及缺乏特异性生物标记物导致难以在临床上常规推广,VISNú-1研究基于上述背景下展开[15]。循环肿瘤细胞(circulating tumour cells,CTC)作为近年来新型的生物标记物,可以从原发肿瘤或者转移灶释放进入外周血,在mCRC患者中,CTC计数是敏感的独立的预后指标,化疗前外周血≥3 CTCs/7.5 mL与<3 CTCs/7.5 mL的患者相比,PFS和OS明显缩短,因此以CTC计数≥3CTCs/7.5 mL可作为独立不良预后的生物标记物[16]。VISNú-1研究旨在探索FOLFOXIRI联合BEV与FOLFOX联合BEV在≥3 CTCs的mCRC患者的疗效差异,共入组349名患者,试验组(FOLFOXIRI联合BEV,n=172)、对照组(FOLFOX联合BEV,n=177)。从结果来看,试验组和对照组mPFS(12.4个月vs9.3个月;HR=0.64;95%CI:0.49~0.82,P=0.0006),mOS(22.3个月对比17.6个月;HR=0.84;95%CI:0.66~1.06,P=0.1411),ORR(59.3%vs52.0%;OR=0.74;95%CI:0.49~1.14;P=0.1685),R0切除率(7.0%vs7.9%;P=0.7400);RAS突变、BRAF突变、大于20 CTC/7.5 mL被确定为独立的不良因素。在3~4级毒副反应方面,试验组在腹泻(22.9%vs6.8%;P<0.0001)、乏力(17.1%vs8.5%;P=0.0163)、中性粒细胞伴发热(8.2%vs2.3%;P=0.0121)发生率更高。
VISNú-1研究作为全球首个使用以CTC为生物标记物指导mCRC患者治疗方案选择的前瞻性研究,试验结论表明,在CTC计数≥3 CTCs/7.5 mL预后不良的mCRC患者,FOLFOXIRI联合BEV相较于FOLFOX联合BEV能够显著改善PFS,CTC计数作为非侵入性生物标记物,在一线治疗选择适合的强化治疗有助于患者最大化受益。但是在试验方案设计中,由于采用了持续性强化诱导治疗,高频率严重的不良反应导致患者失访,对后续试验结果产生不可预知的偏倚。VISNú-1研究通过将肿瘤生物标记物与前瞻性临床试验结合,是精准分子治疗时代的领头羊,为后续临床研究提供了更加宽广的设计理念。
1.5 TRIBE2研究
TRIBE研究开启了mCRC三药化疗联合靶向治疗的新模式,从2016年开始,国内外多个指南先后推荐FOLFOXIRI三药化疗联合BEV作为mCRC的一线治疗可选方案之一。TRIBE研究结果虽然证实了FOLFOXIRI联合BEV在mCRC一线治疗上的显著疗效,然而问题也接踵而来,面对不同亚组分型的患者以及四药毒副反应增加,如何挑选出最适合的患者?与以奥沙利铂和伊立替康为基础的双药化疗联合靶向治疗在mCRC一二线序贯治疗模式相比较,三药化疗联合靶向治疗新模式是否实际获益以及疾病进展(progression disease,PD)后续治疗又该如何选择?
TRIBE2研究[17]基于TRIBE的研究背景,进一步探索三药化疗联合BEV在临床实践中所面临的挑战。2019年ASCO会议上更新TRIBE2研究结果[8]表明,对于初始不可切除的mCRC患者,一线治疗行FOLFOXIRI三药化疗联合BEV治疗后出现PD后再次引入FOLFOXIRI三药化疗联合BEV方案,与一线治疗行mFOLFOX6双药化疗联合BEV治疗后出现PD后二线更换至FOLFIRI双药化疗联合BEV治疗方案相比较,前者显著延长mCRC患者的PFS和OS。2020年TRIBE2研究更新最新的结果[18]并发表在柳叶刀杂志,共入组679名mCRC患者,实验组(FOLFOXIRI三药化疗联合BEV治疗后出现PD后再次引入FOLFOXIRI三药化疗联合BEV治疗,n=339),对照组(mFOLFOX6双药化疗联合BEV治疗后出现PD后序贯至FOLFIRI双药化疗联合BEV治疗,n=340)。研究结果表明,实验组和对照组的PFS1(从随机开始至第一次PD或死亡的时间)分别为12.0月和9.8月(HR=0.74,95%CI:0.63~0.86,P=0.0002);PFS2(从随机开始至第2次PD或死亡的时间)分别为19.2月和16.4月(HR=0.74,95%CI:0.62~0.88,P=0.0005);ORR分别为62%和50%(OR=1.61,95%CI:1.19~2.18,P=0.0023);R0切除分别为17%和12%(OR=1.55,95%CI:1.00~2.39;P=0.047);mOS分别为27.4月和22.5月(HR=0.82,95%CI:0.68~0.98,P=0.032)。在毒副反应方面,实验组和对照组在一线治疗期间分别有229名(68%)和155名(46%)发生了3~4级不良反应,主要是腹泻(17%对比5%)和中性粒细胞减少(50%对比21%),在二线治疗中,对照组和实验组之间报告的3级或4级不良事件的发生率除神经毒性外没有统计学差异。
TRIBE2研究结果可以看出对于初始不可切除的mCRC患者,与一线使用mFOLFOX6双药化疗联合BEV治疗后出现PD序贯二线FOLFIRI双药化疗联合BEV治疗相比较,一线使用FOLFOXIRI联合BEV治疗后出现PD再引入FOLFOXIRI联合BEV治疗模式,后者的PFS和OS获益更显著,如此独树一帜的设计是基于对三药化疗联合靶向治疗在临床上耐药性的考虑,以及在后线治疗选择的大胆探索。相较于临床中常用的双药化疗联合靶向序贯治疗策略,TRIBE2研究为mCRC后线治疗提供更多元化的选择,再引入治疗是对传统治疗模式的新挑战,值得引起更多的关注与思考,尤其对于RAS/BRAF突变、右半结肠、同时转移且一般体力较好的患者,能够从FOLFOXIRI联合BEV得到更大的获益。
2 FOLFOXIRI联合靶向治疗成为mCRC转化治疗新策略
mCRC可分为初始可切除和初始不可切除mCRC。初始不可切除mCRC又可以分为潜在可切除和不可切除mCRC。对于初始可切除的mCRC可以考虑手术治疗;对于潜在可切除的mCRC可考虑转化治疗。mCRC的转化治疗是指通过化疗、放疗、靶向治疗、免疫治疗、介入治疗等多种治疗手段使肿瘤缩小,使初始不可切除的肿瘤转化为可切除的治疗方法。有相关数据证明,切除转移病灶对患者的OS有极大的提高,并且存在治愈的可能性[19-20]。对于不可切除的肝转移病灶的mCRC患者5年生存率约为0[21],而可切除肝转移病灶的mCRC患者5年生存率为43% ~50%[22-23]。转化治疗后可行根治性手术的患者的总体存活率与初始可切除的mCRC患者相近[24-26]。与双药化疗(mFOLFOX6;FOLFIRI)联合靶向治疗相比较,三药化疗(FOLFOXIRI)联合靶向治疗在mCRC转化治疗疗效更好。
2.1 FOLFOXIRI联合抗VEGF单抗在mCRC转化治疗应用
2018年TRIBE研究再次更新结果[27],在RAS/BRAF野生型亚组中,FOFLOXIRI联合BEV组和FOLFIRI联合BEV组在右半结肠ORR分别为81.3%和66.7%,左半结肠ORR分别为63.8%和65.4%。由此可以看出,在右半结肠、RAS/BRAF野生型的mCRC,FOFLOXIRI联合BEV组ORR明显优于FOLFIRI联合BEV组,有效性是转化治疗的基石,更高的有效率意味着可获得更高的转化率。
2018年一篇关于FOLFOXIRI三药化疗联合BEV与FOLFOX/FOLFIRI双药化疗联合BEV在mCRC转化治疗的Meta分析[28]中,作者对4项随机对照试验(STEAM、CHARTA、Olivia和TRIBE试验)的1 013名患者进行荟萃分析。分析结果显示在mCRC转化治疗中,FOLFOXIRI三药化疗联合BEV与双药化疗联合BEV相比,前者显著提高了mCRC患者的R0切除率、ORR,PFS和OS同样也明显延长。在转化治疗失败的mCRC患者中,即使转化治疗失败,FOLFOXIRI三药化疗联合BEV治疗模式也会带来明显的生存获益。FOLFOXIRI三药化疗联合BEV组较双药化疗联合BEV组,患者的总转移灶和肝转移灶的R0切除率得以显著提高(分别为30%和128%)。其他大量研究亦表明,FOLFOXIRI三药化疗联合BEV方案在mCRC患者中具有很高的转化治疗成功率,转移瘤的切除是mCRC潜在的根治方法[19-20]。另一篇对29个已发表试验的综合分析的文章结果表明,在FOLFIRI双药化疗联合BEV治疗方案中,转移灶(任何部位)切除率为9.3%,肝转移病灶切除率为18%[29]。另一项结合11项研究的分析显示,在FOLFOXIRI三药化疗联合BEV方案在mCRC转化治疗中,总转移瘤和肝转移瘤的R0切除率分别为28.1%和54.7%[30]。从上述众多的文章结果中能够清楚地发现,三药联合BEV相较于两药化疗联合BEV在mCRC转化治疗方面,患者的R0切除率、ORR、PFS和OS都有明显增加。
2020年TRIBE2研究更新结果[18],对照组和实验组ORR分别为50%和62%,R0切除率分别为12%和17%。FOFLOXIRI联合BEV组在ORR提高12%,R0切除率提高5%。TRIBE2研究主要人群为右半结肠或RAS/BRAF突变,左半结肠和RAS、BRAF均野生型仅占16%左右,在亚组分析中,FOFLOXIRI联合BEV组在右半结肠或RAS/BRAF突变获益明确。TRIBE2研究可以看出,在右半结肠或RAS/BRAF突变mCRC患者中,三药联合BEV组比双药联合BEV组在转化治疗中有更高的获益率。
基于众多的临床试验证据,2019年CSCO结直肠诊疗指南更新指出,FOLFOXIRI联合BEV应用于mCRC转化治疗的推荐强度从II级推荐提升至I级推荐,建议在RAS和BRAF均野生型的右半结肠、RAS/BRAF突变型的潜在可切除的mCRC人群。
2.2 FOLFOXIRI联合抗EGFR单抗在mCRC转化治疗应用
2.2.1 FOLFOXIRI联合帕尼单抗在mCRC转化治疗应用 2018年ASCO公布VOLFI研究结果[31],VOLFI研究比较mFOLFOXIRI联合帕尼单抗对比FOLFOXIRI三药化疗在RAS野生型mCRC一线治疗的疗效。结果表明,试验组和对照组ORR(85.7%vs54.5%,P=0.0013)、DCR(96.8%vs78.8%,P= 0.0071);在左半结肠,试验组和对照组ORR(90.6%vs60.0%,P=0.0039);在右半结肠,试验组和对照组ORR(60.0%vs50.0%);试验组左右半结肠ORR分别为90.6%和60.0%(P=0.0288),对照组左右半结肠ORR分别为60.0%和50%;在潜在可切除组,试验组和对照组R0切除率分别为60%和36.4%;与治疗相关的3~5级严重不良反应,试验组和对照组分别为32.8%和12.1%(P=0.0297)。从VOLFI研究结果可以看出在RAS野生型mCRC患者中,mFOLFOXIRI联合帕尼单抗相较于FOLFOXIRI三药化疗在左半结肠ORR率明显更高,同时能够获得更高的R0切除率。
2019年7月ASCO更新VOLFI研究结果[32],试验组和对照组ORR(89.2%vs66.7%,P=0.02)、意向性治疗(intention-to-treat,ITT)人群RO切除(33.3%vs12.1%,P=0.029)、mOS(35.7个月vs29.8个月,P=0.12);潜在可切除组R0切除率(75%vs36.4%,P=0.05)、mOS(52.0个月vs41.7个月,P=0.07);从更新结果看出,mFOLFOXIRI联合帕尼单抗能够提高ORR及R0切除率且可以转化为OS获益。
2019年12月VOLFI研究最终结果[33]发表在JCO杂志上,从入组的基线上看,入组人群平均年龄为60岁,主要为ECOG评分0级(60%)、左半结肠RAS野生型,BRAF突变在试验组和对照组分别占10%和25%,且试验组采用的改良的mFOLFOXIRI联合帕尼单抗。最终的试验结果更新了试验组和对照组ORR(87.3%vs60.6%,P=0.004);在探索性研究终点,中位肿瘤缓解深度(median depth of response,DpR)(58.9%vs40.9%,P=0.004)、肿瘤早期退缩(early tumour shrinkage,ETS;首次重新评估时,肿瘤直径缩小>20%)(85.7%vs60.0%,P=0.01),且ETS与OS获益相关(HR=0.43;95%CI:0.24~0.78;P= 0.005); 3~4级不良反应(81.3%对比66.7%,P=0.004),主要是腹泻和皮肤病。
2020年10月VOLFI研究回顾性分析了BRAF状态及原发肿瘤位置对疗效和PD的影响[34],在BRAF野生型与突变型亚组分析中,试验组和对照组DpR(57.6%vs40.8%,P=0.013)、到达最大肿瘤缓解深度的时间(time to DpR)(4.0个月vs3.9个月,P=0.885)、ETS(85.2%vs33.3%,P=0.001)、从最大肿瘤缓解深度开始到肿瘤进展或者死亡的时间(post-DpR PFS,pPFS)(6.5个月vs2.6个月,HR=0.24,P<0.001)、从最大肿瘤缓解深度开始到任何原因死亡时间(post-DpR OS,pOS)(33.6个月vs5.4个月,HR=0.27,P<0.001);在左半和右半结肠亚组分析中,试验组和对照组DpR(56.8%vs30.6%,P=0.018)、time to DpR(3.9月vs3.9月,P=0.666)、ETS(85.7%vs37.5%,P<0.001)、pPFS(5.3个月vs2.5个月,HR=0.36,P=0.004)、pOS(31.8个月vs11.8个月,HR=0.59,P=0.104)。从亚组分析结果可以看出,与BRAF野生及左半mCRC患者相比,BRAF突变和右半mCRC患者对治疗反应明显较差。
从上述VOLFI研究持续更新及亚组分析可以看出,三药联合帕尼单抗强化诱导方案在左半结肠、RAS野生型mCRC患者,尤其是潜在可切除的mCRC人群,有更高的ORR率和R0切除率,且可以转化为OS获益。但随之3~4级不良反应风险也相应增加,转化获益与毒副风险之间的天秤,是需要临床医生充分评估权衡利弊,从入组人群提示四联疗法更适合年轻、体力状态良好,需要强烈转化治疗且无基础疾病的患者。探索性研究终点ETS和DpR可作为早期评估肿瘤反应的指标,对预后良好(BRAF野生型和左半原发肿瘤)的患者更加有倾向性,两项回顾性研究中也证实ETS、DpR指标在左半比右半mCRC患者发生的比率更高[35-36]。在亚组分析中,BRAF突变和右半mCRC患者预后明显较差,与生物学活性不良生存相关[37-38],同时VOLFI研究观察到BRAF突变患者在治疗过程中,出现肿瘤快速侵袭性进展,可能与刺激性治疗耐药相关,序贯治疗能否带来更大收益[34]。VOLFI研究作为II期小样本临床试验,尝试去探究更精确的治疗模式,仍需要更大样本的试验去探索。
另一项三药联合帕尼单抗的临床试验来自于TRIPLETE研究,TRIPLETE研究是一项前瞻性、随机对照、多中心III期临床试验[39],比较mFOLFOXIRI联合帕尼单抗对比mFOLFOX6联合帕尼单抗在不可切除RAS/BRAF野生型mCRC初始治疗的疗效。由于TRIPLETE研究正在进行中结果尚未公布,期待试验结果能为三药联合帕尼单抗带来更高级别的临床证据。
2.2.2 FOLFOXIRI联合西妥昔单抗在mCRC转化治疗应用 2019年世界胃肠道肿瘤大会上报告了ESTER[40]研究,该研究共纳入5项临床研究进行荟萃分析,纳入所有接受FOLFOXIRI联合西妥昔单抗(cetuximab)作为一线治疗方案的RAS野生型mCRC患者。从公布的结果看,最常见的严重不良反应是腹泻(31.4%)、中性粒细胞减少症(21.4%)和发热伴中性粒细胞减少症(2.9%)。中位PFS和OS分别为13.3个月和48.5个月。1年PFS率为56.2%,OS率为92.6%。在亚组分析中,BRAF野生型患者的mPFS为13.3月,而BRAF突变型患者的mPFS为6.0月。BRAF 野生型患者的mOS为50.1月,BRAF突变型患者的mOS为21.2月。总体人群的ORR为85.7%,BRAF野生型和BRAF突变型患者的ORR分别为87.7%和60%。在最初68例不能切除的肝转移瘤患者中,39例(57.4%)接受了手术,其中31例行R0切除。手术组和未手术组的中位OS分别为55.1月和30.7月 (P=0.029)。
从ESTER研究分析中可以看出,FOLFOXIRI联合西妥昔单抗在初始不可切除的RAS野生型mCRC转化治疗潜力是巨大的,需要进一步临床试验去证实,但目前国内外对三药联合西妥昔单抗研究较少,主要是以II期研究和单臂研究为主。
国内FOCULM研究[41]是比较mFOLFOXIRI联合西妥昔单抗对比mFOLFOXIRI三药化疗在RAS和BRAF均野生型初始不可切除的CLM的疗效差异。从试验结果看,试验组和对照组无疾病状态(no evidence of disease,NED)率为70.1%vs41.2%(P=0.005),NED的中位持续时间13.9个月vs10.7个月(P=0.944),整体完全切除率46.3%vs23.5%(P=0.027),其中R0切除率35.8%vs20.6%(P=0.117),R0切除联合热消融10.4%对比2.9%(P=0.187);试验组和对照组ORR率为95.5%vs76.5%(P=0.010),mDpR为56.1%对比44.0%(P=0.012),mPFS为15.5个月vs14.2个月(P=0.031);试验组未达到mOS,对照组mOS为33.2个月(P=0.02);无论是在试验组还是对照组,达到NED的患者相较于未达到NED的患者OS明显更长。在安全性方面,试验组和对照组3~4级毒副反应主要为中性粒细胞减少(31.3%vs41.2%)和腹泻(7.5%vs5.9%);除皮疹相关不良反应试验组远高于对照组(55.2%vs5.9%,P<0.001),其余不良反应事件无统计学差异。
从FOCULM研究可以看出,mFOLFOXIRI联合西妥昔单抗可以提高NED获得率及R0切除率,ORR率达到95.5%,并且可以转化为PFS及OS获益。FOCULM研究作为国内少数的三药联合西妥昔单抗的前瞻性临床研究,纳入人群平均年龄53岁,一般体力状态ECOG评分0级,使用改良FOLFOXIRI,5-氟尿嘧啶减量至2 800 mg/m2,安全性良好且毒副反应可控,年轻且体力状态良好是可耐受毒副反应的潜在因素,FOCULM研究纳入国内患者的人群标准及方案剂量对临床实践具有指导性帮助。同时,FOCULM研究采用多种治疗手段,除了常见的手术治疗外,局部消融技术(local ablative treatment,LAT)也被纳入治疗方案中,并且提高NED获得率;对于不适合手术的CLM患者,LAT是一种合理的治疗选择,并且与OS改善显著相关[42];mCRC的国际治疗指南推荐,对CLM患者的治疗目标是使用包括LAT等多种治疗方式尽可能最大程度地根除所有可见肝转移病灶[43],所以NED率可能是CLM患者转化治疗疗效评估的最佳终点。FOCULM研究结果未公布左右半结肠分组情况,采用非随机对照可能会出现无不可预知的偏倚,随访时间相对较短,长期的数据随访可能会受到影响。
从上述的临床研究以及荟萃分析可以看出,三药联合抗EGFR单抗可以显著提高RAS和BRAF野生型mCRC的转化率,尤其是对于左半结肠潜在可切除的mCRC患者人群。总体而言,三药联合抗EGFR单抗目前仍缺少更高级别的证据,国内外各大指南目前仍以双药联合抗EGFR单抗作为RAS和BRAF均野生型、左半结肠、潜在可切除组mCRC的首选,期待更多的III期临床研究带来更多高级别证据改变目前的格局。
3 总结与展望
从2002年首次提出三药化疗在mCRC治疗的可行性,打开三药化疗临床研究之路;2007年GONO研究证实三药化疗在mCRC一线治疗地位;2015年TRIBE研究结果及更新明确三药联合靶向较双药联合靶向有更好的疗效;2018年TRIBE2研究结果及更新显示三药联合靶向在PD后续治疗中较双药联合靶向序贯治疗仍然有更高的获益(表1)。三药化疗联合靶向治疗一路高歌猛进,坐实mCRC姑息治疗一线地位,但是高获益的背后隐藏着高风险。在mCRC姑息治疗方面,保证高生活质量下的长生存期才是有意义的,三药化疗联合靶向方案如何在保证疗效的前提下尽可能减少不良反应的发生率,在临床实践中选择合适的患者是关键,目前三药方案的剂量仍在摸索阶段,国内FOCULM研究改良的mFOLFOXIRI具有一定参考价值,但是仍需更多的研究去证实探索。在mCRC转化治疗方面,随着TRIBE/TRIBE2研究结果更新、VOLFI研究、FOCULM研究以及众多Meta分析结果的公布,三药化疗联合靶向治疗被作为不同等级的证据级别陆续写进国内外各大指南推荐。在RAS/BRAF突变或右半结肠、RAS和BRAF均野生型的潜在可切除的亚组中,三药联合BEV较双药联合BEV转化率更高;在左半结肠、RAS和BRAF野生型潜在可切除的亚组中,双药联合抗EGFR单抗仍然为首选推荐,但对于在临床上需要接受强烈转化治疗的年轻且一般体力状态好的患者,三药化疗联合抗EGFR单抗不失为更为合适的选择。
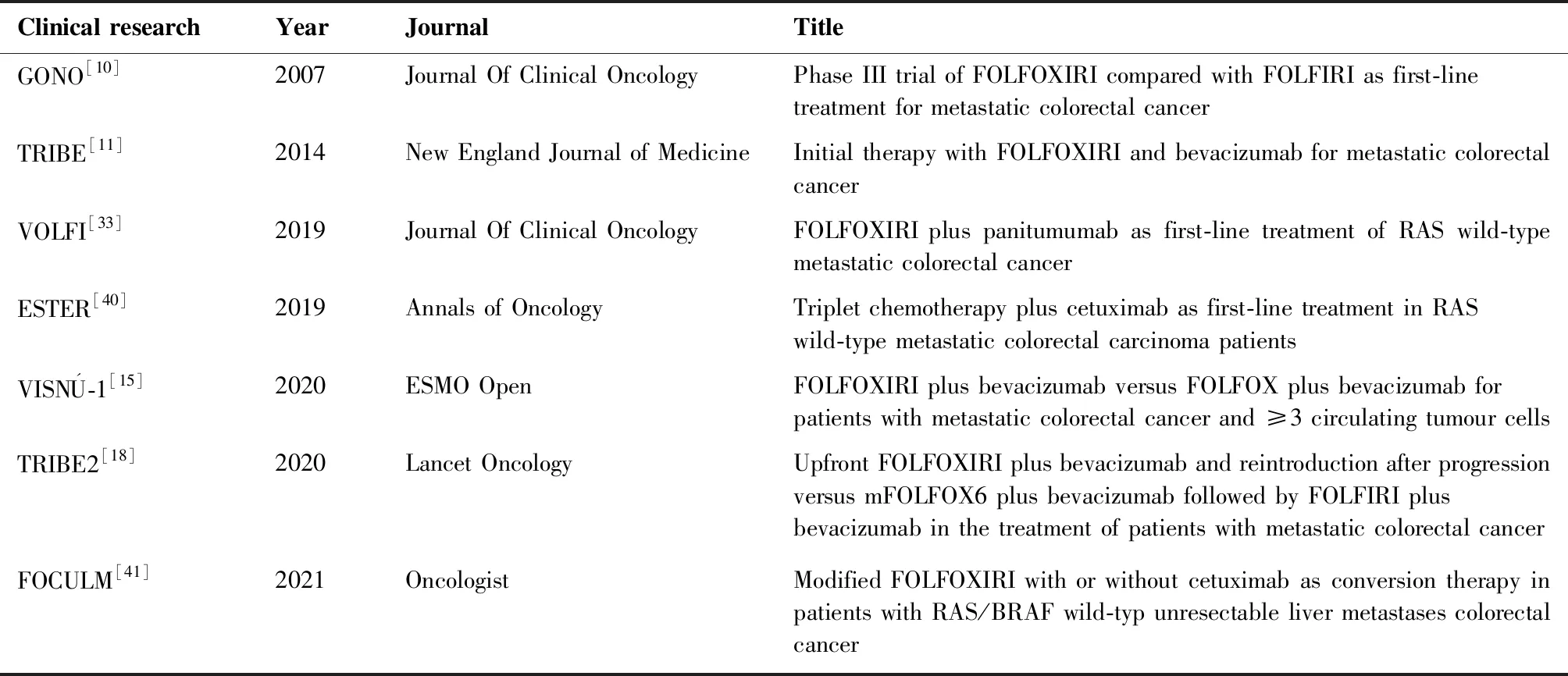
表1 三药化疗联合靶向治疗临床研究进展盘点
NED作为mCRC患者追求的治疗目标,三药化疗联合靶向治疗模式成为有力的武器,随着更多的临床试验的深入探索,三药联合靶向在mCRC治疗的地位逐步提高,三药联合靶向治疗模式在转化治疗中具有更大的舞台,尤其可作为肿瘤负荷大且一般体力状态好的年轻患者的首选方案。然而,四药联合方案导致的不良反应增加以及耐药后的后续治疗选择是阻扰其在临床应用的难题。在精准治疗时代,如何结合患者肿瘤生物学活性、基因分子分型、身体状况、经济条件等开展个性化治疗,帮助患者获得最大化的生存获益,提高生活质量,需要更多的临床试验去探索、研究创新,也需要更多的肿瘤工作者去思考、回顾总结。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

