原发性肝癌立体定向放疗的疗效及安全性研究*
刘晓,李涛,李崇国,吴达军,肖苓,吕家华
646000泸州,西南医科大学 临床医学院(刘晓、李涛);610041成都,四川省肿瘤医院·研究所,四川省癌症防治中心,电子科技大学医学院 胸部放疗科(李涛、吕家华);610041成都,中航工业三六三医院 体部伽玛刀室(李崇国);610000,成都,成都市妇女儿童中心医院 肿瘤科(吴达军);610041成都,电子科技大学 医学院(肖苓)
原发性肝癌是我国高发的恶性肿瘤之一[1]。权威指南推荐,原发性肝癌的治疗首选手术切除,但只有<30%的患者可以进行肝切除;肝移植和射频消融(radiofrequency ablation,RFA)则是小肝癌的标准治疗方式[2-3]。对于符合“米兰标准”[4]的肝癌患者,肝移植术后4年生存率达85%。但由于“米兰标准”过于严格,大量能够通过肝移植获得长期生存的肝癌患者被排除在肝移植治疗之外[5]。对于单个肝癌肿瘤直径小于3cm,RFA可达到与手术完全性(R0切除)肿瘤类似的效果[6]。但RFA用于肿瘤太大或一些特殊部位的肝癌时,消融常不完全,局部复发率较高。肝动脉化疗栓塞(transcatheter arterial chemical embolization,TACE)是不适合手术切除或RFA的中晚期肝癌患者的可选治疗手段之一[7]。但是,肝脏为双重血供器官,肿瘤易出现转移,因此TACE治疗原发性肝癌患者近期疗效尚可,而远期疗效欠佳[8]。由于肝脏的辐射耐受性较低,放射治疗在肝癌中的作用历来受到质疑。然而,随着精准放疗时代的到来,放疗逐渐被认为是原发性肝癌安全有效的局部治疗方法之一。立体定向放射治疗以其疗效确切、不良反应少、疗程短等优势,目前在临床已得到了广泛应用[9]。尽管有许多诊疗手段,肝癌的发病率在全世界范围内还是居高不下,仍然是侵袭性强的肿瘤,致死率高[10],肝外远处转移和肝内转移均是治疗失败的主要原因,是目前肝癌治疗上的难点。由于既往研究大多样本量较少或随访时间较短,疗效和安全性还不确切。本研究回顾性分析中国航空工业三六三医院实施立体定向放射治疗的202例原发性肝癌患者的临床资料,随访观察患者疗效、安全性,并探讨影响预后的因素,为临床治疗肝癌提供思考。
1 资料与方法
1.1 一般资料
选取中国航空工业三六三医院自2006年6月至2017年12月收治接受立体定向放射治疗的原发性肝癌患者。纳入标准:1)临床或病理明确诊断为原发性肝癌[11];2)KPS评分≥70分,无重要器官严重功能异常;3)Child-Pugh分级A、B级;4)BCLC分期为C期以上;5)既往3个月内无放疗史。排除标准:1)不符合入组标准类型的患者;2)全身情况极差,KPS评分<60分;3)Child-Pugh肝功能分级C级;4)BCLC分期D期;5)既往3个月内有放疗史。
1.2 治疗方法
立体定向放射治疗采用深圳奥沃公司生产的OUR-QGD型旋转式立体定向伽玛射线(60钴)全身治疗系统实施治疗。以负压真空袋固定体位,治疗床上取仰卧或俯卧位行增强螺旋CT 3~5mm扫描定位,以定位尺(N型尺)覆盖肝脏病灶范围。将获得的图像及相关数据输入治疗计划系统,进行三维立体重建,制定治疗计划,勾画大体肿瘤体积(gross tumor volume,GTV),临床靶体积(clinical target volume,CTV)和计划靶区体积(planning target volume,PTV),并勾画危及器官(organ at risk,OAR),OAR包括正常肝脏组织、胃、十二指肠、胰腺、肾脏和脊髓等。根据病灶大小采用单靶点或多靶点照射。计划要求以尽量少的靶点和最大的等剂量曲线包绕尽量多的PTV,以及尽量小的正常器官受量。多发病灶相邻间距小于2 cm按照单个病灶勾画靶区。根据病灶大小采用单靶点或多靶点照射。50%等剂量曲线覆盖95%以上靶区,单次处方剂量280~350 cGy/次,总物理剂量3 900~4 900 cGy,治疗次数10~14次,每周5次。对于正常器官受量,与普通放疗类似,正常肝受照射量≤23Gy,与靶区相邻的部分肺平均剂量≤20Gy,十二指肠或胃最大剂量<54Gy,脊髓受量<45Gy,双肾平均剂量≤18Gy。但根据既往病例剂量体积直分图,大部分病例的正常器官受量远远低于上述要求。
1.3 指标观察与随访
随访方式:主要包括门诊复查、电话随访。随访时间:放疗后2年内每3月复查,2年后每6月定期复查,随访内容:主要包括血象、肝功能、甲胎蛋白(alpha fetoprotein,AFP)、输血前检查、病毒复制情况、腹部彩超、CT或MRI等。根据实体瘤疗效评价标准(RECIST)[12]进行近期疗效评价:完全缓解(complete response,CR):已知肿瘤病灶完全消失,维持4周;部分缓解(partial response,PR):目标病灶最长径之和减少≥30%,维持4周;稳定(stable disease,SD):变化介于PR和PD之间;进展(progressinve disease,PD):目标病灶最长径之和增加≥20%。
放射相关毒性反应:放疗期间每周记录不良反应,全身反应及消化道反应参考美国放射治疗协作组(Radiation Therapy Oncology Group,RTOG)急性放射损伤分级标准[13],血液学毒性参考通用不良反应标准(common terminology criteria for adverse events,CTCAE)第五版。放射性肝损伤(radiation-induced liver disease,RILD)的诊断标准:参考Lawrence标准[14],多呈亚急性过程.一般出现在放疗后1~4月。典型RILD:迅速出现的非癌性腹水、肝肿大、碱性磷酸酶上升至正常水平或治疗前水平的2倍以上;非典型RILD:转氨酶上升至正常水平或治疗前水平的5倍以上,伴或不伴腹水、肝肿大。RILD的诊断必须排除肿瘤进展引起的上述症状和体征。
1.4 统计学处理
采用SPSS 25.0 软件进行统计描述和分析。Kaplan-Meier法进行生存分析,Log-rank检验进行单因素分析,COX比例风险模型进行多因素分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料
根据入排标准,研究共入组257例患者,失访55例,有完整随访数据共202例。其中,男性158例,女性44例,中位年龄为57岁(范围28~87岁)。所有病例均经乙肝病史、临床表现、肿瘤标志物、影像学或组织学检查诊断明确[11]。其中,137例患者治疗前合并肝内转移或远处转移。113例患者既往针对肿瘤接受过治疗,这些治疗方式有手术、肝移植、RFA、TACE、碘粒子植入术、全身化疗等。其中,手术切除55例,TACE66例,RFA15例,全身化疗8例,碘粒子植入术4例。其他资料详见表1。

表1 202例原发性肝癌患者基线资料
2.2 随访情况
全组病例随访至2020年1月15日,从放疗开始之日计算生存时间,随访期26.1~165.4个月(中位随访时间77.0个月),随访率78.6%。
2.3 近期疗效
202例原发性肝癌患者治疗结束疗效评价显示:CR 29例(14.4%),PR 40例(19.8%),SD 63例(31.2%),PD 70例(34.6%),总有效率(CR+PR)为34.2%。对70例较小肿瘤(肿瘤最大径之和<5 cm)进行亚组分析,近期疗效CR 23例(32.9%),PR 16例(22.9%),总有效率为55.8%。
2.4 局部控制率
患者6个月和1、2、3年的局部控制率分别为71.1%、50.4%、31.7%和22.0%(图1)。对70例较小肿瘤(肿瘤最大径之和<5 cm)进行亚组分析,其1、2、3、5年局部控制率分别为75.6%、58.1%、44.9%和29.4%。
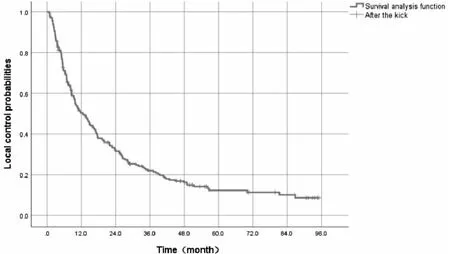
图1 202例原发性肝癌患者局部控制率的生存分析函数
2.5 远期生存
患者的中位生存时间为15.9月(95%CI:12.0~19.8)(图2)。6个月和1、2、3、5年累积生存率分别为76.2%、56.4%、39.6%、30.0%、16.4%。中位无进展生存时间为10.7月(95%CI:7.7~13.7)(图3)。患者的6个月和1、2、3、5年无进展生存率分别为68.6%、48.4%、30.0%、21.3%和12.6%。对70例较小肿瘤(肿瘤最大径之和<5 cm)进行亚组分析,其1、2、3、5年累积生存率分别为87.1%、74.3%、61%和35.9%。
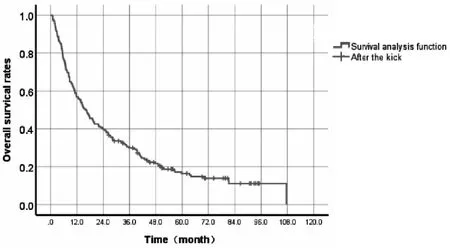
图2 202例原发性肝癌患者总生存率的生存分析函数
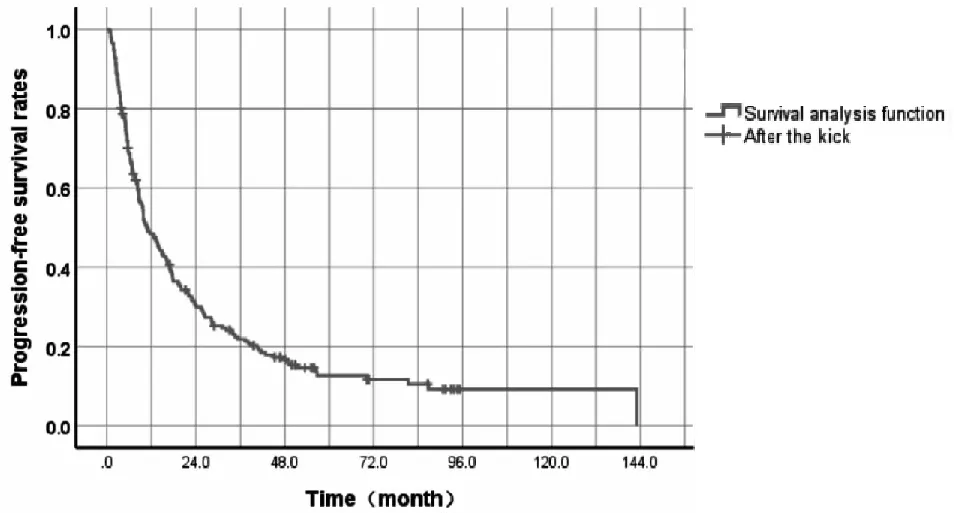
图3 202例原发性肝癌患者无进展生存率的生存分析函数
2.6 影响预后的因素
单因素结果分析显示:入院合并肝癌相关症状(如腹胀、腹痛、腹泻、乏力、消瘦、纳差、腹水、黄疸等),KPS评分,肿瘤部位,病灶个数(P<0.001),肿瘤最大径之和,门静脉癌栓,临床分期,Child-Pugh分级和BCLB分期均与总生存期有关(表2)。入院有相关症状、KPS评分≤80分、肝门肿瘤、病灶个数大于3个、肿瘤最大径之和大于5 cm、合并门静脉癌栓、临床分期III/IV期、Child-Pugh分级B级、BCLB分期C期是影响患者的不良预后因素(表1)。在进一步的多因素分析中,KPS评分、Child-Pugh分级、BCLB分期、病灶个数和肿瘤最大径之和为影响预后的独立因素(表3)。
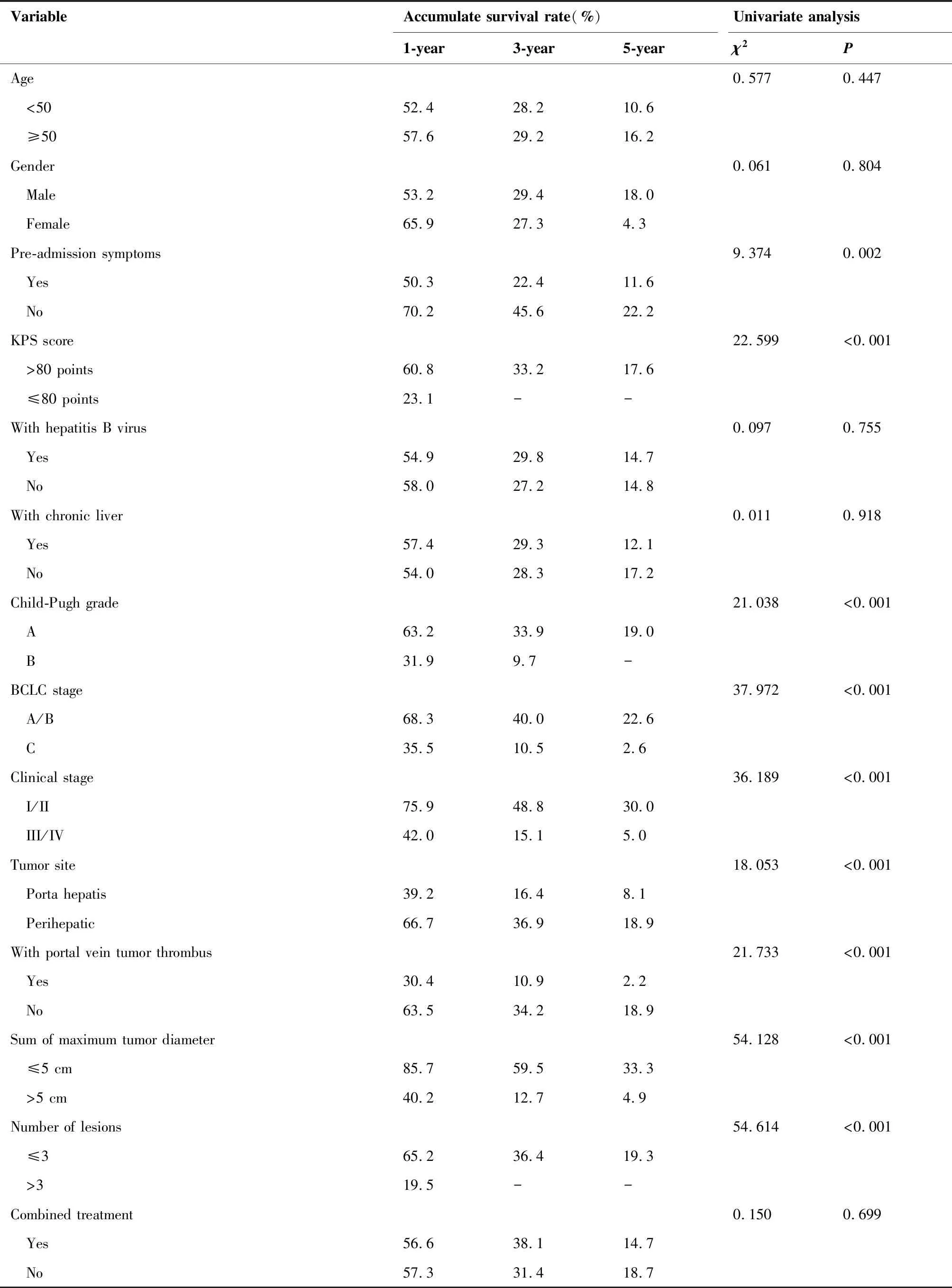
表2 202例原发性肝癌患者预后单因素分析结果

表3 202例原发性肝癌患者预后的多因素分析结果
2.7 不良反应
急性不良反应多为1~2级,其中最常见的为胃肠道反应(56.4%),表现为轻度纳差、恶心、腹胀、腹痛、便秘、腹泻,经对症处理,治疗结束后1周左右均缓解。其次,29例(14.4%)患者治疗后出现轻度乏力。2例(1%)患者出现4级总胆红素升高。此外,32例(15.8%)患者出现3级反应,包括血小板减少,白细胞减少、天冬氨酸转氨酶升高和(或)总胆红素升高(表4)。在治疗后3月内无患者发生RILD。
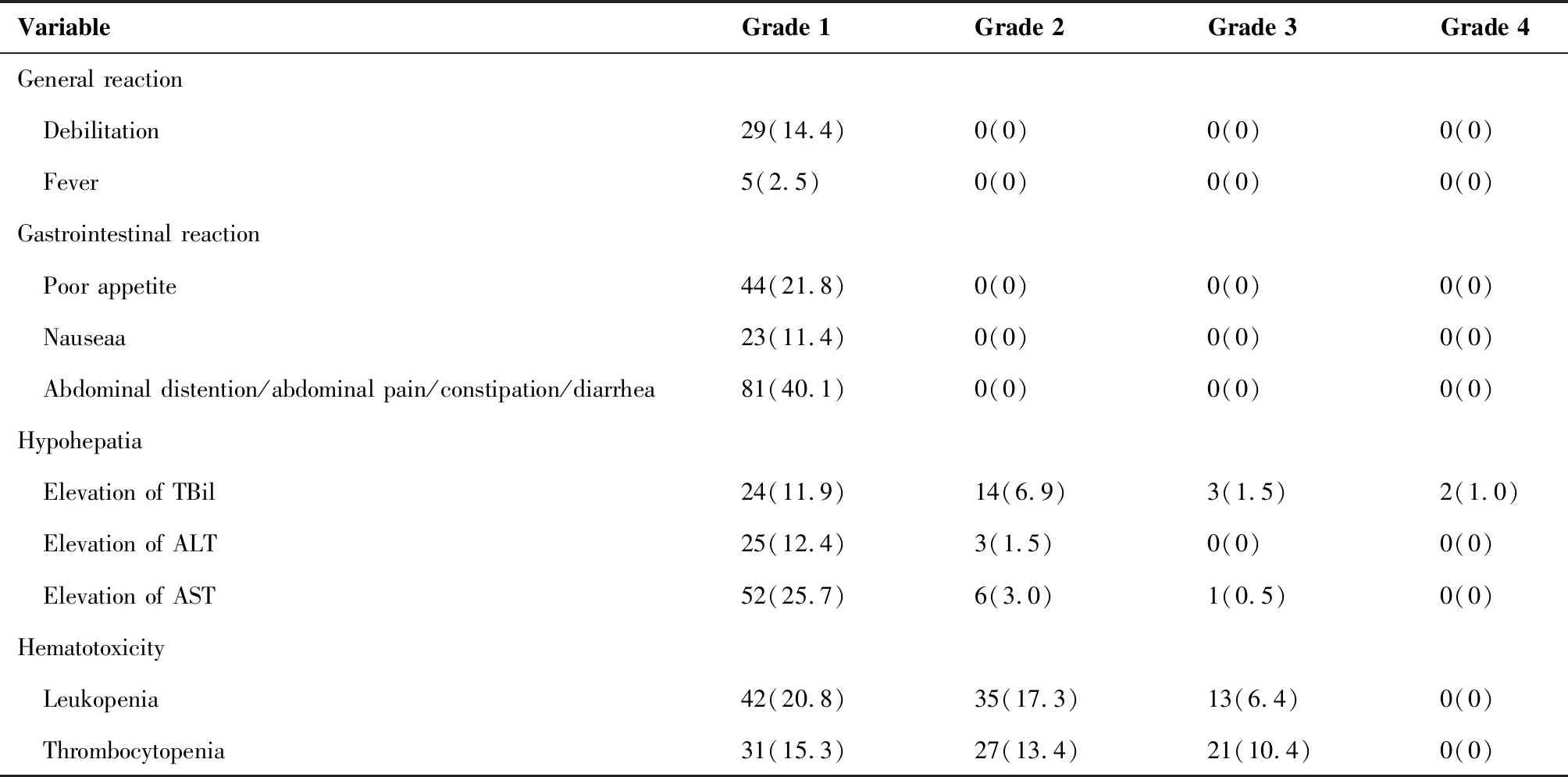
表4 202例原发性肝癌患者治疗的不良反应及比例(例/%)
3 讨 论
NCCN指南和我国卫健委制定的原发肝癌诊疗规范,均将放疗作为病灶不可切除或由于身体状况无法实施手术的肝细胞癌的主要治疗手段之一[15-16]。SBRT通过对靶区病灶实施少分次、高剂量的精准照射,而对周围正常组织损伤较小。既往研究提示,SBRT具有良好的局部控制率、总生存率和较小的不良反应。Rim等[17]对2010年至2018年间发表的32项研究共1 950名患者进行Meta分析。入组的所有患者中,Child-Pugh A级的中位数比例为82.3%(范围为47.9%~100%)。中位肿瘤大小的中位数为3.3 cm(范围为1.6~8.6 cm)。等效生物剂量估算值的中位数为83.3Gy(范围为48.0~114.8 Gy)。研究结果显示,1年、2年和3年总生存率分别为72.6%(95%CI: 65.7~78.6),57.8%(95%CI: 50.9~64.4)和48.3%(95%CI: 40.3~56.5)。1年、2年和3年局部控制率分别为85.7%(95%CI: 80.1~90.0),83.6%(95%CI:77.4~88.3)和83.9%(95%CI:77.6~88.6)。大于5 cm的肿瘤是导致较差的局部控制和总体生存率的重要因素。≥3级的肝和胃肠道并发症发生率分别为4.7%(95%CI:3.4~6.5)和3.9%(95%CI:2.6~5.6)。
体部伽玛刀是立体定向放射治疗的一种方式,采用旋转源聚焦的原理,形成一个围绕焦点的高峰剂量区,具有定位准确、治疗精确、靶区剂量集中、周围正常组织受照射剂量低的特点。体部伽玛刀作为国产立体定放疗设备,具有独特的剂量聚焦优势和完全自主知识产权,但它对原发性肝癌的研究大多在2012年以前,而近期研究大多数为小样本,随访时间较短,且多为回顾性研究。本研究绝大部分病例收治于2012~2017年,中位随访时间达77.0个月,病历资料较完善,且样本量较大,结论可信度较高,可较好反映国产立体定向放疗设备的优势与缺点,对进一步提升国产伽玛刀国际竞争力、促进临床应用规范有重要的意义。
本研究近期疗效评价显示,CR率为14.4%,PR率为19.8%,客观有效率(CR+PR)为34.2%。进一步随访发现,患者放疗后6个月和1、2、3年的局部控制率分别为71.1%、50.4%、31.7%和22.0%。均低于相关报道:客观有效率在60%以上[18-20],1年局控率70%以上[21]。6个月和1、2、3、5年的生存率分别为76.2%、56.4%、39.6%、30.0%和16.4%,与相关报道结论相似[22]。伽玛刀治疗原发性肝癌近期疗效较差,究其原因,可能与本组病例大部分肿瘤较大(肿瘤最大径之和>5 cm,132/202)有关。研究显示,肿瘤细胞的放射抵抗与乏氧具有明显的相关性[23]。肿瘤体积越大,肿瘤组织内对射线不敏感的G0期细胞及乏氧细胞越多,放疗疗效越差。因此,本研究中部分肿瘤尤其是大肝癌放疗后肿瘤消退不明显。其次,目前文献[24]报道,肝癌SBRT剂量分割方式最常见的包括20~30Gy/f×3f、8~10Gy/f×(4~6)f、5~5.5Gy/f×10f。有研究[25]显示,生物有效剂量>100Gy为影响肝癌局部控制率的影响因素。本研究中,患者肿瘤体积大,照射时正常肝组织所受的辐射剂量越高,影响放疗的耐受性导致放疗剂量低。本研究的剂量分割模式为2.8~3.5Gy/f×(10~14f),生物等效剂量50~66Gy,较其他研究更低,因此可能是影响疗效的另一主要原因。因此,本研究进一步分析70例较小肿瘤(肿瘤最大径之和<5 cm)的病例资料发现,近期疗效CR 23例(32.9%),PR 16例(22.9%),总有效率为55.8%,1、2、3、5年累积生存率和局部控制率分别为87.1%、74.3%、61%、35.9%和75.6%、58.1%、44.9%、29.4%,与既往报道[19]结果相似。由此可见,SBRT可能更适用于<5 cm的肝癌患者。因此,伽玛刀在肝癌治疗中适应症的选择非常重要,在小体积肝癌中可能更具优势。而对于大肝癌,既往多为小样本回顾性研究,尚需更大样本的前瞻性随机研究进一步探索其在大肝癌中的治疗价值和具体分割模式。
文献[18,20,26-28]报道,影响原发性肝癌放射治疗预后的因素主要包括体质症状、KPS评分、Child-Pugh分级、肿瘤分期、肿瘤最大径、病灶个数、门静脉癌栓、AFP水平、放疗剂量等。本研究同样对患者的预后因素进行了COX回归分析,结果显示,KPS评分<80分、Child-Pugh B级、BCLC分期 C期、病灶个数>3个是影响原发性肝癌患者立体定向放射治疗生存的独立预后因素,与既往报道的结果类似。
值得注意的是,在肿瘤大小方面,既往研究关注较多的是肿瘤的最大径。原发性肝癌,部分患者在诊断时已发现肝内多个病灶,但目前尚未见肿瘤最大径之和与肝癌预后相关性的研究。虽然病灶个数及肿瘤最大径均是影响生存的独立预后因素,但因肝癌为多灶性疾病,既往研究忽视了对多发小肝癌预后因素的探索。本研究显示,即使单个肿瘤体积较小,但肿瘤最大径之和>5 cm,同样是影响肝癌预后的独立危险因素。该结论使得单发或多发的大/小肝癌有了统一的标准,它可能是更好反映肝癌预后的因素,是本研究另一重要的发现。
本研究中患者的不良反应主要表现为全身反应及胃肠道反应,如乏力、恶心、纳差、腹痛、腹胀、腹泻等,均为1~2级不良反应,所有的不良反应在治疗结束或对症处理后均可缓解。治疗结束3月内无患者发生RILD,说明立体定向放射治疗原发性肝癌的安全性。RILD是SBRT治疗肝癌最严重的毒副作用[29]。研究[30]表明对Child-Pugh分级B级合并肝硬化患者进行SBRT应该谨慎,因此对于肝功能较差的患者制定放疗计划应高度个体化,尽量减少正常肝组织的照射剂量,以减少RILD的发生。放疗中及放疗后应适当给予胃黏膜保护药物,积极防治严重并发症,如消化道大出血、胃十二指肠溃疡等。
但本研究属单中心、回顾性研究,存在选择性偏倚,且未设置对照组,研究结果存在一定的局限性。因此,治疗的最佳适应证、疗效及不良反应等仍有待于多中心、前瞻性、多学科协作来做进一步临床研究。
综上所述,本研究显示,使用体部伽玛刀对原发性肝癌进行SBRT治疗具有较好的肿瘤控制和远期生存,且安全性较好。为了达到更好的治疗疗效,应根据患者的特征,如入院前有无相关症状、患者一般状态、肿瘤部位、病灶个数及大小、肝功能分级等选择适宜人群并采用个体化的放疗方式。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

