进展期胃癌新辅助化疗周期和手术时机的选择*
张树泽,李凡,杨含腾,焦作义
730030 兰州,兰州大学第二医院 普外科
胃癌是全球范围内最常见的一种恶性肿瘤,2018年世界癌症统计数据发现胃癌居世界恶性肿瘤发病率第5位,死亡率第3位[1]。全球大约50%的胃癌病例在中国,2018年中国癌症统计数据发现胃癌居我国恶性肿瘤发病率第3位,死亡率第2位[2]。近年来,随着全世界内镜、病理和放射诊断技术的进步,以及外科手术、放化疗、靶向药物及免疫治疗手段的进展,胃癌患者的生存预后得到明显改善,5年生存率显著提升[3]。我国进展期胃癌(advanced gastric cancer,AGC)占所有胃癌患者的80%以上,这与日韩欧美以早期胃癌为主有明显的差异[4]。目前AGC的治疗为手术为主、放化疗及靶向药物为辅的多学科综合治疗。对于AGC患者,我们应积极寻求多种手段使潜在可切除肿瘤降期,从而提高根治性手术切除率,降低术后复发率和提高患者5年生存率。故对于III期和IVA期的AGC患者,应首先考虑新辅助化疗(neoadjuvant chemotherapy,NAC)[5-7]。近年来,NAC在进展胃癌降期治疗中逐渐发挥着重要作用[8-9]。目前AGC的NAC周期尚不统一,手术时机的选择也各不相同,对AGC患者的新辅助治疗产生了一定的困扰。本文就AGC患者术前NAC周期与手术时机的选择进行回顾,以期帮助医生控制化疗周期,判断手术时机。
1 NAC用于AGC的意义
AGC的定义主要依据肿瘤侵犯胃壁的程度(即T分期),AGC侵犯胃壁的深度≥T2,其淋巴结转移率高达70%。对于III期和IVA期胃癌患者,直接行D2胃癌根治术效果可能欠佳,因为直接手术对微转移灶的根治效果并不理想。而NAC可弥补直接手术的微观缺陷[10-11],NAC主要影响AGC患者的手术根治度、并发症、副作用及临床预后。由于局部晚期胃癌的高T和N分期,直接手术完整彻底切除肿瘤的难度大,难以达到R0根治。T和N分期的程度,严重影响AGC患者的R0根治度及临床预后。NAC主要目的是通过围手术期使用化疗药物使肿瘤体积缩小和区域阳性淋巴结体积缩小或数目减少,从而提高AGC手术根治率,改善AGC患者的临床预后[12-13]。不仅如此,有研究证明NAC使用XELOX方案(卡培他滨+奥沙利铂)对AGC患者新辅助组与直接手术组相比,不仅可提高其R0根治率(91.94%vs66.13%),而且可缩短手术时间(139.27±16.60vs151.86±18.04)min和减少术中失血量(259.74±52.69vs291.31±61)mL;术后观察到胃动素1、多肿瘤抑制蛋白、肾母细胞瘤基因(WTX基因)和10号染色体磷酸及张力同源性缺失基因(PTEN基因)的mRNA表达明显增高,结果显示术前NAC对肿瘤抑制基因的影响比单纯根治术更为显著[14]。近年关于FLOT(氟尿嘧啶、亚叶酸、奥沙利铂、多西他赛)研究中发现NAC可获得较理想的病理完全缓解(pathological complete regression,pCR)率,并显著延长患者的生存期[15-17]。Eom等[18]研究中发现东亚局部AGC患者术前使用多西他赛联合S-1(替吉奥)NAC较直接手术患者可显著延长5年总生存率(73.3%vs51.1%,P=0.005),且对术后并发症无显著影响。围手术期NAC对局部AGC的影响可概括为3点:1)对于潜在可切除的AGC,使其瘤体缩小或区域阳性淋巴结较少或缩小,争取达到R0根治的标准;2)对于可手术切除的AGC,围手术期NAC使其获得更长总生存期和较低的复发率;3)术前NAC对AGC的降期作用可为术中操作降低难度和风险。
2 NAC的演进
MAGIC研究[19]在AGCNAC领域具有里程碑意义,该研究中503例AGC患者随机分为NAC(ECF方案)联合手术组和单纯手术组,ECFNAC方案每3周为1周期:第1天表柔比星50 mg/m2,顺铂60 mg/m2和第1天到第21天持续口服氟尿嘧啶200 mg/m2或卡培他滨1 250 mg/m2。NAC联合手术组接受术前3周期的ECF方案化疗,化疗结束后3~6周AGC患者接受手术治疗。研究结果显表明NAC联合手术组AGC患者5年总生存率显著优于单纯手术组(36%vs23%,HR=0.75;95%CI=0.60~0.93,P=0.009)。此外,NAC联合手术可以显著延长患者的无进展生存期(HR=0.66,95%CI=0.53~0.81,P<0.001),首次证实了NAC对于AGC的确切疗效。
EORTC研究[20]推动了AGC NAC的发展。该研究中144例AGC患者随机分为NAC联合手术组(NAC方案为氟尿嘧啶、亚叶酸和顺铂组)和单纯手术组。化疗方案每48天为1周期:第1、15和29天顺铂50 mg/m2,第1、8、15、22、29和36天左亚叶酸200 mg/m2和氟尿嘧啶2 000 mg/m2。NAC联合手术组接受术前两周期氟尿嘧啶、亚叶酸和顺铂方案的NAC,化疗结束后4周患者接受手术治疗。研究结果发现NAC联合手术组手术R0切除率明显高于单纯手术组(82.0%vs66.7%,P=0.036),术后病理结果提示NAC联合手术组淋巴结转移率显著低于对照组(61.4%vs76.5%,P=0.018),但该研究证并未显示生存获益(HR=0.84,95%CI=0.52~0.89,P=0.446),可能归因于死亡病例数较少导致统计学分析时受限。
FFCD研究[21]进一步推动了局部晚期胃癌NAC的发展。该研究中224例AGC患者随机分为NAC联合手术组(NAC方案为氟尿嘧啶联合顺铂)和单纯手术组。化疗方案每4周为1周期:第1天顺铂100 mg/m2,第1天到第5天氟尿嘧啶800 mg/m2。NAC联合手术组接受术前2周期或者3周期氟尿嘧啶和顺铂方案的NAC,化疗结束后4~6周患者接受手术治疗。研究结果提示NAC联合手术组的5年生存率显著优于单纯手术组(38%vs24%)。JCOG研究[22]中151例AGC患者接受NAC后手术治疗,149例患者直接接受手术治疗。该研究采用替吉奥+顺铂NAC方案:第1天到第21天替吉奥80 mg/m2,第8天顺铂60 mg/m2,每4周为1周期。第2周期化疗结束后14~20天评估AGC的可切除性,符合相关标准的患者在化疗结束后21~34天接受手术治疗。研究结果显示NAC组手术和单纯手术组患者肿瘤深度(pT)、淋巴结转移(pN)和病理分期(pTNM)均存在显着差异(P<0.001),且NAC组R0切除率显著高于单纯手术组(80.6%vs66.6%,P=0.0045)。
FLOT研究[15]中术前4周24小时内静脉注射多西他赛50 mg/m2、奥沙利铂85 mg/m2、静脉注射亚叶酸200 mg/m2和氟尿嘧啶2 600 mg/m2,FLOT组128例患者中20例获得pCR,显著高于ECF组137例患者中8例获得pCR(16%vs6%)。与ECF组相比,FLOT组中位总生存期显著增加(50个月vs35个月,P=0.012)[16]。随着NAC方案的改进与实践,将为更多AGC患者获得良好的预后打下坚实的基础。
虽然MAGIC研究、EORTC研究和FFCD研究奠定了NAC在AGC综合治疗中的里程碑式的地位,但是这些方案仍然存在缺乏精准的临床分期,无法精准评估局部NAC患者等不足之处。目前欧洲肿瘤内科学会仍然推荐ECF方案或者改良ECF方案作为AGC NAC的首选方案。既往研究发现:FLOT方案作为AGC NAC的方法与ECF方案及改良ECF方案相比,存在较高的术后并发症和药物不良反应发生率[23]。虽然这些化疗方案对于推广AGC NAC起到了举足轻重的作用,但是上述AGC方案的研究人群都是欧美患者,基于人群遗传差异,这些NAC方案在我国患者甚至在亚洲患者中的应用及推广可能受到一些限制。通过里程碑式的MAGIC研究、EORTC研究、FFCD研究和FLOT研究,我们发现随着科学技术的探索,NAC方案与时俱进,通过术前使用化疗药物使肿瘤体积缩小和区域阳性淋巴结体积缩小或数目减少,从而提高AGC手术根治率,显著延长患者的无进展生存期和总生存期,明显改善AGC患者的临床预后。虽然通过以往研究发现NAC让更多AGC患者获益,但是我们外科医生如何控制NAC周期,选择合适手术时机显得非常重要。
3 NAC与手术
3.1 化疗周期
MAGIC研究NAC周期选择3个周期,而FFCD研究NAC周期选择4个周期。不同研究纳入化疗周期亦不相同,将不同研究的化疗周期归纳见表1。NAC的周期选择主要取决不同NAC化疗方案对AGC疗效。对疗效的评价主要包括影像学评估、肿瘤标记物检测、症状、体征及体重[24]。AGC需要超声内镜和CT、MRI和PET等放射诊断技术来明确临床分期[25]。Yardimci等[26]研究中证明PET-CT能较为可靠的检测出对NAC无应答的患者,以便及时手术和调整NAC方案。多层螺旋CT根据影像学特征采用线性判别分析,对T期、N期和肿瘤分级的判别能力分别为90.4%、81.6%和64.5%,可用于NAC前后术前评估[27]。Schneider等[28]研究表明可利用CT容量分析的减容率值的高低可靠地判断AGC对NAC的反应程度。NCCN指南推荐必要时可行腹腔镜探查和腹腔脱落细胞学等有创检查明确AGC有无腹膜转移[29],从而减少患者接受不必要的开腹探查。超声内镜和CT常用来评估局部晚期胃癌NAC的疗效与反应程度,肿瘤标志物、临床表现和体力评分也可用来评估其疗效。NAC1-2周期后使用影像学手段评估化疗药物对AGC的疗效,以便医生可以随时调整治疗方案,判断和选择合适的NAC周期。如果NAC无效者应提前中止化疗然后进行手术治疗,有效者依据临床分期和不良反应综合判断和选择合适的NAC周期,如果条件允许应在病变完全缓解状态下进行手术,也就是NAC周期可以适当延长[24]。AGC NAC的周期选择应考虑化疗方案、疗效、不良反应和药物疗效等多种因素。不同的化疗方案产生的不良反应和药物疗效也不同,这些因素都决定NAC周期的选择,进而影响患者的治疗效果和临床结局。
但对于特殊病理类型的AGC,如胃印戒细胞癌,是否应行NAC或是NAC的周期如何判定仍有待考量。Li等[30]对144进展期胃印戒细胞癌(cT3/4和cN0-3)研究中,36例接受了NAC,108例在确诊后立即手术根治。经倾向性评分匹配调整后,共产生36对患者,两组患者的年龄、性别、肿瘤部位、cTNM分期等基本特征相似。直接手术优先组和NAC组R0切除率分别为88.9%和86.1%(P=1.000),术后5年总生存率分别为64.7%和50%(P=0.192)。不管从R0切除率还是术后5年总生存率而言,NAC对胃印戒细胞癌患者益处并不显著。法国ESO胃肿瘤工作组公布了一项法国全国回顾性调查研究的结果,其中包括1997年至2010年924例局部进展期胃印戒细胞癌患者,其中18.5%的患者接受了NAC治疗。研究发现,NAC对胃印戒细胞癌患者无生存益处,且NAC组与手术优先组的R0肿瘤切除率相似。此外,在pT、pN、平均淋巴结数目、平均浸润淋巴结数目和病理性肿瘤淋巴结转移(pTNM)分期上均无显著性差异[31]。由此可见,对于进展期期胃印戒细胞癌术前NAC并未提高潜在可切除AGC的R0根治率和改善其临床预后。对于特殊病理类型的印戒细胞癌我们应首先考虑手术治疗,而不能盲目对进展期印戒细胞癌患者进行NAC周期的划分和定义。AGC NAC周期的选择因人而异,根据临床具体情况选择适合AGC患者的NAC周期。
3.2 手术时机
NAC的效果与手术时机的权衡,尚无统一标准。在中国人民解放军总医院开展的一项研究中,176例AGC患者接受SOX(替吉奥+奥沙利铂)方案(第1天到第14天替吉奥80 mg/m2,第1天奥沙利铂130 mg/m2,每3周为1周期),9例患者接受XELOX方案(第1天到第14天卡培他滨1 000 mg/m2,第1天奥沙利铂130 mg/m2,每3周为1周期)。2周期后使用超声胃镜和CT评估疗效,如果发现肿瘤增大或者消失立即选择手术治疗,肿瘤缩小则继续NAC 1~2周期[32]。将手术时机分为接受NAC后到手术治疗间隔<4周、4~6周和>6周三个时间段。该研究结果发现AGC NAC后手术时机与术后pCR有关,然而与总生存率无关,NAC后间隔>6周进行手术治疗的患者获得pCR的比率高于<4周和4~6周的患者。NAC与手术间隔时间对卵巢癌患者的影响与上述观点基本一致[33]。Kumazu等[34]对801例胃癌患者从确诊到手术的时间间隔分为≤31天组,32~44天组、43~62天组和≥63天组,其研究结果证明胃癌患者手术等待时间(100天以内)与生存率无显著负相关。上述研究表明术前NAC与手术间隔时间在一定时间范围内,与OS相关性并不显著,而与pCR有一定相关性。根据以往国内外开展NAC研究的经验,我们课题组设计了一项观察性研究,予对照组AGC患者FLOT方案:多西他赛(60 mg/m2),奥沙利铂(85 mg/m2),亚叶酸(200 mg/m2),和5-氟尿嘧啶(2 600 mg/m2),2周为1个周期,使用2~4个化疗周期,NAC结束后3~6周后选择手术。共有47例AGC患者接受NAC后手术,其余患者直接手术治疗,研究结果发现:NAC组的3年生存率显著高于直接手术组[17]。本研究NAC后手术时机的选择主要依据两个方面:1)NAC结束后3~6周患者各器官功能功能状态基本恢复良好,无明显骨髓抑制;2)此时间段内术前影像学表现化疗药效果较明显。对于AGC患者,临床医生应该选择合适的化疗方案,控制化疗周期,判断手术时机,为患者的健康保健护航。
4 总 结
随着胃癌多学科综合治疗模式的开展,NAC联合D2胃癌根治术逐渐成为AGC的主要治疗方式。根据以往相关研究局部晚期胃癌NAC的化疗周期常规为2~4周期,如果在化疗过程中患者出现难以耐受的不良反应,或者NAC评估无效者应提前中止术前NAC,选择手术根治。有效者继续完成1~2周期NAC然后进行D2胃癌根治术。手术时机一般选择NAC结束后3~6周(表1)。因人制宜和因时制宜地选择合适的NAC方案对于AGC患者影响显著,局部晚期胃癌NAC周期和手术时机的选择需要继续探索研究,旨在实现AGC个体化和精准化治疗,延长患者生存时间,提高患者生活质量。
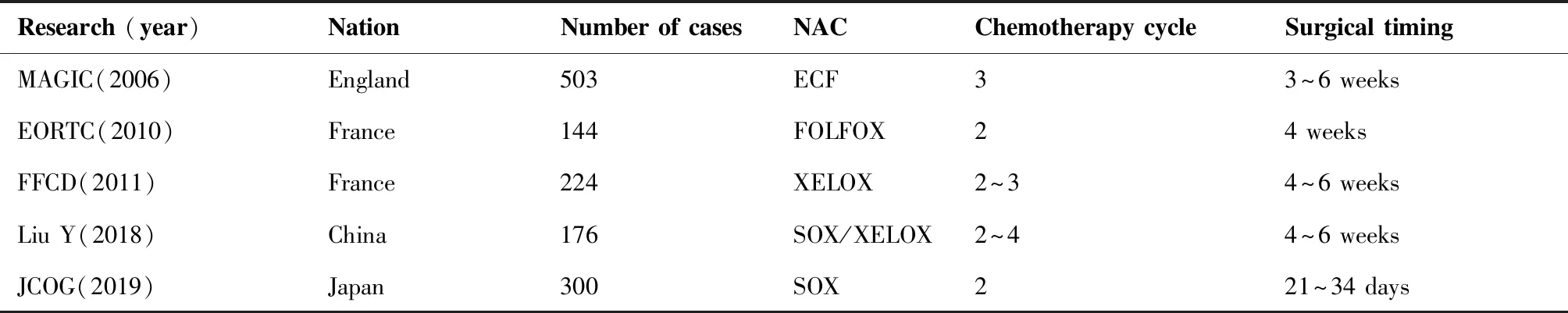
表1 AGC NAC周期和手术时机的相关研究
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

