下咽鳞癌免疫细胞的分布特征及其对非手术患者预后的影响*
黄仁超,张世文,金从国,周博,赵留芳,王浩,邱有玉,张露,董子辰
650118昆明,昆明医科大学第三附属医院 头颈外一科[黄仁超(现工作单位:661000 云南 红河,红河州第三人民医院 甲状腺外科)、张世文、赵留芳、王浩、邱有玉、张露,董子辰] ,肿瘤研究所(金从国); 661000 云南 红河,红河州第三人民医院 甲状腺外科(周博)
下咽鳞状细胞癌是头颈鳞癌中预后最差的恶性肿瘤之一[1],约占头颈部恶性肿瘤的3%~5%[2],占全身恶性肿瘤的0.5%[3]。由于下咽鳞癌病灶位置隐蔽,淋巴结转移率高,疾病进展快,尽管包括手术、放疗和化疗在内的多模式治疗取得了一定进展,但5年生存率仅为20%~35%[4]。既往研究发现,下咽鳞癌常常伴有不同程度的免疫抑制,随着病情的进展,细胞免疫和体液免疫功能均有所下降[5]。细胞免疫是机体抗肿瘤免疫的主力军[6],淋巴细胞和自然杀伤(natural killer,NK)细胞是机体细胞免疫的重要组成部分[7]。机体免疫缺陷常表现为T淋巴细胞水平下降。CD3+代表T细胞总数、CD4+代表辅助性T淋巴(helper T,Th)细胞、CD8代表抑制性T淋巴(suppressor T,Ts)细胞或细胞毒性T淋巴 (cytotoxic T,Tc)细胞[8],它们在免疫监视、免疫调节及杀伤靶细胞方面具有重要作用。正常情况下,T细胞及亚群的数目处于相对平衡状态,免疫功能稳定。若T细胞总数或者CD4+/CD8+T细胞比值发生异常,即可视为免疫调节紊乱,机体免疫功能低下或受抑制,易造成肿瘤的发生和进展[9]。本文通过研究下咽鳞癌患者治疗前机体免疫细胞的分布特征,并对不同免疫状态的患者进行生存分析,旨在探讨下咽鳞癌患者机体免疫细胞的分布特征及对预后的影响。
1 资料与方法
1.1 研究对象
选取2009年11月至2019年10月昆明医科大学第三附属医院收治的650例下咽鳞癌患者为研究对象,纳入标准:1)原发于下咽的恶性肿瘤;2)经病理证实为鳞状细胞癌;3)患者均为首次发病,入院前未经治疗;4)无其他肿瘤病史;5)影像学资料证实无其他部位原发恶性肿瘤。排除标准:1)临床资料记录不完整;2)患免疫相关疾病者。另选择此期间内来昆明医科大学第三附属医院接受体检的健康者作为对照组, 均无免疫相关疾病。该研究通过了昆明医科大学第三附属医院伦理委员会的医学伦理审查(伦理编号:QT201905)。
1.2 临床指标
采集下咽鳞癌患者的治疗方式和治疗前后的免疫指标[包括T淋巴细胞数(CD3 +T细胞、CD4 +T细胞、CD8 +T细胞)、NK细胞数和细胞因子诱导的杀伤(cytokine-induced killer,CIK)细胞数及病理检查结果等资料。另选择健康者的T淋巴细胞数作为对照组。
1.3 实验仪器、试剂及检测方法
1.3.1 实验仪器与实验试剂 CS-3000PLUS血细胞分离机购自百特公司,Forma311二氧化碳孵箱,Forma205生物安全柜,Gibco无血清培养基(AMV),Beckman Coulter EPICS XL流式细胞仪均购自IMMUNOTECH公司。流式检测试剂CD326(EpCAM)-PE购自BD公司,CD45-FITC/CD4-RD1/CD8-ECD/CD3-PC5、CD3-FITC/CD16+56-PE、CD45-PC5均购自BECKMAN COULTER公司,CK18-FITC购自ABCAM公司。
1.3.2 检测方法 下咽鳞癌患者的采血时间点为治疗开始前第1天和治疗结束后第1天。1)临床标本采集:抽取清晨空腹静脉血1 mL,肝素抗凝,充分混匀,避免振荡;2) T细胞亚群检测:取试管加入10 μL CD45-FITC/CD4-RD1/CD8-ECD/CD3-PC5,加入肝素抗凝的全血100 μL,摇匀后避光室温静置30 min。加入NH4CL溶血素2 mL溶血,15 min后上机检测,CD45+CD3+细胞为CD3细胞、CD45+CD3+CD4+细胞为CD4细胞、CD45+CD3+CD8+细胞为CD8细胞;3) NK及CIK细胞检测:取试管加入20 μL CD45-PC5、CD3-FITC/CD16+56-PE,加入肝素抗凝的全血100 μL,摇匀后避光室温静置30 min,加入NH4Cl溶血素2 mL溶血,15 min后上机检测,CD45 +CD3-CD16 +56 +细胞为NK细胞,CD45 +CD3 +CD16 +56 +为CIK细胞。
1.4 肿瘤患者免疫细胞特征分类
Jin等[10]通过对12 000例肿瘤患者进行大数据分析,把免疫细胞检测结果分为5类,即第I类(免疫耐受型):CD3、CD4、CD8、CD4/CD8比值、NK、CIK均在正常范围内;第II类(免疫低下型):CD3、CD4、CD8下降,CD4/CD8正常,NK升高,CIK正常;第III类(肿瘤反应型):CD3正常,CD4明显下降,CD8明显升高,CD4/CD8明显下降,NK和CIK正常;第IV类(免疫消耗型):CD3、CD4正常,CD8明显下降,CD4/CD8明显升高,NK、CIK正常;第V类(免疫亢进型):CD3升高,CD4正常,CD8明显升高,CD4/CD8明显降低,NK下降,CIK正常。
1.5 随访情况
采用电话进行随访,末次随访日期为2019年10月26日,总生存时间(overall survival,OS)指从首次确诊时间至患者死亡时间或最后一次有效随访时间,失访患者按死亡处理, 并以最后一次有效随访时间计入。
1.6 统计学处理
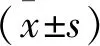
2 结 果
2.1 一般资料
共纳入650例下咽鳞癌患者为研究对象。其中男性624例(96%),女性26例(4%),年龄40~87岁,中位年龄58岁。肿瘤临床分期采用国际抗癌联盟2010年第七版的肿瘤临床分期标准:I期26例(4%),II期26例(4%),III期39例(6%),IV期559例(86%)。对照组共纳入650例,其中男性533例(82%),女性117例(18%),年龄38~79岁,中位年龄52岁。治疗上采用化疗者286例(44%),采用放化疗者364例(56%)。
2.2 下咽鳞癌组和正常组免疫细胞比较
与对照组相比,下咽鳞癌组CD3 +T细胞、CD4 +T细胞、CD4+/CD8+比值、NK细胞、CIK细胞数显著降低,CD8+T细胞显著升高,差异有统计学意义(P<0.05)(表1)。
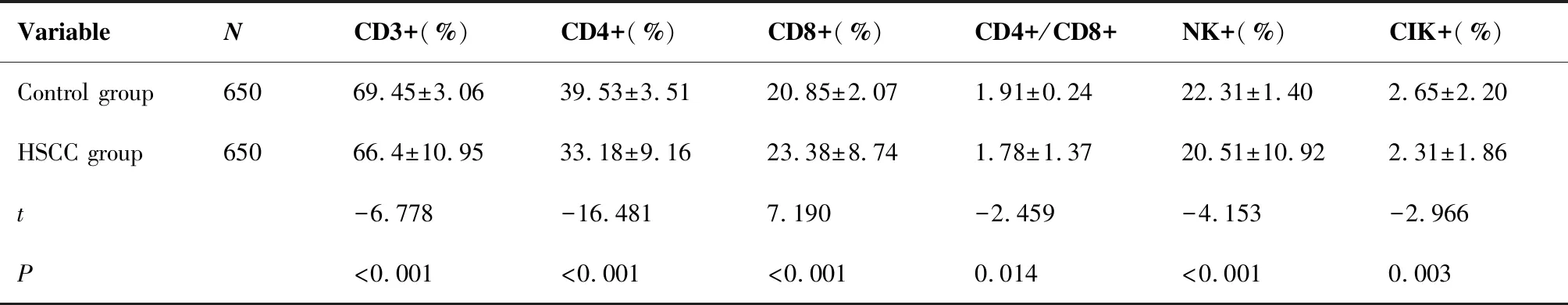
表1 下咽鳞癌组和正常组免疫细胞比较
2.3 下咽鳞癌患者治疗前机体免疫细胞的分布特征
650例下咽鳞癌患者治疗前免疫细胞的分布特征可分为5种类型,第I类占34%(221/650);第II类和第III类分别占22%(143/650)和26%(169/650);第IV类和第V类分别占10%(65/650)和8%(52/650)(表2)。由表2可见,下咽癌的免疫细胞有5种类型,第I类免疫细胞是正常的,第II~V类的免疫细胞是紊乱的,与第I类相比,差异有统计学意义。
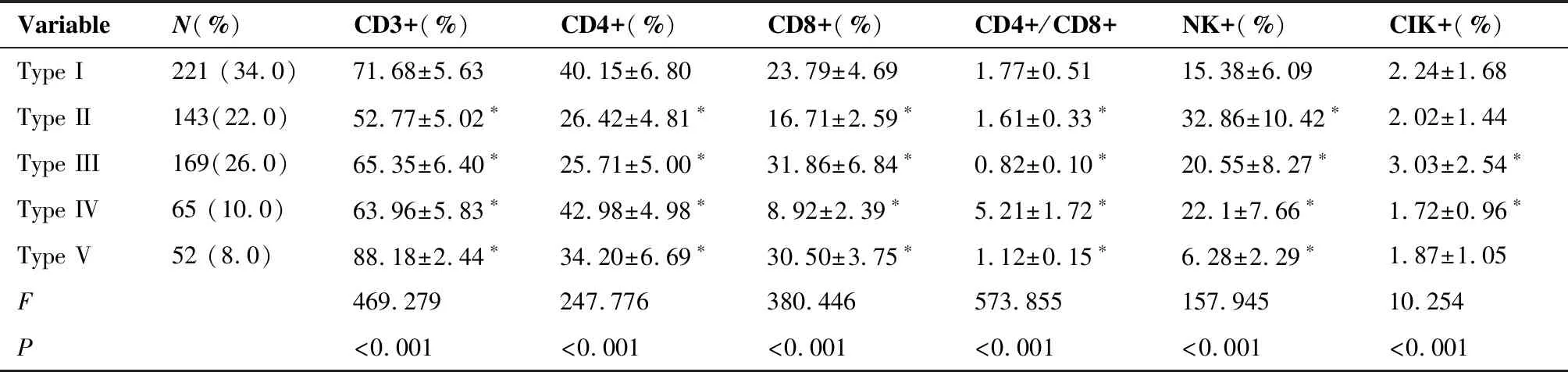
表2 下咽鳞癌患者治疗前机体外周血免疫细胞的分布特征
2.4 不同治疗方式对下咽鳞癌患者治疗前后免疫细胞分布的影响
接受化疗的286例患者中,免疫细胞特征分布为第I类的患者(65例)化疗后CD3+T细胞显著降低; 第II类 患者(78例)化疗后CD3+T细胞显著降低,CD4+/CD8+比值显著升高 ; 第III类 患者(65例)化疗后CD3+T细胞显著升高; 第IV类 患者(39例)化疗后CD3+T细胞、CD4+/CD8+比值显著降低; 第V类(39例) 患者化疗后CD3+T细胞显著降低(P<0.05);接受放化疗的364例患者中,免疫细胞特征分布为第I类的患者(156例)放化疗后CD3+T细胞、CD4+/CD8+比值显著降低; 第II类患者(65例)放化疗后CD3 +T细胞、CD4 +/CD8+比值显著降低;第III类患者(104例)放化疗后CD4+/CD8+比值显著升高; 第IV类患者(26例)放化疗后CD3+T细胞、CD4+/CD8+比值显著降低;第V类患者(13例)放化疗后CD3+T细胞显著降低、CD4+/CD8+比值显著升高(表3)。
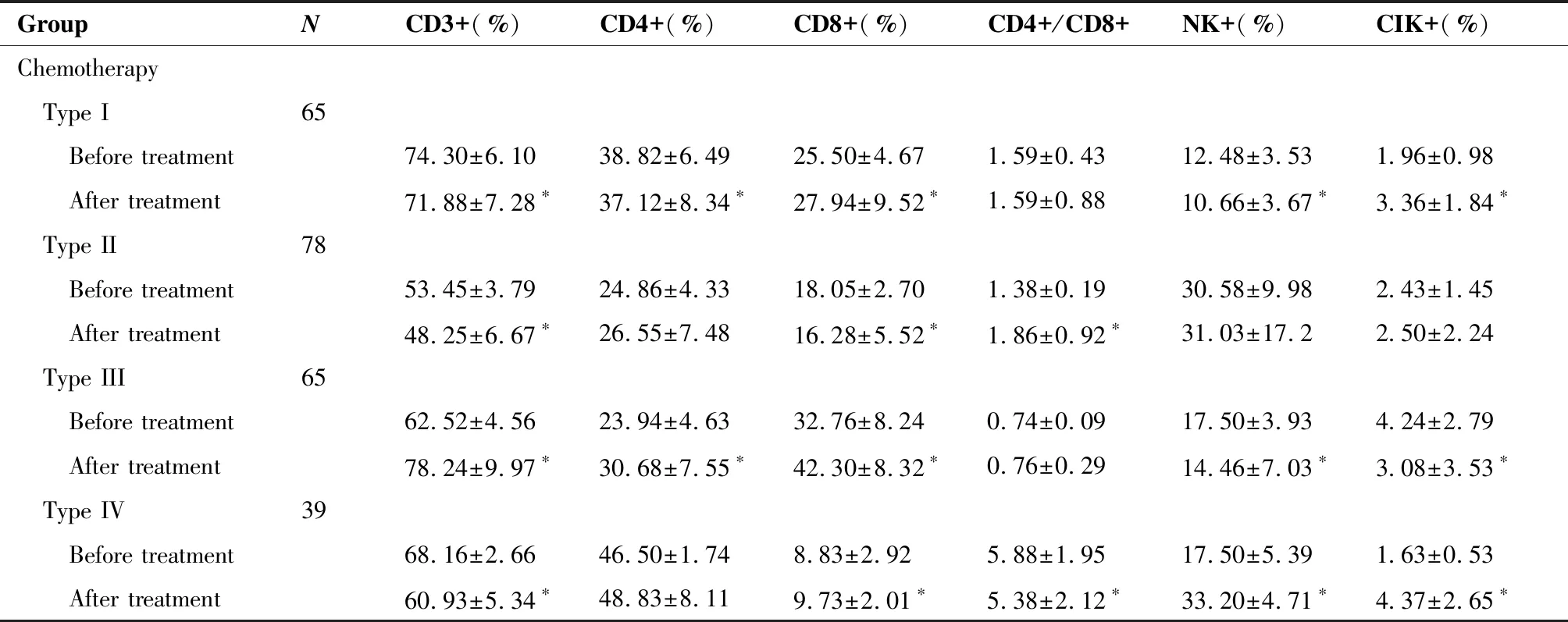
表3 不同治疗方式对下咽鳞癌患者治疗前后免疫细胞分布的影响
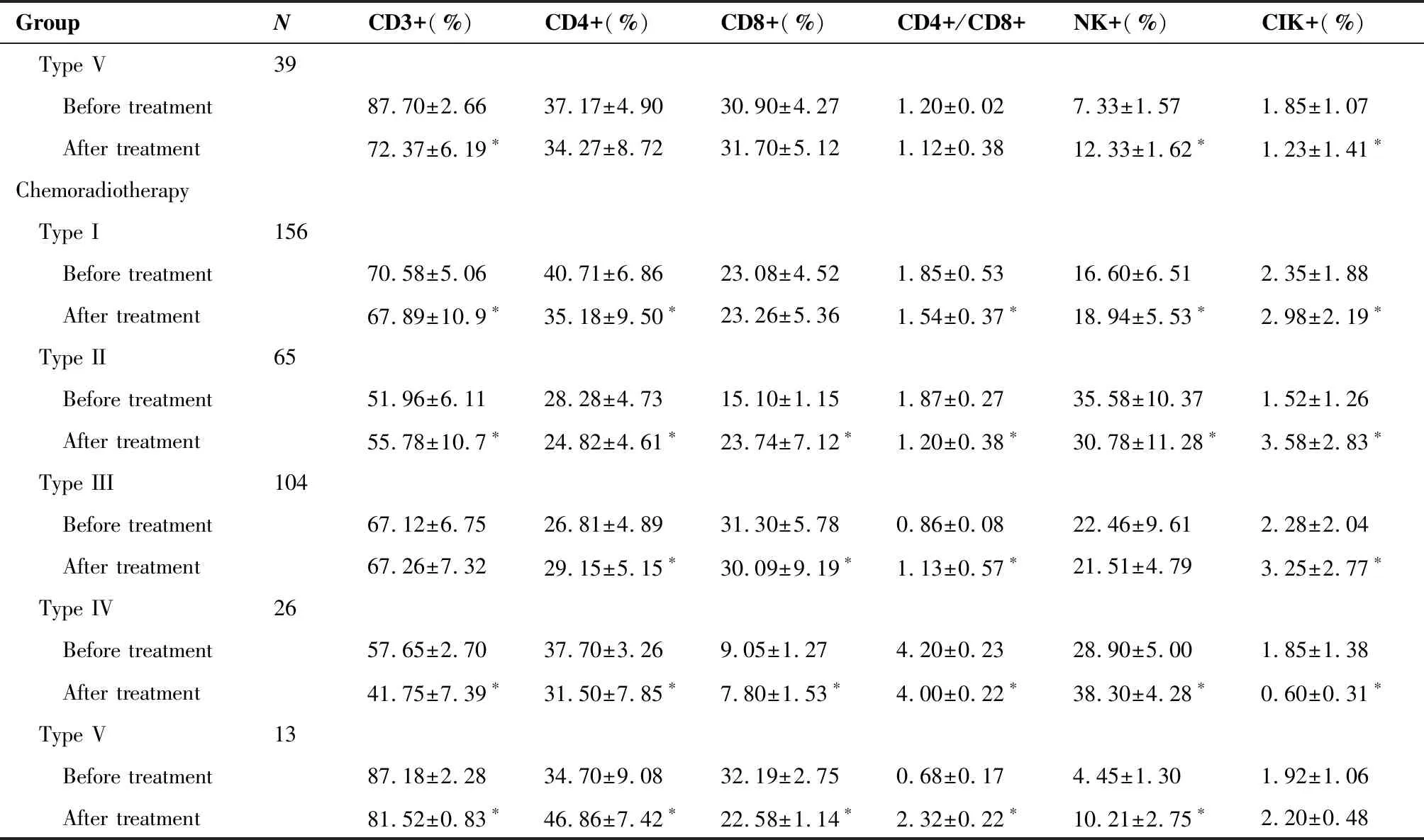
(Table 3 continues on next page)
2.5 不同免疫状态的下咽鳞癌患者生存分析
免疫细胞特征分布为第I~V类的650例下咽鳞癌患者的12月、24月和36月的总生存率(overall survival rate,OSR)分别为71.00%、49.00%、91.70%、78.00%、74.80%和22.80%、14.30%、66.10%、57.00%、44.90%和10.60%、0、37.20%、28.60%、14.30%,相互间比较差异均有统计学意义(P<0.001)(表4)。
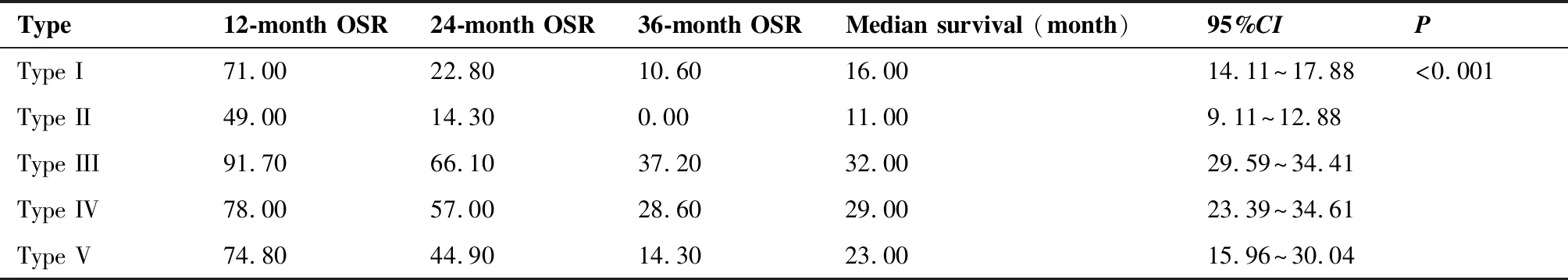
表4 下咽鳞癌患者在不同免疫状态下的总生存率
单纯化疗组和放化疗组12月、24月和36月的OSR分别为62.1%、33.4%、13.3%和81.1%、41.7%、22.5%,差异有统计学意义(表5)。

表5 治疗方式对下咽鳞癌患者生存期的影响
单纯化疗组中免疫细胞特征分布为第I~V类的286例下咽鳞癌患者的中位生存期分别为9个月、10个月、32个月、22个月、23个月,差异有统计学意义(表6)。

表6 不同免疫状态下单纯化疗对下咽鳞癌患者生存期的影响
放化疗组中免疫细胞特征分布为第I~V类的364例下咽鳞癌患者的中位生存期分别为16个月、11个月、32个月、29个月、23个月,差异有统计学意义(表7)。

表7 不同免疫状态下放化疗对下咽鳞癌患者生存期的影响
各组患者生存曲线图见图1~4。
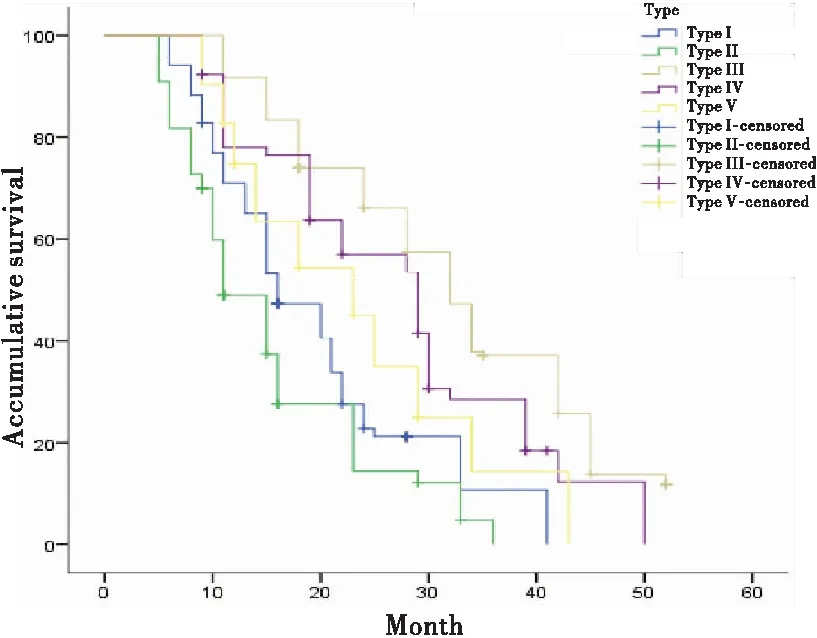
图1 免疫细胞分类对下咽鳞癌患者生存期的影响
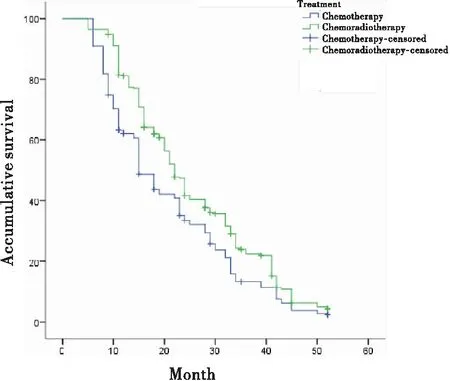
图2 治疗方式对下咽鳞癌患者生存期的影响
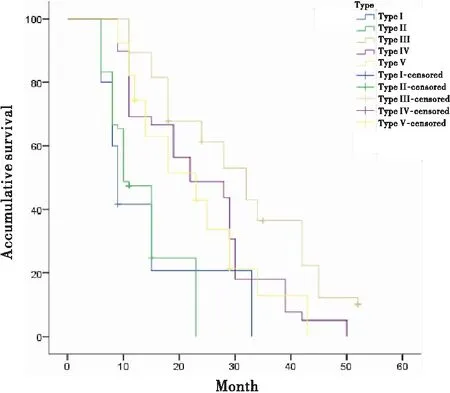
图3 不同免疫状态下单纯化疗对下咽鳞癌患者生存期的影响
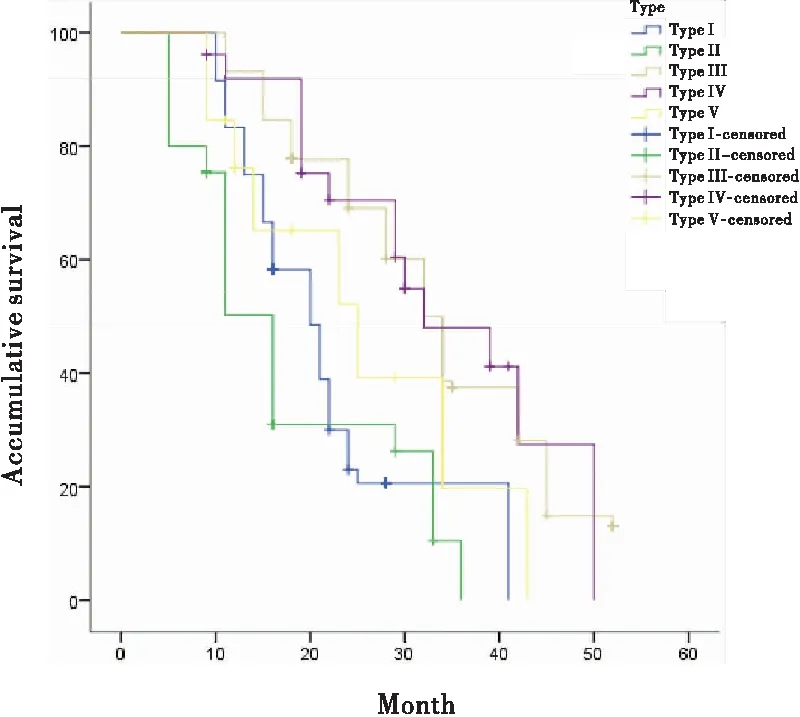
图4 不同免疫状态下放化疗对下咽鳞癌患者生存期的影响
3 讨 论
免疫功能的改变常与肿瘤形成相关,大量的动物模型证据支持自身免疫异常可能促进肿瘤生长的观点[11]。相关研究证明,下咽鳞癌患者机体内免疫功能明显下降, Th细胞减少,Ts细胞增多, 机体出现免疫抑制[12]。以细胞免疫为主的肿瘤免疫是导致肿瘤发生免疫逃避以及免疫抑制的主要原因[13-14]。细胞免疫以T淋巴细胞介导的特异性免疫最为关键[7]。外周血T 细胞亚群活性变化情况能够较好地反映患者机体细胞免疫功能状态[15],免疫功能状态越差的患者生存情况越差[16]。我们的研究发现,下咽鳞癌患者机体内存在细胞免疫功能紊乱,这可能是促进肿瘤发生发展的原因之一。
Jin等[10]通过对12 000例肿瘤患者进行大数据分析,把免疫细胞检测结果分为5类,其中第I类为免疫耐受型,免疫细胞值均在正常范围内,免疫细胞中的效应细胞对肿瘤无反应性;第II类为免疫功能低下型,主要表现为患者CD3+T细胞总数降低,机体体质差,免疫力低下;第III类为肿瘤反应型,主要表现为CD4+/CD8+比值降低,此类型降低肿瘤负荷可使免疫细胞水平恢复正常;第IV类为机体反应不足,效应细胞耗竭型,主要表现为CD4+/CD8+比值升高,CD8+效应细胞消耗过快,机体反应性差;第V类为免疫细胞亢进型。主要表现为CD3+T细胞总数升高,体液免疫亢进,机体反应性好,肿瘤反应性差。这一分类方法在肺癌免疫细胞的分类中已得到了应用[10]。
Das等[17]的研究表明,CD3+总T细胞、CD4+/CD8+比值可以较好地反映免疫调节的平衡性,且CD4+/CD8+比值降低提示患者的免疫功能降低而增加恶性肿瘤发生的机会。我们的研究发现,免疫细胞特征分布为第III类的下咽鳞癌患者单纯化疗后CD3+T细胞显著升高,放化疗后CD4+/CD8+比值显著升高,无论是单纯化疗还是放化疗,免疫细胞特征分布为第III类的患者治疗后免疫细胞的改善均较为显著。越来越多的证据表明,在宿主免疫系统和化疗之间存在着一种复杂的相互作用。通常情况下,化疗药物引起恶性肿瘤细胞死亡后,肿瘤细胞抗原会进入宿主免疫系统,导致T细胞介导的肿瘤特异性免疫应答[18]。传统理论一直认为放疗是通过损伤肿瘤的DNA而杀灭肿瘤细胞,然而后期研究表明, 放疗可以通过影响特定的免疫调节机制来发挥抗肿瘤作用[19]。我们的研究同时发现,无论是单纯化疗还是放化疗,均是免疫细胞特征分布为第III类的下咽鳞癌患者中位生存期最长,预后最好,我们考虑可能与免疫细胞分布为第III类的患者治疗后免疫细胞改善均较为显著有关。本研究表明,纠正患者机体免疫缺陷,激活特异性抗肿瘤免疫反应,或许可以达到抑制肿瘤细胞生长或消灭肿瘤细胞的治疗目的,我们的研究更好地描述了下咽鳞癌的免疫缺陷情况及其与生存期的相关性,将有助于未来更加合理地设计下咽鳞癌的免疫治疗方法。
目前,尽管下咽鳞癌的化疗、放疗和重建手术等治疗方式有了进步,但总体预后较差[1]。肿瘤免疫治疗为这些患者提供了新的治疗选择和改善预后的希望[20]。Jin等[10]的研究指出,针对免疫细胞的5种紊乱类型,均有不同的免疫调节方案。我们的研究发现不同免疫状态的下咽鳞癌患者其预后不同,后期我们将针对下咽鳞癌免疫细胞的5种紊乱类型,进行不同免疫调节方案的前瞻性研究,希望配合手术和放化疗能改善下咽鳞癌的生存情况。
作者声明:本文全部作者对于研究和撰写的论文出现的不端行为承担相应责任;并承诺论文中涉及的原始图片、数据资料等已按照有关规定保存,可接受核查。
学术不端:本文在初审、返修及出版前均通过中国知网(CNKI)科技期刊学术不端文献检测系统的学术不端检测。
同行评议:经同行专家双盲外审,达到刊发要求。
利益冲突:所有作者均声明不存在利益冲突。
文章版权:本文出版前已与全体作者签署了论文授权书等协议。

