高黏附罗伊氏乳杆菌的筛选及其益生特性评价
刘 佳,卜子晨,费 苏,夏永军,艾连中,王光强
上海理工大学医疗器械与食品学院 上海食品微生物工程技术研究中心,上海 200093
罗伊氏乳杆菌(Lactobacillusreuteri)是专性异型发酵乳酸杆菌,天然存在于所有脊椎动物和哺乳动物肠道内。其对肠黏膜具有很强的黏附能力,具有抑制病原菌,调节肠道菌群,增强宿主机体免疫功能等诸多优良益生功能,对宿主肠道上皮组织再生和修复具有重要意义[1-5]。大量研究表明,益生菌发挥益生功效的关键在于其能够黏附于宿主肠道粘膜细胞表面[6]。因此,筛选黏附力强的菌株,对其在宿主体内的有效定植具有重要意义[7-8]。研究结果表明,可通过测定乳酸菌细胞表面理化性质指标(例如疏水性、自聚集能力和表面电荷量等)来反映其黏附能力的强弱[9]。VADILLO-RODRGUEZ V等[10]研究发现嗜酸乳杆菌(Lactobacillusacidophilus)ATCC4356和干酪乳杆菌(Lactobacilluscasei)ATCC393的疏水性和黏附能力之间具有相关性。但不同菌株之间存在较大差异,黏附能力强弱与细胞表面理化性质之间的相关性也存在很大差别。
目前评价乳酸菌黏附能力的模型当中,使用最为广泛的是体外细胞黏附模型。采用体外细胞模型来模拟人体肠道上皮细胞,常用的有CaCo-2、HT-29和IPEC-J2等[11-14]。HUANG 等[15]研究发现嗜酸乳杆菌MJLA1和乳酸杆菌BDBB2对C2BBe1的黏附能力与对Caco-2的黏附能力相似。薛超辉等[16]研究发现,所考察的5株益生菌可以竞争、排除和取代三种方式抑制肠道致病菌粘附HT-29。其中副干酪乳杆菌(Lactobacillusparacasei)M7的抑制效果最好,对3株致病菌的竞争性抑制粘附抑制率分别为93%、83%和87%。研究表明,通过菌株自身的凝聚力、细胞表面的疏水性以及与大肠杆菌的共聚性等指标,能够初筛出具有良好黏附性的菌株。因此,本文选择常用的HT-29细胞评估模型,测定了罗伊氏乳杆菌的自聚能力、表面疏水性、与大肠杆菌的共聚性及对HT-29细胞黏附能力等指标,并进一步分析了这4个指标之间的相关性,以筛选出黏附能力较强的罗伊氏乳杆菌。
1 材料与方法
1.1 材料
1.1.1菌株
使用菌株为28株罗伊氏乳杆菌,编号为R1~R28,均通过小鼠粪便筛选获得。
1.1.2试剂
甲醇、二甲苯均为国产分析纯试剂;培养液胎牛血清、RPMI1640培养液、胰蛋白酶均购自GIBCO公司(纽约,美国);二甲亚砜(Sigma,美国);细胞孔板及细胞爬片购自耐思生物科技有限公司(无锡,中国);革兰氏染色试剂盒购自国药(北京,中国);HT-29细胞(上海兰茉生物医药科技有限公司,上海)。
1.1.3培养基及缓冲液
固体MRS培养基和液体MRS培养基的配制参见文献[12]。
PBS缓冲溶液:NaCl 8 g,Na2HPO41.56 g,KCl 0.2 g,KH2PO40.2 g,去离子水定容至1 000 mL,调pH至7.4,115 ℃灭菌20 min。
D-Hanks缓冲液:氯化钾0.40 g、氯化钠8.00 g、磷酸二氢钾0.06 g、碳酸氢钠0.35 g、十二水磷酸氢二钠0.08 g,添加去离子水溶解并定容1 000 mL,调节溶液pH至7.2,灭菌条件:121 ℃灭菌15 min。灭菌后存放于细胞操作室。
1.2 仪器与设备
pH计(赛多利斯科学仪器(北京)有限公司,北京);紫外分光光度计(上海美谱达仪器有限公司,上海);超低温冰箱(Thermo Scientific,美国);二氧化碳细胞培养箱(Memmert,德国);Bioscreen C全自动生长曲线分析仪(Oy Growth Curves Ab公司,芬兰)。
1.3 方法
1.3.1乳杆菌的分离
从-80 ℃冰箱中取出28株罗伊氏乳杆菌R1~R28和植物乳杆菌AR326的保藏液,在固体培养基上培养一代,再挑单菌落液体活化一代后得到种子液。将种子液以1%的接种量接种到MRS液体培养基中进行后续实验。
1.3.2罗伊氏乳杆菌系统发育树构建
用NCBI的Blast程序对菌株16S rRNA序列进行相似性搜索,获取相似性最高的典型菌株序列,然后用Clustal W对所得序列进行比对,最后用MEGA7软件构建Neighbor-Joining系统进化树。
1.3.3罗伊氏乳杆菌和植物乳杆菌自聚能力测定
按1%接种量将乳杆菌的种子液分别接种入新鲜MRS液体培养基,37 ℃恒温培养12 h。取5 mL菌液,8 000 r/min离心10 min,用灭菌后的PBS缓冲溶液重悬菌体,洗涤三次,然后在8 000 r/min下离心10 min。用PBS缓冲液重悬菌体,在波长600 nm处测吸光度A0。菌液常温静置5 h再次测吸光值At。
自聚性(%)=[1-(At/A0)]×100%
1.3.4罗伊氏乳杆菌和植物乳杆菌表面疏水性测定
按上述方法准备菌悬液,用PBS洗涤三次并重悬。调整菌液浓度后在波长600 nm处测吸光度A0。取2 mL菌悬液与2 mL二甲苯混合,涡旋震荡2 min,室温静置1 h,测定水向的吸光度At。
表面疏水性(%)=[1-(At/A0)]×100%
1.3.5罗伊氏乳杆菌和植物乳杆菌与大肠杆菌共聚性测定
按1%的接种量接种到培养基,37 ℃培养12 h,得到罗伊氏乳杆菌和植物乳杆菌的菌悬液。大肠杆菌用LB培养液培养20 h,得到大肠杆菌菌悬液。8 000 r/min离心10 min获得罗伊氏乳杆菌、植物乳杆菌和大肠杆菌的菌体,分别用灭菌后的PBS缓冲溶液洗涤三次并重悬,调整罗伊氏乳杆菌和植物乳杆菌菌液的吸光度Aprobio,大肠杆菌菌液的吸光度为Apat;取等体积的乳杆菌和大肠杆菌菌液2 mL,混匀,37 ℃培养5 h,然后测定混合液的吸光度Amix。
共聚性(%)=[((Aprobio+Apat)/2-Amix)/(Aprobio+Apat)/2]×100%
1.3.6罗伊氏乳杆菌和植物乳杆菌对HT-29细胞的黏附性测定
HT-29细胞水浴解冻,8 000 r/min离心5 min收集细胞,加入5 mL完全培养液,吸出上清,保留细胞沉淀。加入3 mL无菌D-hanks缓冲溶液轻轻吹吸混匀。重复操作2次,加入1 mL完全培养液轻轻吹吸,混匀并移至培养皿中。放置于37 ℃培养,每隔2 d更换培养液,待细胞培养皿上HT-29的覆盖率达到80%后,可进行黏附实验。
将细胞爬片放置12孔板内,取HT-29细胞,调整细胞浓度约为5×105cells/mL,置37 ℃培养12 h。加入罗伊氏乳杆菌R21-R28和植物乳杆菌AR326菌悬液各1 mL,再次放置于37 ℃孵育2 h。取出后用PBS缓冲溶液轻轻洗涤三次。每孔加入1 mL甲醇固定20 min,再用PBS缓冲溶液洗涤一次,用革兰氏染色试剂盒染色,镜检计数。计算每100个细胞周围黏附的乳杆菌数量。黏附实验重复三次。
1.3.7罗伊氏乳杆菌R28的耐酸耐胆盐测定
将罗伊氏乳杆菌R28的种子液分别接入pH3.0、pH4.0、pH 5.0、胆盐含量0.1%、0.2%和0.3%和不含胆盐的MRS液体培养基中,取200 μL加入生长曲线孔板,利用Bioscreen C全自动生长曲线分析仪测定乳杆菌在不同pH和胆盐浓度下的吸光度。
1.4 数据处理
所有数据均用“平均值±标准差”(mean±SD)表示,采用SPSS 22.0软件进行显著性差异分析并计算皮尔逊(Pearson)线性相关性系数,结果图采用Origin8.0和GraphPad16.0绘制制作。
2 结果与分析
2.1 罗伊氏乳杆菌系统发育树分析
对28株罗伊氏乳杆菌株进行16S rRNA分析,利用邻接法构建发育树。分析表明R1与R8之间差异性较小,表明这2株菌具有亲缘关系。R13、R5、R7、R10这4株亲缘关系明显,与R1、R8亲缘关系较远。R28、R20与大部分罗伊氏乳杆菌亲缘关系较远。
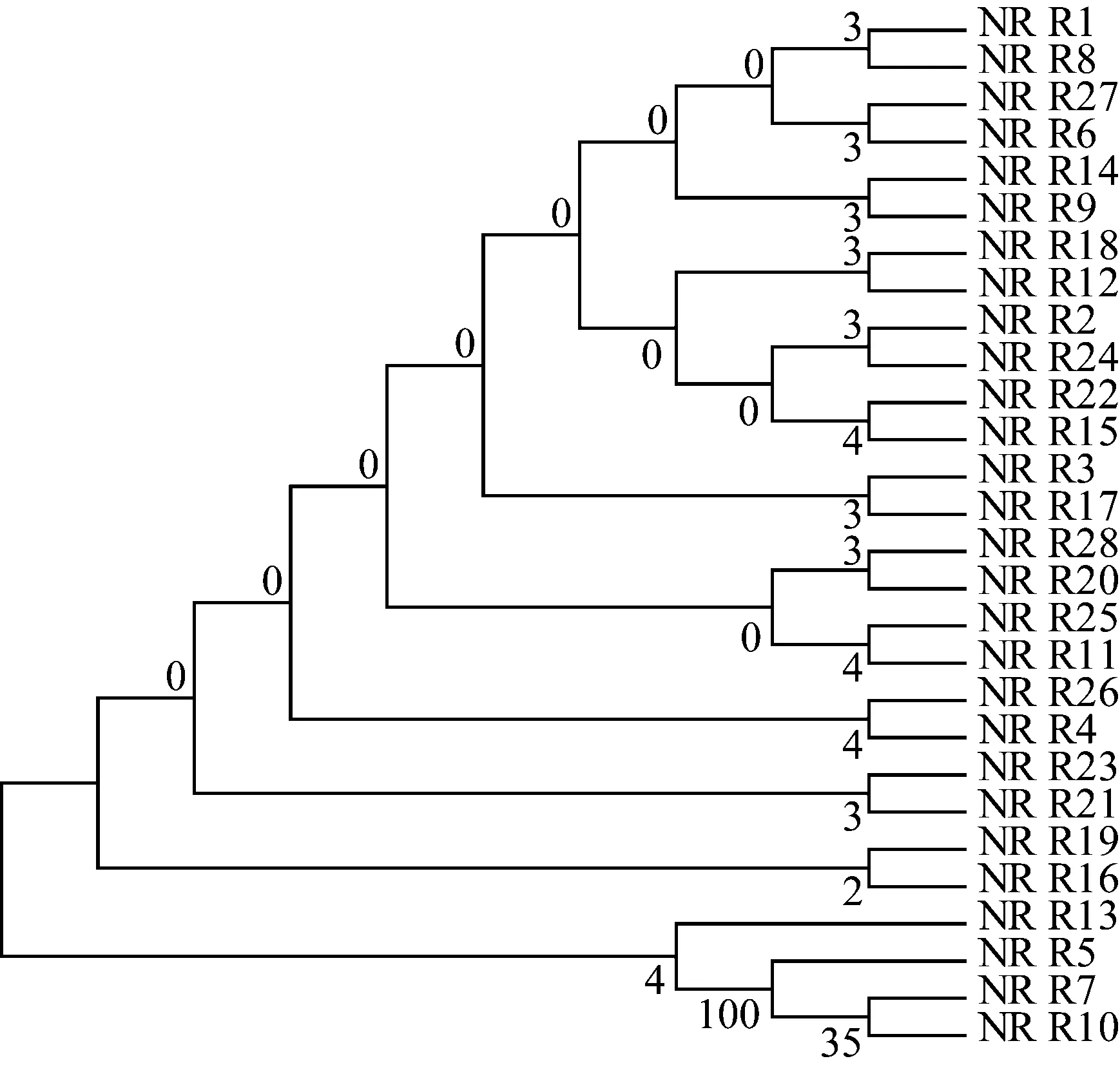
图1 基于16S rRNA构建的28株罗伊氏乳杆菌的邻接法系统发育树
2.2 乳杆菌自聚性、细胞表面疏水性、与大肠杆菌共聚性分析
如表1所示,所有考察的乳杆菌的自聚率范围分布在4.27%~52.1%。罗伊氏乳杆菌菌株R2、R5、R8自聚性均小于10%,自聚能力较低。植物乳杆菌AR326的自聚性为39.77±8.47%。而罗伊氏乳杆菌菌株R22和R10的自聚性均高于40%,自聚效果明显。所考察菌株的细胞表面疏水性范围为1.35%~88.51%。其中罗伊氏乳杆菌菌株R1、R2、R3、R5、R6、R8、R9、R10、R12和R21的细胞表面疏水性较弱,均低于10%。相比之下,菌株R24、R27和R28表面疏水性极强,分别可达88.51±7.81%、86.39±6.78%和75.53±4.09%。植物乳杆菌AR326的疏水性为16.30±3.64%。菌株R28与大肠杆菌共聚效果最佳(36.84%),说明在这28株罗伊氏乳杆菌中,菌株R28在肠道定植后,能够与致病菌很好的接触聚合,发挥抑菌作用。对植物乳杆菌AR326而言,其与大肠杆菌共聚效果也较好(24.78%)。
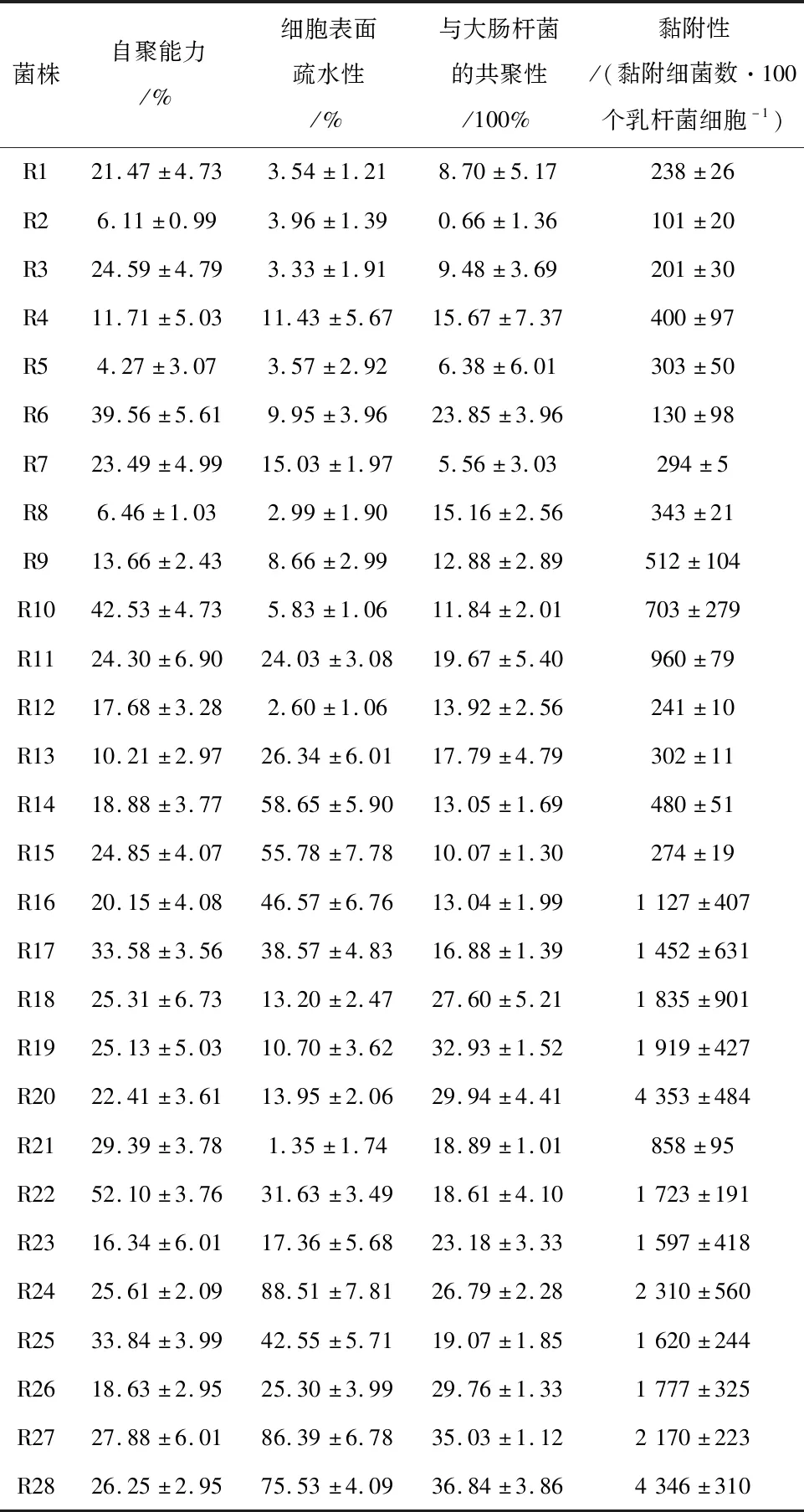
表1 乳杆菌自聚能力、细胞表面疏水性、与大肠杆菌共聚性及细胞黏附结果
2.3 乳杆菌对HT-29细胞的黏附性分析
从表1可看出,细胞黏附性的测定结果与罗伊氏乳杆菌的自聚性,疏水性,与大肠杆菌共聚性的测定结果之间具有一定程度的相关性。R20和R28的细胞黏附效果极佳,高达每100个细胞附近黏附大于4 000个乳杆菌细胞。R2和R5的细胞黏附效果及前三项指标数值都较低,R1、R3、R6、R7、R12和R15的黏附效果较差。
2.4 罗伊氏乳杆菌自聚能力、表面疏水性、与大肠杆菌共聚性及HT-29细胞的黏附性相关性分析
相关性分析采用皮尔逊相关系数(Pearson correlation coefficient)表示。r为皮尔逊相关系数值。一般的,当|r|<0.2时,可认为两变量基本不相关;0.2≤|r|<0.4,认为两变量低度相关;0.4≤|r|<0.6,认为两变量中度相关;0.6≤|r|<0.8,认为两变量高度相关;|r|≥0.8,认为两变量间极高度相关。由图2A可知,罗伊氏乳杆菌的自聚性与细胞黏附性之间基本不相关(r=0.263,P>0.05);由图2B可知,疏水性和细胞黏附性为中度相关(r=0.476,P<0.01);由图2C可知,菌株与大肠杆菌的共聚性和细胞黏附性之间具有高度相关性(r=0.792,P<0.001)。由图3D、3E、3F可看出,罗伊氏乳杆菌自聚性与大肠杆菌共聚性之间,以及自聚性与菌株表面疏水性之间相关度低,因此表面疏水性及与大肠杆菌共聚性可作为评价菌株黏附能力的有效指标。
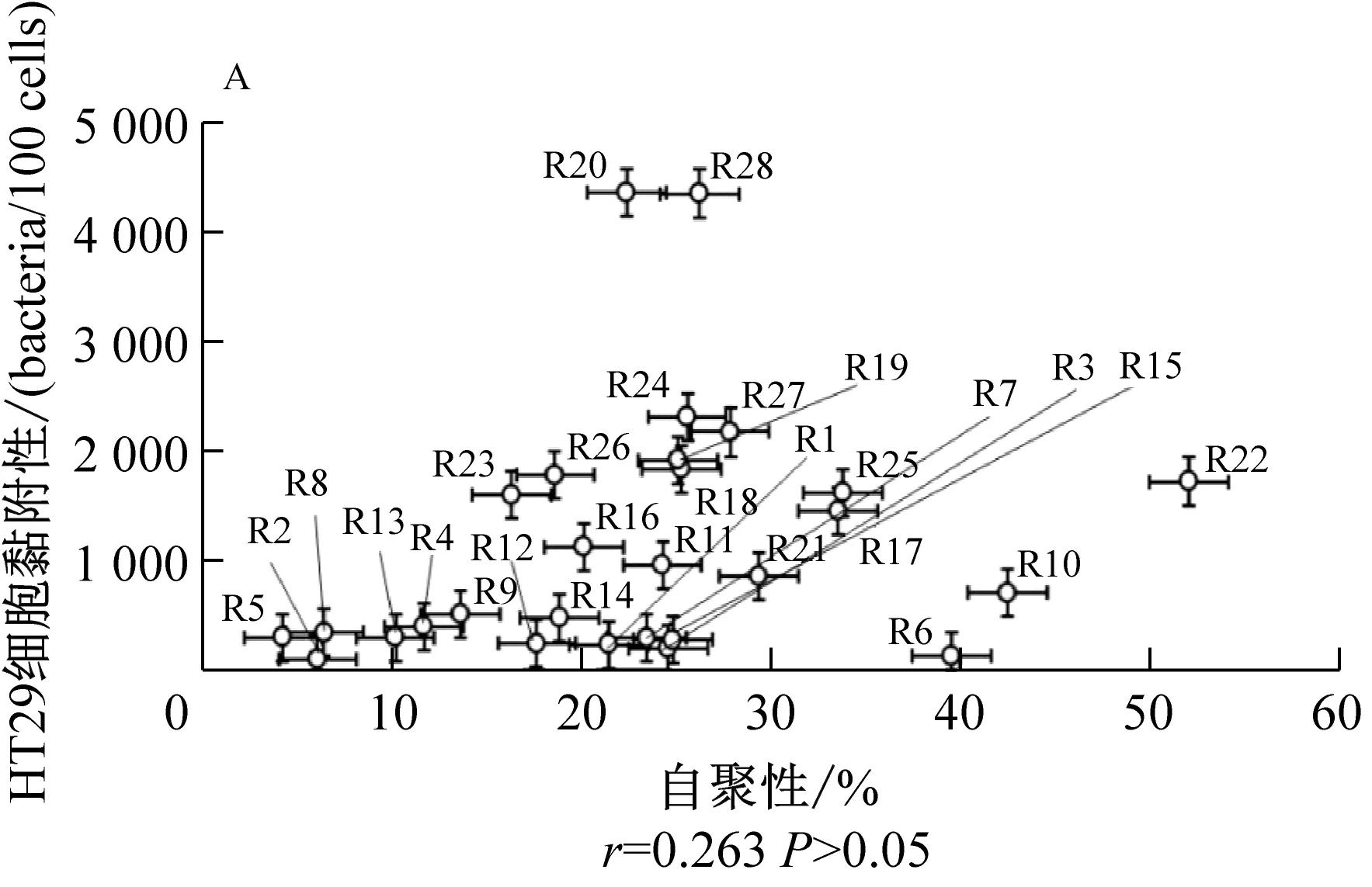
图2 乳杆菌自聚性、与大肠杆菌的共聚性、细胞表面疏水性和细胞黏附性之间的相关性分析
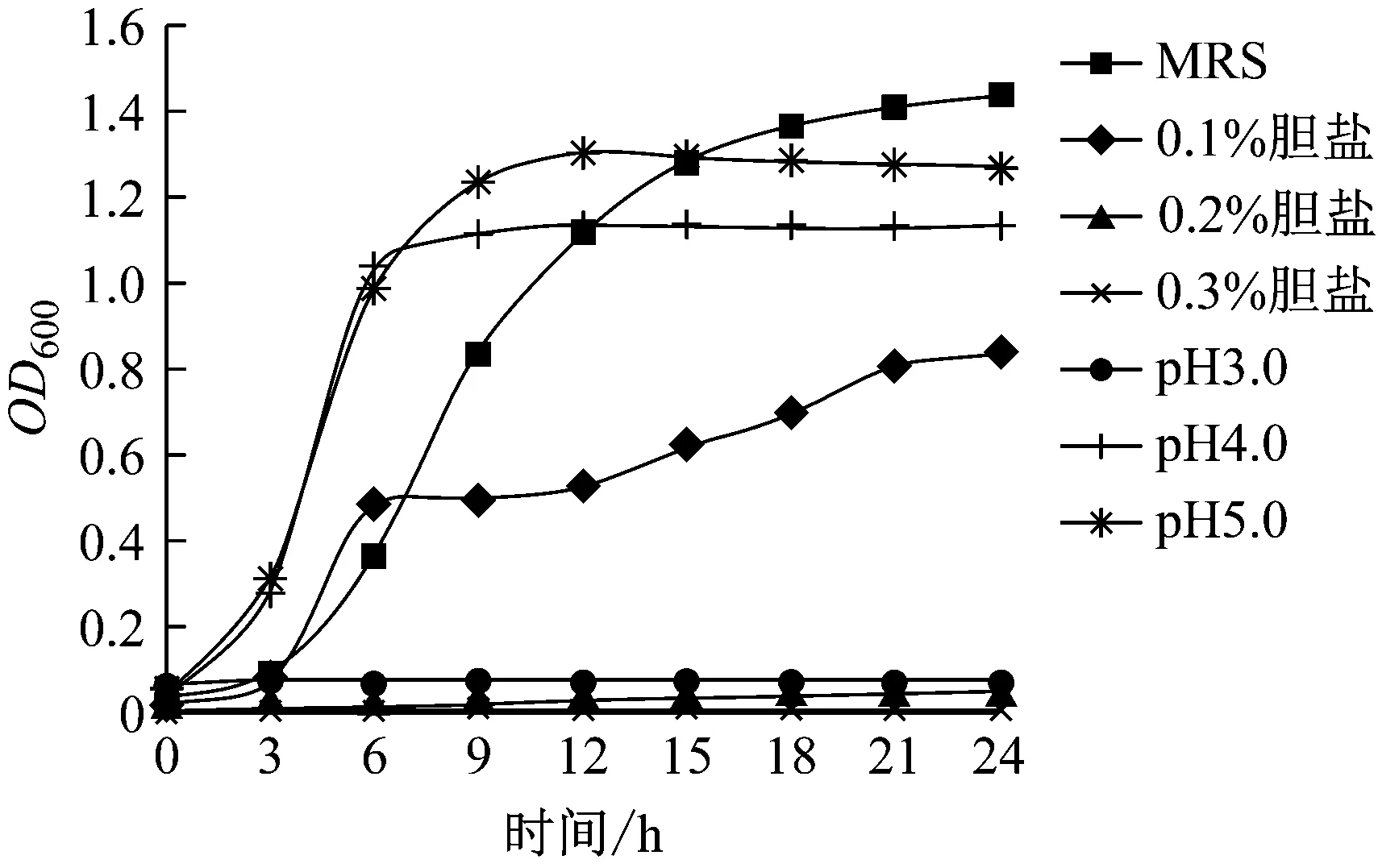
图3 罗伊氏乳杆菌R28耐酸、耐胆盐生长曲线
2.5 乳杆菌R28耐酸耐胆盐结果
在37 ℃下,检测了罗伊氏乳杆菌R28在pH 3.0、pH 4.0、pH 5.0,胆盐浓度0.1%、0.2%、0.3%及未添加胆盐的常规MRS培养条件下的生长曲线。在pH值为3.0的条件下,均未见菌株生长的迹象。在pH 4.0和pH 5.0的条件下,随培养时间延长,OD600明显增加,生长曲线可大致分为3个阶段(迟滞期、对数期与稳定期)。当胆盐浓度高于0.1%时,R28生长受到抑制,OD600显著低于常规MRS培养条件下的观测值。当胆盐浓度高于0.2%时,未观察到菌浓明显增加的迹象。
3 结论
通过对28株罗伊氏乳杆菌的自聚能力、表面疏水性、与大肠杆菌的共聚性的测定发现:菌株R22的自聚效果最佳,为52.1%;R28的自聚能力为26.25%;R5的自聚能力最弱,仅为4.27%。疏水性指标测定结果显示:R28,R27,R24的表面疏水性极强。R28与大肠杆菌的共聚效果检测值最高可达36.84%。益生菌的黏附性、疏水性及自凝集作用均存在菌种特异性。
通过相关性分析发现,罗伊氏乳杆菌的细胞表面疏水性与大肠杆菌共聚性,以及细胞黏附能力之间具有高度相关性,说明细胞表面疏水性及与大肠杆菌的共聚性可作为筛选黏附性良好的罗伊氏乳杆菌的评价指标。最终确定R28为黏附性最强的罗伊氏乳杆菌,可很好黏附于肠道细胞,是益生菌制剂开发应用中的潜力菌株。

