lncRNA HNF1A-AS1通过miR-320d/SOX4轴调节宫颈癌的发展
谢锦霞 ,刘晶晶
宫颈癌是最常见的妇科恶性肿瘤,早期症状不明显,晚期出现阴道出血等症状[1]。近些年,宫颈细胞学筛查的普遍应用使宫颈癌的发病率和死亡率已有明显下降,但癌细胞生物学特性多种多样,导致宫颈癌易发生转移,并对治疗产生不同的反应。因此进一步了解宫颈癌的发展机制能为早期诊断和晚期预后提供新的分子理论基础。长链非编码RNA(long noncoding,lncRNA)是一类非编码RNA,含有200个核苷酸,翻译潜力有限[2-3],研究发现lncRNAs参与细胞内外的多种活动,包括基因转录、mRNA剪接和肿瘤发生等[4-6]。HNF1A AS1是一种新鉴定的lncRNA,自鉴定以来,HNF1A AS1已被证明在人类肿瘤发生中起关键作用,如在口腔鳞癌和胶质瘤细胞中,HNF1A AS1表达上调,促进癌细胞的存活和转移,提示HNF1A AS1可能作为癌基因促进癌症发展[7-8]。然而,HNF1A AS1是否对宫颈癌细胞具有强大的促癌作用还没有深入的研究。本研究拟探究HNF1A AS1在宫颈癌发展过程中的作用及机制,为治疗宫颈癌患者提供新的理论基础。
1 材料与方法
1.1 主要材料
人宫颈癌细胞C33A和人宫颈上皮永生化细胞株H8细胞来自上海生物细胞研究所;DMEM(Dulbecco's-modified Eagle's medium)培养基和胎牛血清来自美国Gibco公司;CCK-8试剂盒、点突变试剂盒和双荧光素酶活性检测试剂盒购自上海碧云天生物科技有限公司;PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)、LipofectamineTM2000购于美国Invitrogen公司;钙粘附蛋白E(epithelial-cadherin,E-cadherin)、钙粘附蛋白N(N-cadherin)、B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2)、Bcl-2相关蛋白X(Bcl-2-Associated X,Bax)和GAPDH多克隆抗体购于上海圣克鲁斯生物科技有限公司;模拟物对照(mimics NC)、miR-320d 模拟物(miR-320d mimics)、抑制剂对照(inhibitor NC)、miR-320d抑制剂(miR-320d inhibitor)、干扰对照(siRNA NC)、HNF1A-AS1干扰(HNF1A-AS1 siRNA)、SOX4干扰(SOX4 siRNA)质粒由广州锐博生物科技有限公司合成。
1.2 方法
1.2.1 细胞培养 在含10%胎牛血清的DMEM培养基中培养C33A细胞和H8细胞,于37℃、5% CO2饱和湿度条件下培养。
1.2.2 细胞转染 取生长状态良好的细胞,当细胞长满后,按1×105个/孔的密度铺于12孔板中,待细胞汇合至75%~80%时,将各组重组质粒、LipofectamineTM2000分别稀释于无FBS培养基中,转染组分为:A:mimics NC组、miR-320d mimics组、inhibitor NC组、miR-320d inhibitor组;B:siRNA NC组、HNF1A-AS1 siRNA组、SOX4 siRNA组;C:siRNA NC+inhibitor NC组、HNF1A-AS1 siRNA+inhibitor NC组、miR-320d inhibitor+siRNA NC组、HNF1A-AS1 siRNA+miR-320d inhibitor组;D:HNF1A-AS1 wt +miR-320d组、HNF1A-AS1 wt +mimics control组、HNF1A-AS1 mut+miR-34a组、HNF1A-AS1 mut+mimics control组;E:SOX4 wt +miR-320d组、SOX4 wt +mimics control组、SOX4 mut+miR-34a组、SOX4 mut+mimics control组。于室温孵育5 min,将稀释后的重组质粒和脂质体混匀,室温孵育15 min,将混合物小心滴加到细胞中,转染48 h后收集各组细胞RNA样和蛋白样进行生物学功能实验。
1.2.3 细胞增殖测定 取生长状态良好的细胞,当细胞密度达95%时,PBS清洗3次,用2.5 g/mL胰酶消化细胞,按1×105个/mL的密度铺于96孔板中,观察细胞汇合达70%~80%时,使用LipofectamineTM2000转染质粒,每组重复6个,于37℃、5% CO2培养箱中培养48 h后弃上清,PBS清洗2次,每孔加入10 μL CCK-8工作液,继续培养5 h,在酶标仪上读取各孔在450 nm处的吸光值。
1.2.4 双荧光素酶报告基因活性检测 采用miRanda和TargetScan生物信息学软件预测HNF1A-AS1和miR-320d潜在靶基因,PCR扩增HNF1A-AS1 3' UTR片段和SOX4 3' UTR片段,构建HNF1A-AS1野生型(HNF1A-AS1 wt)和SOX4野生型(SOX4 wt)载体。再通过点突变试剂盒构建HNF1A-AS1和SOX4突变重组质粒。按照LipofectamineTM2000转染说明书转染各组重组质粒,采用双荧光素酶活性检测试剂盒检测C33A细胞的荧光素酶活性。
1.2.5 流式细胞仪检测宫颈癌细胞的凋亡率 将各组重组质粒使用LipofectamineTM2000转染至C33A细胞,胰酶消化后,用含10%FBS的DMEM培养基进行中和,1 000 r/min离心10 min后弃上清,PBS清洗3次,沉淀置于70%的乙醇中,4°C固定过夜,用流式细胞仪检测各组细胞的细胞凋亡水平,收集数据进行显著性分析。
1.2.6 实时荧光定量PCR 收取转染重组质粒的细胞RNA样,使用Trizol试剂在无RNA酶条件下从细胞中抽提总RNA,使用Takara反转录试剂盒反转成cDNA,按照42℃,2 min;37℃ 15 min,85 ℃ 5 s的程序进行反应,逆转录得到的cDNA为模板,进行RT-qPCR,反应程序为95℃ 10 min,95℃ 15 s,60℃ 1 min,40个循环。使用2-△△Ct法分析实验结果,并以U 6表达作为内参照。实验所用的引物见表1。

表1 引物序列
1.2.7 Western blot 收取转染重组质粒的细胞蛋白样,使用RIPA充分裂解细胞,收集蛋白上清液,使用BCA试剂盒测定上清蛋白质浓度,取适量样品进行点样,并按照 80 V 35 min、115 V 2 h 的程序进行SDS-PAGE凝胶电泳。结束后采用湿转将蛋白湿转到PVDF膜上。转膜完成后,将PVDF 膜置于封闭液(50 g/L脱脂奶粉配制)中,在室温摇床封闭 2 h,封闭后的PVDF膜与一抗中在4℃过夜孵育,TBST清洗5次,每次5 min,一抗孵育结束后,将膜放在特异性二抗中,室温摇床孵育1.5 h,TBST清洗3次,每次10 min,清洗干净后进行目的蛋白曝光。
1.3 统计学分析
采用SPSS 16.0软件处理数据,至少取3次独立实验结果。组间比较采用单因素方差分析,两两比较采用LSD-t检验,P<0.05为差异有统计学意义。
2 结果
2.1 miR-320d抑制C33A细胞增殖和EMT,促进C33A细胞的凋亡
由图1A可知,C33A细胞中miR-320d的表达量低于H8细胞(t=8.139,P=0.0148)。由图1B可知,和mimics NC组相比,miR-320d mimics组的miR-320d表达量明显升高(t=20.79,P=0.0023)。由图1C MTT实验结果可知,miR-320d mimics组的细胞增殖能力低于mimics NC组(t=6.081,P=0.0260)。由图1D、1E可知,miR-320d mimics组的细胞凋亡率明显高于mimics NC组(t=15.52,P=0.0041)。由图1F~1I可知,和mimics NC组相比,miR-320d mimics组的Bax、E-cadherin蛋白表达量明显上升(t=12.67,P=0.0062),Bcl-2和N-cadherin蛋白表达量下降(t=6.281,P=0.0237),以上结果表明miR-320d能够抑制C33A细胞的增殖和EMT,促进C33A细胞的凋亡。

A:RT-qPCR检测miR-320d在C33A和H8细胞中的表达量;B:RT-qPCR检测miR-320d的相对表达量;C:MTT检测miR-320d对C33A细胞增殖的影响;D:流式细胞仪检测miR-320d对C33A细胞凋亡的影响;E:C33A细胞凋亡率;F:Western blot检测Bcl-2、Bax的蛋白表达量;G:Bcl-2、Bax蛋白相对表达量;H:Western blot检测E-cadherin、N-cadherin的蛋白表达量;I:E-cadherin、N-cadherin蛋白的相对表达量(*P<0.05;**P<0.01;n=3)(注:“n”是代表每个实验重复3次,下同)
2.2 HNF1A-AS1通过调控miR-320d表达促进C33A细胞增殖和EMT,抑制细胞凋亡
miRanda预测HNF1A-AS1和miR-320d之间的结合位点见图2A。图2B结果可知,当质粒携带HNF1A-AS1 3' UTR wt时,miR-320d的荧光素酶活性显著降低(t=19.70,P=0.0026);当质粒携带HNF1A-AS1 3' UTR mut时,miR-320d的荧光素酶活性无变化(P>0.05)。由图2C可知,C33A细胞中HNF1A-AS1的表达量明显高于H 8细胞(t=18.31,P=0.0030);由图2D~2E可知,与siRNA NC相比,HNF1A-AS1 siRNA组HNF1A-AS1的基因表达量下降(t=6.893,P=0.0204),而miR-320d的基因表达量上升(t=8.839,P=0.0126),说明HNF1A-AS1和miR-320d之间存在负调控关系。由图2F~2J可知,和siRNA NC+inhibitor NC组相比,HNF1A-AS1 siRNA+inhibitor NC组细胞增殖能力下降(t=5.367,P=0.0330),Bax、E-cadherin蛋白表达量明显上升(t=24.31,P=0.0017 ),Bcl-2和N-cadherin蛋白表达量明显下降(t=25.64,P=0.0015),miR-320d inhibitor+siRNA NC组细胞增殖能力上升(t=5.518,P=0.0030),Bax、E-cadherin蛋白表达量明显下降(t=25.25,P=0.0016 ),Bcl-2和N-cadherin蛋白表达量明显上升(t=25.25,P=0.0013);与miR-320d inhibitor+siRNA NC组相比,HNF1A-AS1 siRNA+miR-320d inhibitor组细胞增殖能力下降(t=7.279,P=0.0184),Bax、E-cadherin蛋白表达量明显上升(t=18.11,P=0.0030),Bcl-2和N-cadherin蛋白表达量明显下降(t=23.71,P=0.0018)。以上结果说明HNF1A-AS1通过调控miR-320d表达促进C33A细胞增殖和EMT,抑制细胞凋亡。
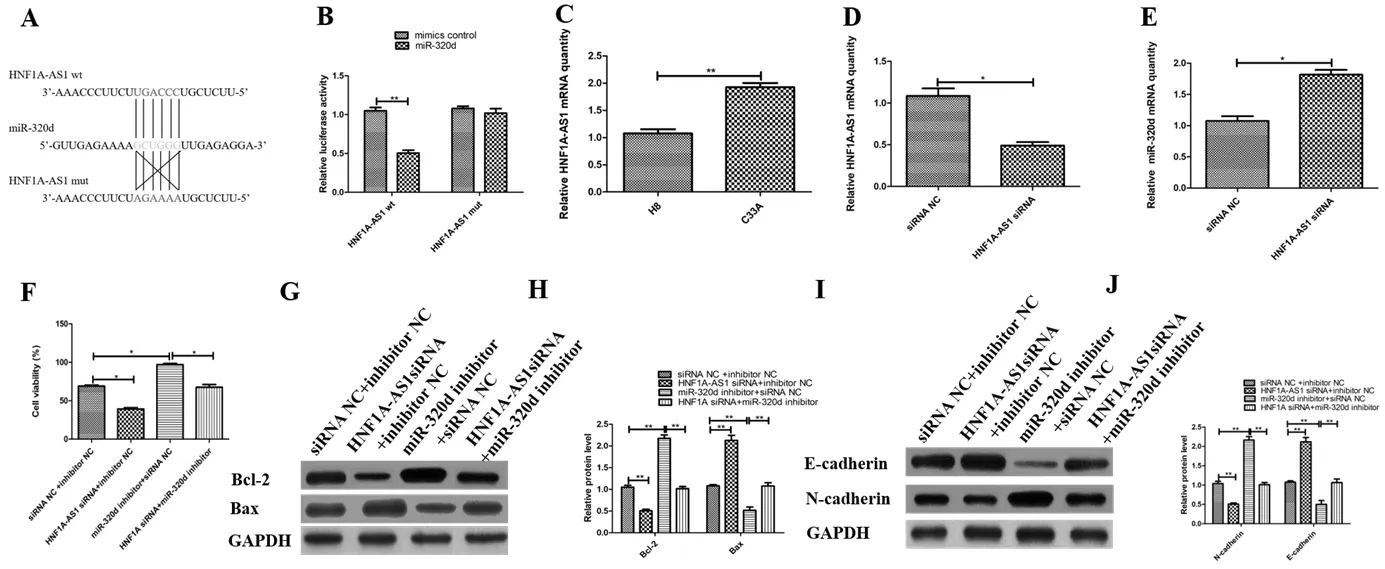
A:miRanda预测NF1A-AS1和miR-320d之间的结合位点;B:荧光素酶表达量的测定;C:RT-qPCR检测HNF1A-AS1在C33A和H8细胞中的表达量;D:RT-qPCR检测HNF1A-AS1的表达量;E:RT-qPCR检测miR-320d的表达量;F:MTT检测 HNF1A-AS1通过miR-320d对C33A细胞增殖的影响;G:Western blot检测Bcl-2、Bax的蛋白表达量;H:Bcl-2、Bax蛋白相对表达量;I:Western blot检测E-cadherin、N-cadherin蛋白的表达量;J:E-cadherin、N-cadherin蛋白的相对表达量(*P<0.05;**P<0.01;n=3)
2.3 SOX4是miR-320d在C33A细胞中的下游靶点
预测miR-320d和SOX4之间的结合位点见图3A,由图3B结果可知,当质粒携带SOX4 3' UTR wt时,miR-320d的荧光素酶活性显著降低(t=12.62,P=0.0062),当质粒携带SOX4 3' UTR mut时,miR-320d的荧光素酶活性无变化(t=3.280,P=0.0817 )。以上结果表明SOX4是miR-320d在C33A细胞中的下游靶点。

A:TargetScan预测 miR-320d和SOX4之间的结合位点;B:荧光素酶表达量的测定;(*P<0.05;**P<0.01;n=3)
2.4 SOX4促进C33A细胞增殖和EMT,抑制C33A细胞的凋亡
由图4A可知,C33A细胞中SOX4的表达量明显高于H8细胞(t=20.87,P=0.0023)。如图4B显示,和siRNA NC组相比,SOX4 siRNA的表达量明显降低(t=18.48,P=0.0029)。由图4C~4I结果可知,SOX4 siRNA组细胞的增殖能力低于siRNA NC组(t=8.728,P=0.0129),凋亡率明显高于siRNA NC组(t=13.10,P=0.0058),Bax、E-cadherin蛋白表达量明显上升(t=48.78,P=0.0004),Bcl-2、N-cadherin蛋白表达量下降(t=7.778,P=0.0161),表明SOX4能够促进C33A细胞的增殖和EMT,抑制C33A细胞的凋亡。

A:RT-qPCR检测SOX4在C33A和H8细胞中的表达量;B:RT-qPCR检测敲低SOX4后细胞中的SOX4的表达量;C:MTT检测SOX4对C33A细胞增殖的影响;D:流式细胞仪检测SOX4对C33A细胞凋亡的影响;E:C33A细胞凋亡率;F:Western blot检测Bcl-2、Bax的蛋白表达量;G:Bcl-2、Bax蛋白相对表达量;H:Western blot检测E-cadherin、N-cadherin的蛋白表达量;I:E-cadherin、N-cadherin蛋白的相对表达量(*P<0.05;**P<0.01;n=3)
2.5 HNF1A-AS1通过miR-320d调控SOX4的表达
由图5A可知,和siRNA NC组相比,HNF1A-AS1 siRNA组的SOX4表达量降低(t=4.664,P=0.0430 );和inhibitor NC组相比,miR-320d inhibitor组的SOX4表达量明显升高(t=13.56,P=0.0054 );由图5B~5C可知,和siRNA NC+inhibitor NC组相比,HNF1A-AS1 siRNA+inhibitor NC组SOX4蛋白表达量降低(t=8.728,P=0.0129 ),miR-320d inhibitor+siRNA NC组SOX4蛋白表达量明显上升(t=15.41,P=0.0042 );和miR-320d inhibitor+siRNA NC组相比,HNF1A-AS1 siRNA+miR-320d inhibitor组SOX4蛋白表达量降低(t=5.692,P=0.0295 )。以上结果说明HNF1A-AS1通过miR-320d调控SOX4的表达。

A:RT-qPCR检测SOX4的表达量;B:Western blot检测HNF1A-AS1通过miR-320d调控SOX4的表达;C:SOX4蛋白的相对表达量(*P<0.05;**P<0.01;n=3)
3 讨论
最近越来越多的研究发现,在癌症的发生发展过程中,miRNA的异常表达可能作为癌基因或抑癌基因发挥重要的作用。大量研究报道了在宫颈癌中异常表达的miRNA,如在宫颈癌缺氧条件下,microRNA-519d-3p通过靶向HIF-2抑制细胞增殖和促进细胞凋亡[9]。miR-152在宫颈癌中具有抑癌功能,miR-152/KLF 5轴可能为宫颈癌治疗提供新的治疗靶点[10]。此外,miRNA-489能够作为宫颈癌诊断和治疗的生物标志物[11]。miR-320d作为miR-320家族的重要成员,已有研究报道miR-320d在胶质瘤、乳腺癌、结直肠腺瘤和B细胞淋巴瘤中的作用[12-13]。而在本研究中,我们探讨了miR-320d在宫颈癌中的临床意义,并研究了其在宫颈癌细胞增殖、凋亡和EMT中的作用。结果表明,miR-320d在宫颈癌细胞中的表达明显低于正常细胞,过表达miR-320d能够抑制宫颈癌细胞的增殖、EMT和促进细胞凋亡。因此,miR-320d可能在宫颈癌中发挥抑癌作用。
大量研究表明,lncRNA能够作为宫颈癌的诊断和预后标志物参与癌症的发生发展。例如,LncRNA MALAT-1在宫颈癌中过表达,促进癌细胞的增殖、侵袭和迁移[14]。长链非编码RNA TUG1的上调促进了宫颈癌细胞的增殖和迁移[15]。HNF1A-AS1作为很重要的lncRNA首次在人原发性食管腺癌中发现异常表达[16]。另外发现HNF1A-AS1在肺腺癌、肝细胞癌和骨肉瘤中也表达上调,能够作为癌基因发挥作用[17-18]。本研究首先通过生物信息学分析发现miR-320d在HNF1A-AS1 3 UTR中的靶位点。此外,和正常细胞相比,宫颈癌细胞中HNF1A-AS1表达上调,敲低HNF1A-AS1增加了miR-320d的表达,抑制了宫颈癌细胞增殖的EMT,促进了癌细胞的凋亡。表明HNF1A-AS1通过下调miR-320d在宫颈癌进展中的表达,起到致癌基因的作用。SOX4是SOX家族中的一员,在调控癌症发展方面起着重要作用。研究发现SOX4在各种癌症中都有上调,如miR-129-2通过下调SOX4的表达来抑制食管癌细胞的增殖和迁移;miR-132通过靶向SOX4抑制肺癌细胞迁移和侵袭[19];SOX4能够诱导上皮-间质转化,促进乳腺癌进展[20]。据报道,SOX4的表达在转录后受到miR-187、miR-204和miR-363等miRNA的调控,而在本研究中,SOX4被预测为miR-320d的下游靶点。SOX4在宫颈癌细胞中表达上调,敲低SOX4能够抑制宫颈癌细胞的增殖和EMT,促进癌细胞的凋亡。此外,本研究结果表明,宫颈癌细胞中SOX4的水平与HNF1A-AS1呈正相关,与miR-320d呈负相关,HNF1A-AS1能够通过miR-320d调控SOX4的表达。
综上所述,lncRNA HNF1A-AS1在宫颈癌中起促癌作用,并通过miR-320d/SOX4轴促进宫颈癌的发展。本实验数据也表明,HNF1A-AS1/miR-320d/SOX4轴可能是宫颈癌的一个有希望的治疗靶点。

