固相萃取-气相色谱-串联质谱法测定牛奶中9种N-亚硝胺的含量
李登昆,张 云,赵士权,刘祥萍,李 磊
(1.南京医科大学附属南京市疾病预防控制中心,南京 210003;2.南京医科大学 公共卫生学院,南京 211166)
N-亚硝胺是一类含有R1N(-R2)-N=O 结构的胺化合物,对哺乳动物具有强烈的细胞毒性[1-4],20世纪80年代国际癌症研究机构(IARC)已将N-亚硝胺归类为有强致癌性的食品污染物。相关研究表明食品在运输、贮藏、加工处理过程中,食品中的蛋白质在内源蛋白酶和微生物的共同作用下极易生成胺类物质,并进一步与食品中的亚硝酸钠等亚硝化剂反应生成N-亚硝胺类化合物[5-6]。许多国家和地区高度重视食品中N-亚硝胺污染状况,并制定相关食品卫生标准对食品中的N-亚硝胺含量进行控制[7],俄罗斯、乌克兰规定肉类、海产品中总N-亚硝胺的安全限量分别为2,3μg·kg-1,冰岛规定肉类、海产品中总N-亚硝胺的安全限量分别为10,7μg·kg-1,我国GB 2762-2017《食品安全国家标准 食品中污染物限量》[8]规定肉及肉制品(肉类罐头除外)、水产动物及其制品(水产品罐头除外)中N-二甲基亚硝胺(NDMA)的安全限量分别为3,4μg·kg-1。
对于富含蛋白的牛奶,国内外鲜有研究报道N-亚硝胺的含量,也未检索到相关牛奶中N-亚硝胺的检验方法。鉴于此,本工作拟建立一种前处理简便、检测灵敏度高、定量准确度好的固相萃取-气相色谱-串联质谱法测定牛奶样品中9种N-亚硝胺含量的方法,为开展牛奶中多种N-亚硝胺污染现状调查,进行人群健康风险评估提供技术支持,为保障我国牛奶产品质量安全、牛奶产业健康发展提供技术支持。
1 试验部分
1.1 仪器与试剂
GCMS-TQ 8040型气相色谱-串联质谱仪;ML 203/02型电子分析天平;CNW 12位固相萃取真空装置;Sorvall Lynx 6000 型高速冷冻落地离心机;JZ-5013型多管旋涡混合仪;UP 500 H 型超声波振荡仪;QL-861型旋涡混合器;Milli-Q Reference水纯化系统;N-EVAP 24 位干浴氮吹仪;Captiva EMR-Lipid固相萃取小柱(300 mg/3 mL);Oasis PRIME HLB固相萃取小柱(200 mg/6 mL);EMRLipid无水硫酸镁除水盐包(部件号5982-0102);SCAA-113亲水PTFE针式滤器(13mm×0.45μm);一次性使用无菌注射器(2 mL,带针)。
N-亚硝胺混合标准储备溶液:100 mg·L-1,于-20 ℃冰箱冷冻保存。
N-亚硝胺混合标准溶液:1.0 mg·L-1,将100 mg·L-1N-亚硝胺混合标准储备溶液从冰箱-20 ℃冷冻层取出置于通风橱内恒温至室温,用乙腈稀释配制成1.0 mg·L-1的N-亚硝胺混合标准溶液。
同位素内标混合标准储备溶液:10 mg·L-1,于-20 ℃冰箱冷冻保存。
同位素内标混合标准溶液:1.0 mg·L-1,将10 mg·L-1同位素内标混合标准储备溶液从冰箱-20 ℃冷冻层取出置于通风橱内恒温至室温,用乙腈稀释配制成1.0 mg·L-1的同位素内标混合标准溶液。
NDMA、N-亚硝基甲基乙基胺(NMEA)、N-亚硝基二乙胺(NDEA)、N-亚硝基哌啶(NPIP)、N-亚硝基二苯胺(NDPh A)、N-亚硝基吗啉(NMor Ph)、N-亚硝基二丙胺(NDPA)、N-亚硝基二丁胺(NDBA)、N-亚硝基吡咯烷(NPYR)、NDMA-d6和NDPA-d14的纯度均大于99%;乙腈为色谱纯;氯化钠为分析纯;试验用水均由Milli-Q 净化系统制得,符合GB/T 6682-2008《分析实验室用水国家标准》规定的一级水。
1.2 仪器工作条件
1)色谱条件 VF-WAXms色谱柱(30 m×0.25 mm,0.25μm);载气为高纯氦气(纯度大于99.999%);流量1.0 mL·min-1(恒流),隔垫吹扫流量3 mL·min-1;进样口温度250 ℃;进样体积1.0μL,不分流进样。柱升温程序:初始温度50 ℃,保持1 min;以10 ℃·min-1速率升温至110 ℃;再以15℃·min-1速率升温至200℃;最后以50 ℃·min-1速率升温至250 ℃,保持10 min。
2)质谱条件 电子轰击离子(EI)源;传输线温度250 ℃;离子源温度230 ℃;电离能量70 eV;溶剂延迟6 min;前四极杆温度150 ℃;后四极杆温度150 ℃;多反应监测(MRM)模式;碰撞诱导解离(CID)气为高纯氩气(纯度99.99%),CID 气压力150 kPa;离子扫描时间间隔0.1 s。9种N-亚硝胺与2种同位素内标的质谱参数见表1,其中“∗”为定量离子对。

表1 质谱参数Tab.1 MS parameters
1.3 试验方法
1.3.1 样品萃取
称取牛奶样品10.0 g(精确至0.001 g)置于50 mL离心管中,加入62.5μL 同位素内标混合标准溶液并充分振荡混匀,加入10.0 mL 乙腈,以转速2 000 r·min-1涡旋振荡2 min,超声波振荡萃取10 min,在冷冻离心机中于4 ℃冷藏5 min,然后以转速10 000 r·min-1离心5 min。转移全部上清液于另一50 mL离心管中,加入10 g氯化钠,以转速2 000 r·min-1涡旋振荡2 min,再于4 ℃以转速10 000 r·min-1离心5 min,移取上层有机相4.0 mL至15 mL离心管中待净化。
1.3.2 样品净化
用体积比4∶1的乙腈-水混合液4.0 mL 在其重力作用下淋洗Captiva EMR-Lipid 固相萃取小柱,淋洗液全部通过后减压排净,重复上述操作步骤2次。上述4.0 mL 萃取液中加入1.0 mL 水,充分涡旋振荡混匀,全部上样至淋洗后的固相萃取小柱中并同时收集净化液,待萃取液在其自身重力作用下完全从固相萃取小柱洗脱之后,施加真空以排空净化小柱。
1.3.3 样品浓缩
在净化液收集管中加入0.5 g氯化钠,以转速2 000 r·min-1涡旋振荡1 min,再于4 ℃以转速10 000 r·min-1离心5 min,转移全部上层有机相至刻度离心管中,然后于30℃以微流量氮气进行氮吹浓缩。净化液浓缩至0.5 mL左右时,加入适量乙腈定容至1.0 mL,再加入适量的无水硫酸镁除水,经亲水PTFE针式滤器过滤后按仪器工作条件测定。
2 结果与讨论
2.1 仪器工作条件的选择
气相色谱法分析测定N-亚硝胺类化合物时常用强极性色谱柱,笔者在文献[2]中已进行过探讨,本试验仍采用VF-WAXms色谱柱作为分析柱。选用质量浓度为25μg·L-1的混合标准溶液,结合GCMS-TQ 8040 软件的Smart MRM 功能自动优化目标组分的母离子、子离子、碰撞能量及采集时间等。
9种N-亚硝胺及2种同位素内标的质谱参数见1.2节,MRM 扫描的总离子流色谱图见图1。

图1 9种N-亚硝胺及2种同位素内标的总离子流色谱图Fig.1 Total ion chromatograms of the 9 N-nitrosamines and 2 isotope internal standards
2.2 样品前处理条件的选择
2.2.1 蛋白沉淀剂
牛奶样品基质成分复杂,富含蛋白质、脂肪、磷脂及碳水化合物等,会造成仪器系统污染。为降低基质干扰、提高目标待测物的分析测定灵敏度,牛奶样品应进行蛋白沉淀及净化处理[9-10],常用的蛋白沉淀剂为亚铁氰化钾-乙酸锌、3%(体积分数,下同)乙酸溶液及乙腈等[11]。但文献[12]认为亚铁氰化钾-乙酸锌作为蛋白沉淀剂引入了大量金属离子,会干扰试验结果;文献[13]通过试验比对发现3%乙酸溶液沉淀效果不理想且不利于进一步上机测定;而文献[14]采用乙腈沉淀蛋白测定乳及乳制品中硝酸盐和亚硝酸盐,文献[15]以乙腈作为蛋白沉淀剂与提取剂测定牛奶中11种真菌毒素残留量,均获得良好的加标回收率及精密度,同时文献[16]发现牛奶样品与乙腈体积比为1∶1 时,超声波振荡10 min并于4 ℃低温冷藏沉淀10 min,可以获得最大程度沉淀效果。
本试验中发现,亚铁氰化钾-乙酸锌沉淀法固形物较多,难以分离出足够量的上清液;3%乙酸溶液沉淀法沉淀剂使用量大,高速离心后上清液过多,不利于进一步的除脂除杂操作;乙腈沉淀法不仅能获得较好的蛋白沉淀效果,在加入过量的氯化钠后由于盐析作用,还能进一步沉淀乳清蛋白等杂质。因此,试验在10.0 g牛奶样品中加入10.0 mL 乙腈,超声波振荡10 min后,在冷冻离心机中于4℃冷藏5 min,再以转速10 000 r·min-1离心5 min进行牛奶蛋白沉淀。
2.2.2 样品净化小柱
牛奶样品中磷脂、脂肪等复杂成分,不仅会污染色谱系统、干扰目标物的分析测定,也会增加维护成本、降低仪器使用寿命[17]。EMR-Lipid净化技术基于体积排阻和疏水相互作用机制,可高选择性去除样品中的脂质/基质[18],Oasis PRIME HLB可以选择吸附去除样品中蛋白质、盐、磷脂等基质干扰物而不影响目标物的回收率[19],两款固相萃取柱都适合净化磷脂/脂质含量较高的样品。按试验方法,分别用Captiva EMR-Lipid 固相萃取小柱与Oasis PRIME HLB固相萃取小柱处理同一牛奶样品,对比两款固相萃取小柱的净化效果。结果显示,采用Oasis PRIME HLB固相萃取小柱净化,所得MRM扫描总离子流色谱图背景响应值高,干扰痕量N-亚硝胺的测定结果,而Captiva EMR-Lipid固相萃取小柱具有更优的净化效果。因此,试验选择Captiva EMR-Lipid固相萃取小柱作为样品净化柱。
2.3 标准曲线与检出限
将N-亚硝胺混合标准溶液用乙腈逐级稀释配制成9种N-亚硝胺质量浓度均为2.0,5.0,10.0,25.0,50.0,100,150μg·L-1,同位素内标质量浓度均为25μg·L-1的混合标准溶液系列,按仪器条件测定。以定量离子峰面积与内标物峰面积的比值为纵坐标,以9种N-亚硝质量浓度与内标物质量浓度的比值为横坐标绘制标准曲线。9种N-亚硝胺的线性范围均为0.5~37.5μg·kg-1,线性回归方程和相关系数见表2。
取牛奶样品10.0 g,加入10 mL 乙腈进行提取,取上层有机相4.0 mL 进行净化、浓缩后测定,分别以3倍信噪比(S/N)、10 倍信噪比计算方法的检出限(3S/N)和测定下限(10S/N),结果见表2。
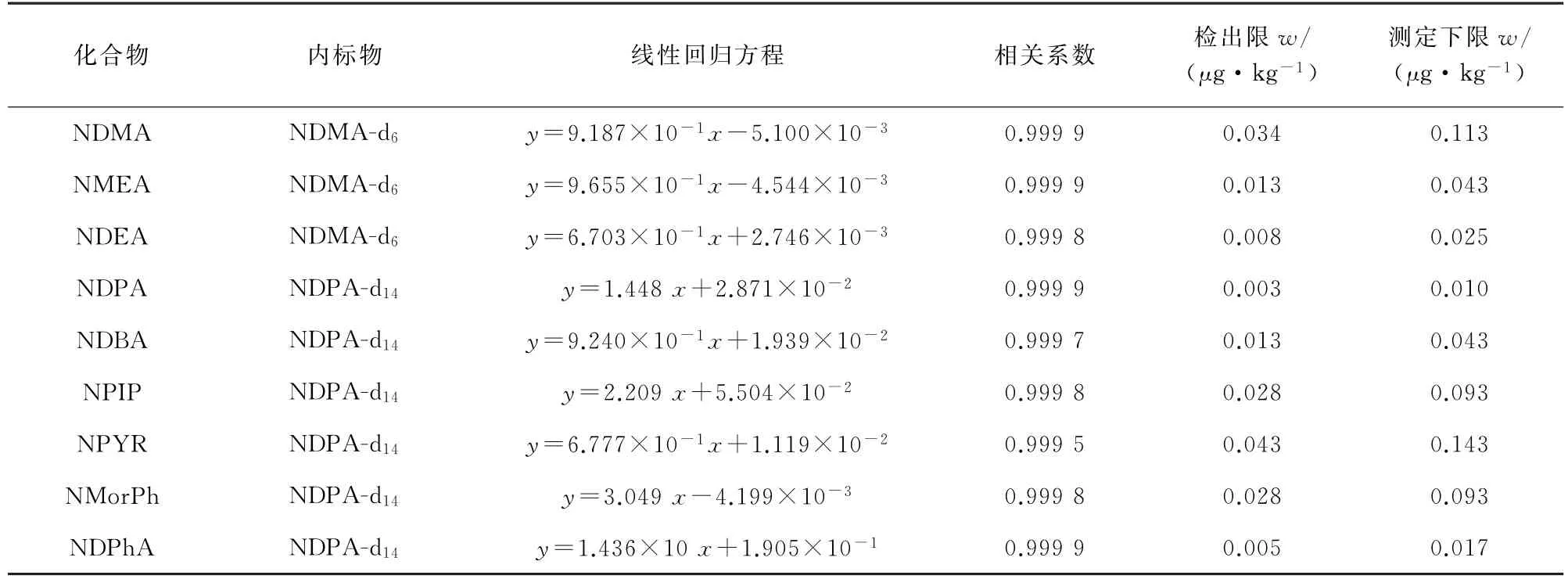
表2 线性参数、检出限和测定下限Tab.2 Linearity parameters,detection limits and lower limits of determination
2.4 精密度与回收试验
在牛奶样品中加入适量N-亚硝胺混合标准溶液,充分振荡混匀,配制成加标浓度水平为1.0,3.0,10μg·kg-1的加标样品,每个浓度水平配制6个平行样品。按试验方法测定,计算回收率及测定值的相对标准偏差(RSD),结果见表3。

表3 精密度与回收试验结果(n=6)Tab.3 Results of tests for precision and recovery(n=6)
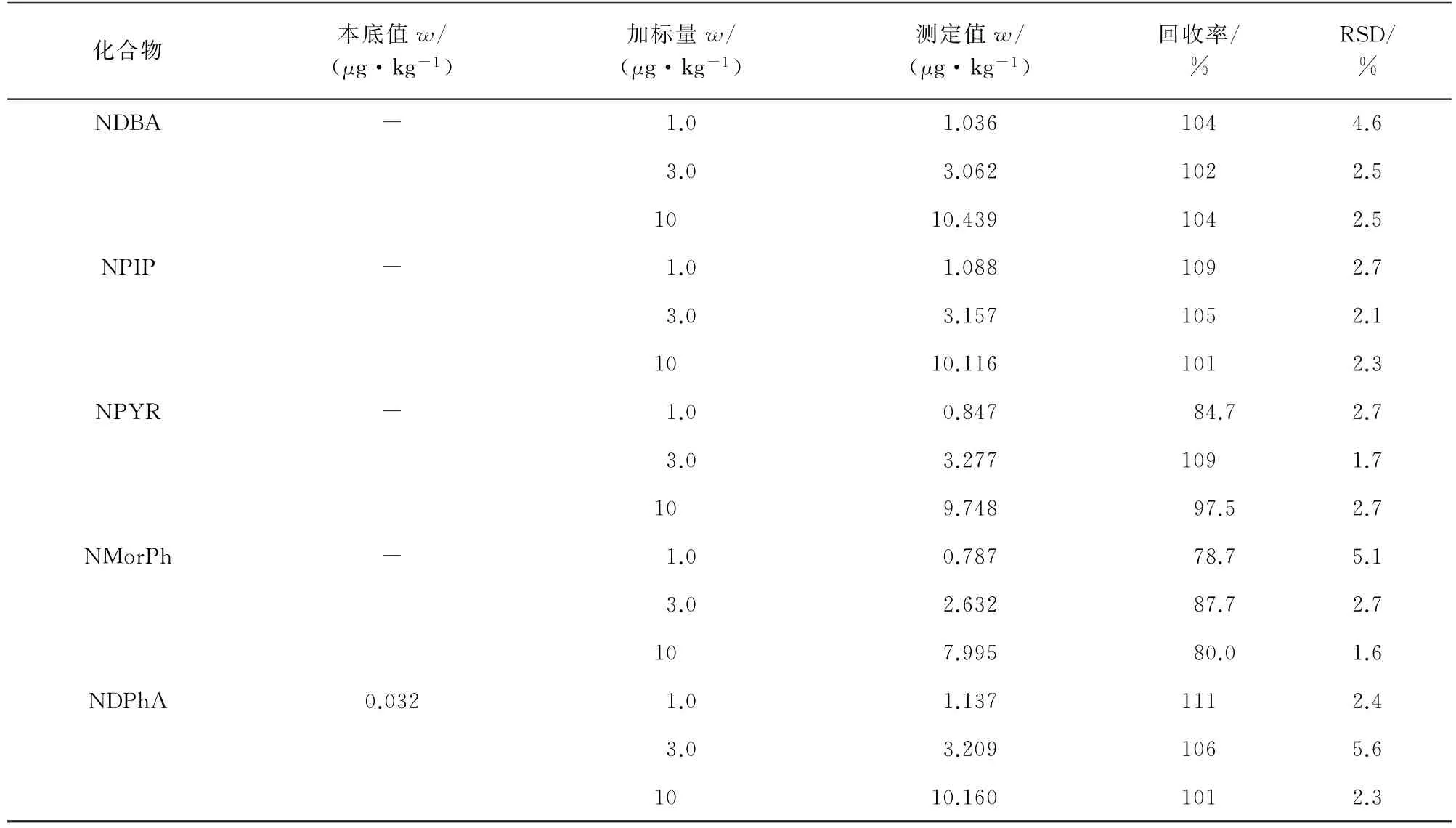
表3 (续)
由表3 可知:所得回收率为78.7%~124%,RSD 为1.3%~5.6%。
2.5 样品分析
采购市售牛奶样品10份,按试验方法测定样品中9种N-亚硝胺的含量,检测结果显示10份牛奶样品中NDMA、NDEA、NDPA、NDPh A 等4 种组分检出率分别为20%,60%,10%,70%,检出量为0.028~0.487μg·kg-1,其余N-亚硝胺化合物未检出。
本工作利用EMR-Lipid净化技术,建立了气相色谱-串联质谱法测定牛奶中9种N-亚硝胺含量的方法。该方法采用保留时间与MRM 扫描质谱双重定性、内标法定量,具有样品前处理简便、定性灵敏度高、定量准确度高的优点,适用于牛奶中9种N-亚硝胺组分的痕量分析。

