在线固相萃取-超高效液相色谱-串联质谱法测定尿液中芬太尼及其代谢物的含量
赵清佳,汪 蓉,徐智儒,盛振海,梁 晨,张玉荣∗
(1.中国医药工业研究总院 创新药物与制药工艺国家重点实验室,上海 200040;2.上海市公安局物证鉴定中心,上海市现场物证重点实验室,上海 200083)
芬太尼是强效的μ-阿片受体激动剂,其镇痛作用是吗啡的80倍,15 min起效,维持2 h,可产生欣快、呼吸抑制,大剂量产生肌肉僵直,用于各种原因引起的疼痛,但长期使用具有成瘾性。芬太尼的消除半衰期(t1/2)较短,以10μg·kg-1的剂量给药时,大鼠血液中的t1/2为3.72 h[1]。体内吸收后,尿液中芬太尼的原体或代谢物的浓度通常高于血液中的浓度,因此通过检测尿液中的原体或代谢物来判断吸食者的吸毒史,具有更高的参考价值,但目前对芬太尼代谢物检测时限的报道相对较少。
芬太尼主要在肝脏中被CYP450酶迅速代谢,去甲芬太尼为其主要的代谢物[2-3]。目前,生物检材中芬太尼的检测方法有均相免疫测定法[4-5]、气相色谱-质谱法[6-7]、液相色谱-串联质谱法[8-10]等。由于生物检材基质复杂,常常存在内源性杂质的干扰,为了延长色谱柱和仪器的使用寿命,提高目标物的检出限,在分析样品之前需要前处理。样品前处理常用的方法有液液萃取法(LLE)[10]、固相萃取法(SPE)[11]和蛋白质沉淀法(PP)[12]等。其中LLE和PP均存在耗时长、溶剂需求量大、污染环境等缺点,PP还会对色谱柱造成一定程度的损坏。而对于SPE研究显示[13],提供同样良好的检出限、准确度和精密度的情况下,离线SPE 需要手动活化、缓冲和淋洗等步骤,过程复杂。
本工作旨在开发一种在线固相萃取(on-line SPE)的前处理方法对尿液中的芬太尼和去甲芬太尼进行富集净化,建立一种前处理与检测全自动化的方法,同时将该方法用于研究芬太尼原体及其代谢物去甲芬太尼在大鼠体内的检测时限。该方法溶剂消耗少,人力需求低,且操作简便易行,可满足公安及司法部门对该物质监控的需求。
1 试验部分
1.1 仪器与试剂
Thermo UltiMate 3000 型双三元超高效液相色谱系统;TSQ Altis型三重四极杆质谱仪,配电喷雾离子源(ESI);Eppendorf AG 型离心机;Talboys型数显型漩涡混合器;BRANSON B3500S-MT 型超声波清洗器。
标准储备溶液:称取芬太尼和去甲芬太尼的对照品粉末10 mg,用甲醇溶解并稀释,分别定容至10 mL容量瓶中,配制成质量浓度均为1.00 g·L-1的芬太尼标准储备溶液和去甲芬太尼标准储备溶液。
混合标准溶液:移取芬太尼和去甲芬太尼的标准储备溶液适量,用甲醇逐级稀释,分别配制成质量浓度为1 mg·L-1、10μg·L-1和100 ng·L-1的混合标准溶液。
混合标准溶液系列:移取一定质量浓度的混合标准溶液适量,用甲醇逐级稀释,配制成质量浓度为20 ng·L-1、1,2,4,6,8μg·L-1的混合标准溶液系列。
2-(3-甲氧基苯基)-2-(乙基氨基)环己酮盐酸盐-d3(MXE-d3)内标储备溶液:称取MXE-d3对照品粉末10 mg,用甲醇溶解,转移至10 mL 容量瓶中,用甲醇定容,配制成质量浓度为1.00 g·L-1的MXE-d3内标储备溶液。
MXE-d3内标溶液:用甲醇稀释MXE-d3内标储备 溶 液,配制成 质 量 浓度为10 μg·L-1的MXE-d3内标溶液。
甲酸铵溶液:2 mmol·L-1,分别以甲酸和氨水调节p H,配制pH 4.2,7.0,9.2的2 mmol·L-1的甲酸铵溶液。
所有溶液在使用前均保存在4 ℃的冰箱中。
芬太尼、去甲芬太尼对照品的纯度大于99%;MXE-d3对照品的纯度大于99.5%;甲醇、甲酸和甲酸铵均为色谱纯;氨水为分析纯;超纯水由Purelab Ultra超纯水机制备。
1.2 仪器工作条件
1)在线固相萃取条件 Waters Oasis HLB固相萃取小柱(20 mm×2.1 mm,25μm);柱温20℃;进样量50μL;流量0.4 mL·min-1;前处理泵的流动相A 为甲醇,B为水(甲醇和水用来活化、平衡固相萃取小柱),C 为pH 9.2的2 mmol·L-1甲酸铵溶液(作为淋洗液)。梯度淋洗程序见表1。

表1 前处理泵的梯度淋洗程序Tab.1 Gradient elution program for pre-process pump
2)色谱条件[14]Thermo Fisher Hypersil GOLD C18分析柱(100 mm×2.1 mm,1.9μm);柱温50 ℃;进样量50μL;流量0.4 mL·min-1;分析泵的流动相D 为含2 mmol·L-1甲酸铵和0.1%(体积分数,下同)甲酸的水溶液;F 为含2 mmol·L-1甲酸铵和0.1%甲酸的甲醇溶液。梯度洗脱程序:0~4.00 min时,D 为90%;4.00~6.00 min时,D 由90% 降 至65%,保 留4.00 min;10.00~12.00 min时,D 由65% 降 至35%;12.00~12.50 min时,D 由35%升至90%,保留2.50 min。
3)质谱条件[14]ESI,正离子模式,选择离子监测(SRM)模式;离子传输管温度325 ℃,雾化器温度325 ℃;鞘气流量12 L·min-1,辅助气流量8 L·min-1。表2 列出了目标物和内标物的质谱参数。
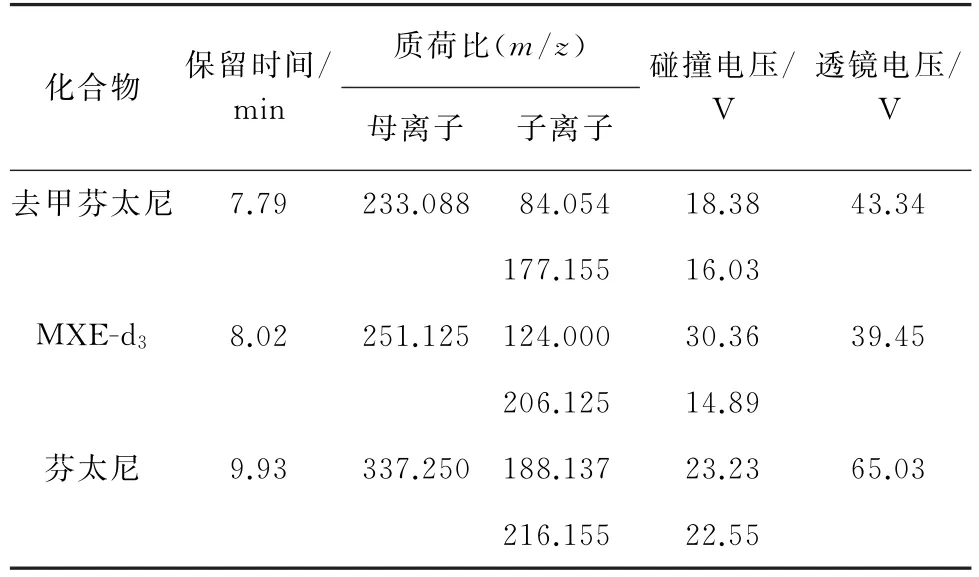
表2 质谱参数Tab.2 MS parameters
1.3 试验方法
1.3.1 样品制备和在线固相萃取
移取尿液样品200μL 至2.0 mL 离心管中,添加10μg·L-1MXE-d3内标溶液4μL,混匀,加入pH 9.2的2 mmol·L-1甲酸铵溶液200μL稀释,涡旋30 s后,以转速13 000 r·min-1离心10 min。移取上清液200μL置于进样小瓶中,单次上样50μL。
移取空白尿样180μL 至2.0 mL 离心管中,分别添加20μL混合标准溶液系列,配制成加标样品,其余步骤同上。
将上述制备的样品加至固相萃取小柱上,前处理泵和分析泵同时开启工作。0~2 min时,六通阀切换至6-1,用前处理泵的流动相洗脱固相萃取小柱,此时目标物被选择性地保留和纯化;2~4 min时,六通阀切换至2-1,此时分析泵与在线固相萃取小柱成串联模式,以分析泵的初始流动相将目标物从固相萃取小柱洗脱至分析柱上;4 min开始,再次将六通阀切换至6-1,用前处理泵清洗、再生固相萃取小柱,用分析泵分离目标物。整个程序由Xcalibular软件控制自动完成。在线固相萃取-超高效液相色谱-串联质谱(UHPLC-MS/MS)的流路图见图1。

图1 在线固相萃取-超高效液相色谱-串联质谱的流路图Fig.1 Diagram of on-line SPE combined with UHPLC-MS/MS
1.3.2 动物试验
试验动物:Sprague Dawley(SD)大鼠,雄性,质量200~230 g。
药液配制:移取1.00 g·L-1的芬太尼标准储备溶液40μL至15 mL 的微量离心管(EP 管)中,加0.9%氯化钠溶液至10 mL,配制成4 mg·L-1的溶液。
给药方法:SD 大鼠3 只,分别以20μg·kg-1的给药剂量尾静脉注射给药。
样本收集:给药后,分别于0,2,4,24,48,72,96,120,144,168,192,216,240,264,288,312,336,360,384,408,432,456,480,504,528,552,576,600,624,648,672 h收集尿液样本,编号,置于-40 ℃的冰箱冷冻保存。
2 结果与讨论
2.1 前处理泵的淋洗液及淋洗时间的选择
由于目标物是碱性化合物,为了抑制离子化效应,同时减少淋洗过程中目标物的流失,试验分别以pH 7.0的2,5,10 mmol·L-1的甲酸铵溶液和pH 9.2的2,5,10 mmol·L-1的甲酸铵溶液为淋洗液清洗基质中极性较强的杂质。芬太尼和去甲芬太尼在采用不同淋洗液时的响应值见图2。
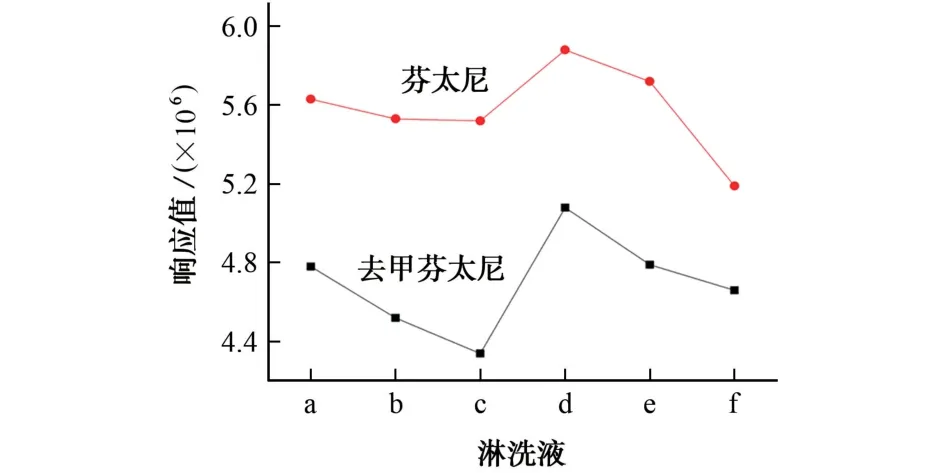
图2 目标物在采用不同淋洗液时的响应值Fig.2 Response values of the target compounds by using different eluants
结果表明:固相萃取小柱在6种淋洗液条件下均能很好地萃取到目标物。但以pH 9.2 的2 mmol·L-1甲酸铵溶液为淋洗液时,目标物具有更优的峰形和更高的响应值,5μg·L-1的尿液加标样品中,芬太尼和去甲芬太尼的响应值分别为5.88×106和5.08×106。因 此,选 择pH 9.2 的2 mmol·L-1甲酸铵溶液作为淋洗液。
将通过在线固相萃取小柱后的废液直接连接至质谱检测器,发现采用该淋洗液进行淋洗,5 min内色谱图无目标物出峰,说明无目标物的流失。设置为全扫描模式,发现在2 min前有杂质出峰,2 min后无其他杂峰出现,表明该淋洗液在2 min内足以将基质中的杂质清洗干净,因此将淋洗时间设置为2 min。
2.2 洗脱程序的选择
为了快速将目标物转移至分析柱,减少谱带的展宽,试验采用反冲的方式将目标物转移至分析柱。试验发现,分析流路的初始流动相即可将所有目标物洗脱至分析柱。将流路中的分析柱拆去,用两通替代,色谱出峰时间在3.6 min内,据此可以确定阀切换的时间应该略晚,因此将阀切换时间设置在4 min时切换固相萃取小柱,确保目标物全部进入分析流路。然后以分析泵的流动相对分析柱上的目标物进行梯度洗脱,同时前处理泵对在线固相萃取小柱进行清洗再生、活化和平衡,二者互不干扰,缩短了分析时间。通过上述色谱条件与阀切换时间的优化后,目标物可获得较好的分离效果。
2.3 样品稀释液的酸度的影响
正常新鲜尿液的pH 为4.5~7.9,而试验中的目标物为碱性物质,因此有必要考察样品稀释液的酸度对目标物测定的影响。试验分别采用pH 为4.2(酸性),7.0(中性),9.2(碱性)的2 mmol·L-1甲酸铵溶液作为样品稀释液,考察了其萃取效果的影响。芬太尼和去甲芬太尼在不同酸度的样品稀释液下的响应值见图3。
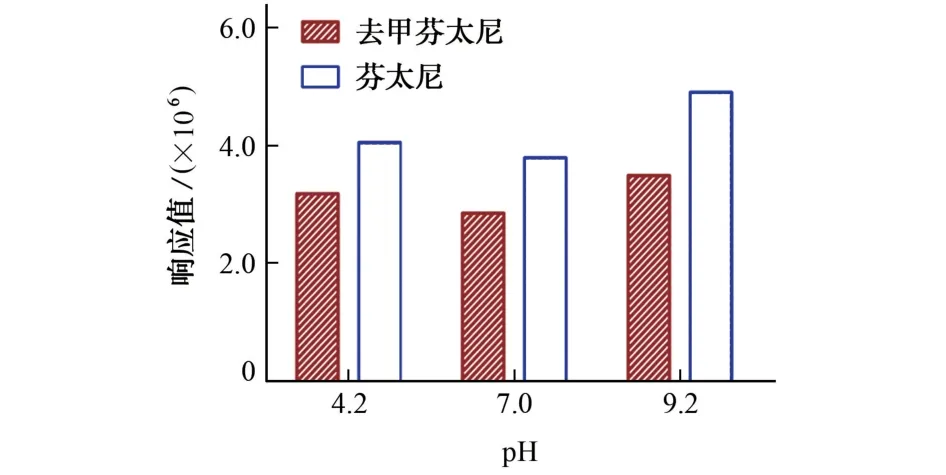
图3 目标物在不同酸度的样品稀释液下的响应值Fig.3 Response values of the target compounds in dilute solutions at different acidity
结果表明:SPE色谱柱在不同酸度的样品稀释液下均能很好地萃取到芬太尼和去甲芬太尼。相比之下,使用碱性样品稀释液时,目标物解离减少,更多的保留在固相萃取小柱上,因而具有更高的响应值。因此,选择pH 9.2的2 mmol·L-1甲酸铵溶液作为样品稀释液。
2.4 方法的专属性
收集6份来自不同健康志愿者的空白尿液样本,并按试验方法进行处理分析,检测背景响应,结果显示空白样品中目标物和内标物均无干扰。芬太尼、去甲芬太尼和内标MXE-d3的保留时间分别为9.94,7.79,8.02 min,400 ng·L-1的质控样品及200ng·L-1的MXE-d3内标溶液的色谱图见图4。

图4 目标物和内标物的色谱图Fig.4 Chromatograms of the target compounds and internal standard
仪器通过高含量样品后进空白样品来估计色谱柱的残留情况。结果表明,通过高含量样品后,芬太尼不存在残留;去甲芬太尼有少量残留但通过1针空白样品清洗后可以消除。
2.5 基质效应、标准曲线与检出限
由于在线前处理的系统设计不能直接得到固相萃取后目标物的回收率[13,15],按照《中华人民共和国药典》2015年版中在线前处理样品的基质效应的考察方法,本试验收集6批不同健康志愿者的空白尿液,分别添加低、高浓度水平的芬太尼和去甲芬太尼,制得基质匹配的混合标准溶液,按试验方法进行预处理和进样分析,考察目标物的响应的总变异系数。总变异系数=标准偏差/平均值×100%,若总变异系数不大于15%,说明基质无干扰。结果显示:6批样品中,芬太尼的响应的总变异系数不大于2.5%,去甲芬太尼响应的总变异系数不大于7.1%,均符合要求,说明基质对样品测定无影响。
配制芬太尼和去甲芬太尼的质量浓度分别为2.00,100,200,400,600,800 ng·L-1的混合标准溶液系列,按照试验方法进样分析。以目标物的质量浓度为横坐标,对应的峰面积为纵坐标绘制标准曲线,其线性范围、线性回归方程和相关系数见表3。

表3 线性参数Tab.3 Linearity parameters
检出限定义为信噪比(S/N)不小于3的最低目标物的质量浓度,测定下限定义为信噪比不小于10的最低目标物的质量浓度。结果显示,在优化的色谱条件下,芬太尼和去甲芬太尼的检出限(3S/N)均为0.200 ng·L-1,测定下限(10S/N)均为2.00 ng·L-1。该方法的检出限高于文献[16]报道的芬太尼的最高检出限(0.003μg·L-1)。
2.6 精密度和回收试验
分别将测定下限、低、中、高等4个浓度水平的混合标准溶液进行预处理和进样分析。当天制备样品,每个浓度水平平行测定5次,计算得到回收率和测定值的相对标准偏差(RSD),考察日内精密度。连续3 d同一时间测定混合标准溶液,计算得到回收率和测定值的RSD,考察日间精密度(《中华人民共和国药典》2015 年版仅监测2 d),所得结果见表4。
由表4可知:测定值的RSD 均小于15%,说明方法的精密度较好。
2.7 稳定性试验和稀释效应
按试验方法测定低、高浓度水平的混合标准溶液,每个浓度水平平行测定3次来评估样品的稳定性。由于SD 大鼠体内代谢后目标物的浓度远远超过线性范围,因此分别设定稀释因子1 为稀释2 000倍、稀释因子2为稀释200倍和稀释因子3为稀释20倍,每组平行测定5次,来考察方法的稀释可靠性。结果表明,芬太尼和去甲芬太尼的短期稳定性(室温放置4 h)、预处理后自动进样盘中的稳定性(放置24 h)、冻融稳定性(每隔24 h,室温解冻20 min,再放入-40 ℃冷冻保存,循环3次)、长期稳定性(-40 ℃冷冻保存10 d)的测定值的RSD 均小于14%,稀释可靠性的测定值的RSD 均小于3%。说明在考察的稀释倍数范围内,其基质不影响结果的精密度,稀释具有可靠性。
2.8 SD大鼠尿液中芬太尼原体和代谢物去甲芬太尼的检测时限
芬太尼原体在SD 大鼠体内2 h时达到最高,最高量 为112.66 μg·L-1,24h时迅速下降至2.58μg·L-1,芬太尼原体在1号和2号SD 大鼠体内的检测时限为5 d,第6 d阴性;在3号SD 大鼠体内的检测时限为7 d,第8 d阴性。代谢物去甲芬太尼在SD 大鼠体内4 h 时达到最高,最高量为1.6 mg·L-1,之后迅速下降,缓慢消除,去甲芬太尼在1号SD 大鼠检测时限为26 d,第27 d阴性,在2号SD 大鼠的检测时限为25 d,第26 d阴性,在3号SD 大鼠内的检测时限为28 d,第29 d阴性。结果表明,去甲芬太尼在体内的消除期缓慢且较长,检测时限远远超过了芬太尼原体,对于吸入更大剂量芬太尼的吸食者来说,可能会需要更长的检测时间。
相对于已报道的文献[16-17],本方法具有更高的灵敏度,因此芬太尼原体的检测时限由3 d延长至7 d,去甲芬太尼28 d的检测时限也尚未见过报道。SD 大鼠尿液中芬太尼原体和代谢物去甲芬太尼的浓度-时间曲线如图5所示。
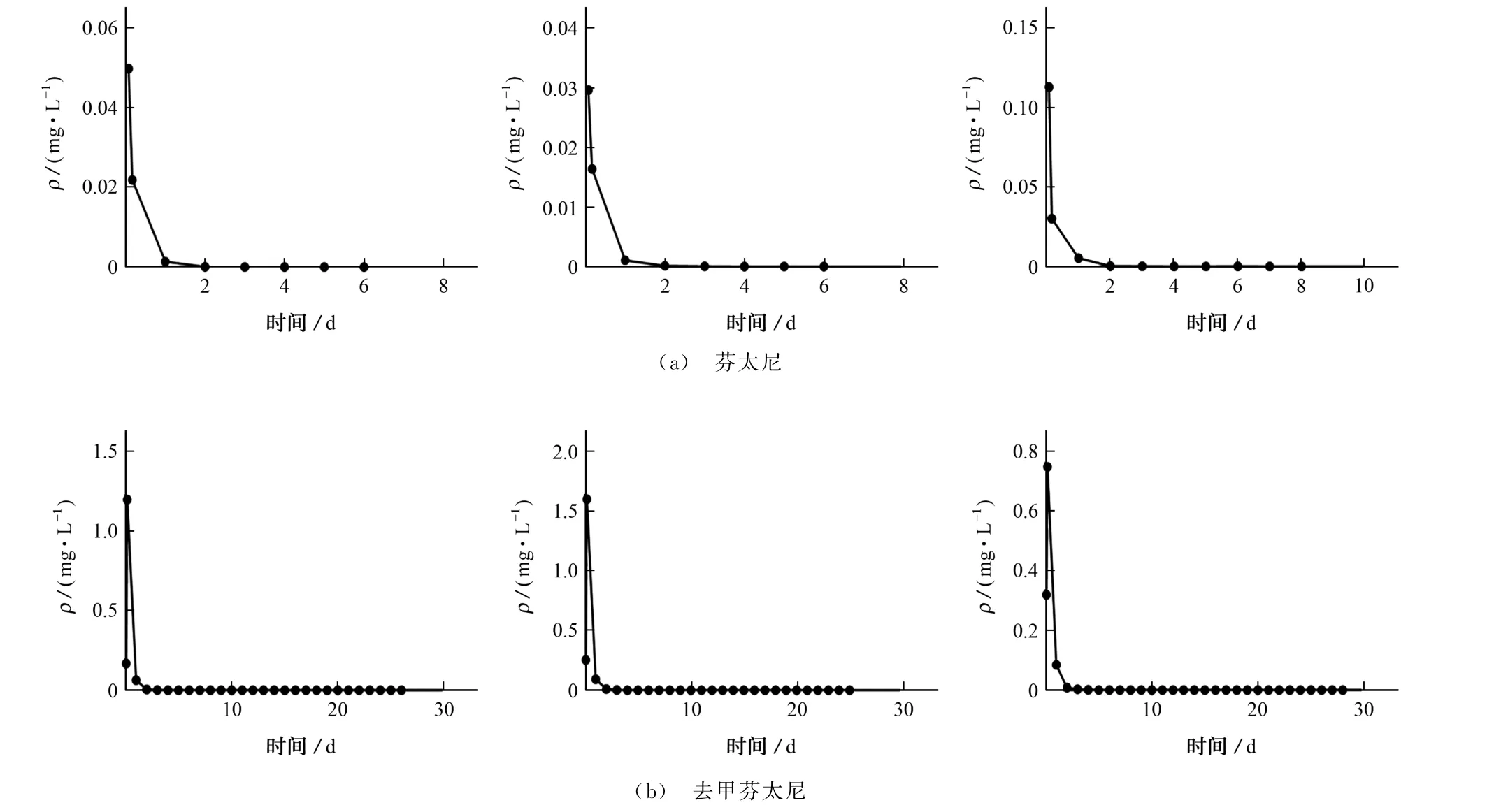
图5 大鼠尿液中芬太尼原体和代谢物的浓度-时间曲线Fig.5 Concentration-time curves of fentanyl prototype and its metabolite in rat urine
本工作通过建立在线固相萃取的前处理方法,优化了程序设计、淋洗液、样品稀释液的酸度等条件,建立了完整的在线固相萃取技术结合超高效液相色谱-串联质谱的分析方法,进行了动物试验并发现去甲芬太尼长达28 d的检测时限。该方法操作简单,自动化程度高,分析结果良好,可为公安及司法部门判断当事人是否吸食芬太尼提供参考。

