基于核心素养发展的项目教学
——以“CO2资源化利用”为例
苏 芹 佘晓敏
(厦门双十中学,福建 厦门 361005)
常规高三化学复习往往是以知识梳理、习题讲练为主的教学模式,师生在多轮次的讲评练中逐渐丧失了教与学的激情,课堂逐渐空洞枯燥乏味,再提升的空间小。为提高高三二轮复习的有效性,本案例以社会热点温室气体CO2的资源化利用的研究应用展开项目教学活动,在复杂陌生的问题情境中,学生从类价二维、方向、限度、速率、条件和能量转化等多认识角度系统分析物质和反应,构建动力学热力学分析解决问题的思维模型,实现知识、问题的结构化和解题思路化,提高了迁移创新能力。[1]
一、项目教学主题分析
本课程是鲁教版化学反应原理模块的第二章化学反应的方向、限度和速率的专题式高三二轮复习。
“CO2的资源化利用”是社会热点也是科技前沿的世界性科研热点,以此新素材为项目课题,立足于CO2这一耳熟能详的常规典型的物质,辩证地引导学生认识到CO2不仅是温室气体,更是潜在的碳资源,探索其能源价值这一未知领域,能极大地激发学生的学习兴趣与探索渴望。科学研究表明,从大规模利用角度考虑,CO2合成CH3OH、HCOOH、CH3、CH2OH、CO 和CH4等反应最具研究价值,尤其是CH3OH 和CH4的能源价值非常显著。[2]CO2结构很稳定,活化CO2分子所需的能量来源于电能、高温或其他活泼原料的化学能,转化反应中最重要的就是高选择性的催化剂的选择,研究过程承载了热力学动力学的核心知识内容,符合课程标准的规定和价值导向。课程内容选择研究较多理论较成熟CO2催化加氢还原制备CH3OH 反应条件的选择与优化[3]、CO2-CH4化重整反应中积炭问题解决[4]两方面的内容,从物质、反应、能量多角度组织学生开展关于反应路线设计、反应方向判断、反应条件的选择与优化的讨论,有效地促使学生形成从方向、限度、速率、能耗和条件等多角度综合调控化学反应的基本思路,培养能量观、变化观念素养;在积炭问题研究过程中,通过催化剂调控反应速率体验利用活化能理论实现反应调控,综合应用多种视角解决真实问题,培养证据推理素养,发展学生“绿色化学”的观念和辩证思维的能力。
二、项目学习规划
(一)项目学习设计思路
基于学生的学生认知发展和学生的能力发展水平及知识的逻辑顺序、实际问题的解决过程,项目活动以“CO2资源化利用”的从理想转化到实际转化再到工业生产的研究过程为情景线索,通过CO2合成CH3OH 反应路线设计、CO2加氢还原制取CH3OH 的反应条件选择、CO2-CH4催化重整积炭问题解决三个主题问题解决活动,引导学生从物质、反应、能量的多重认识角度,运用价-类二维、热力学和动力学原理综合解决问题,梳理核心知识的同时自主构建思维模型,实现复习课程的教学目标。
(二)项目任务及教学流程(见表1)
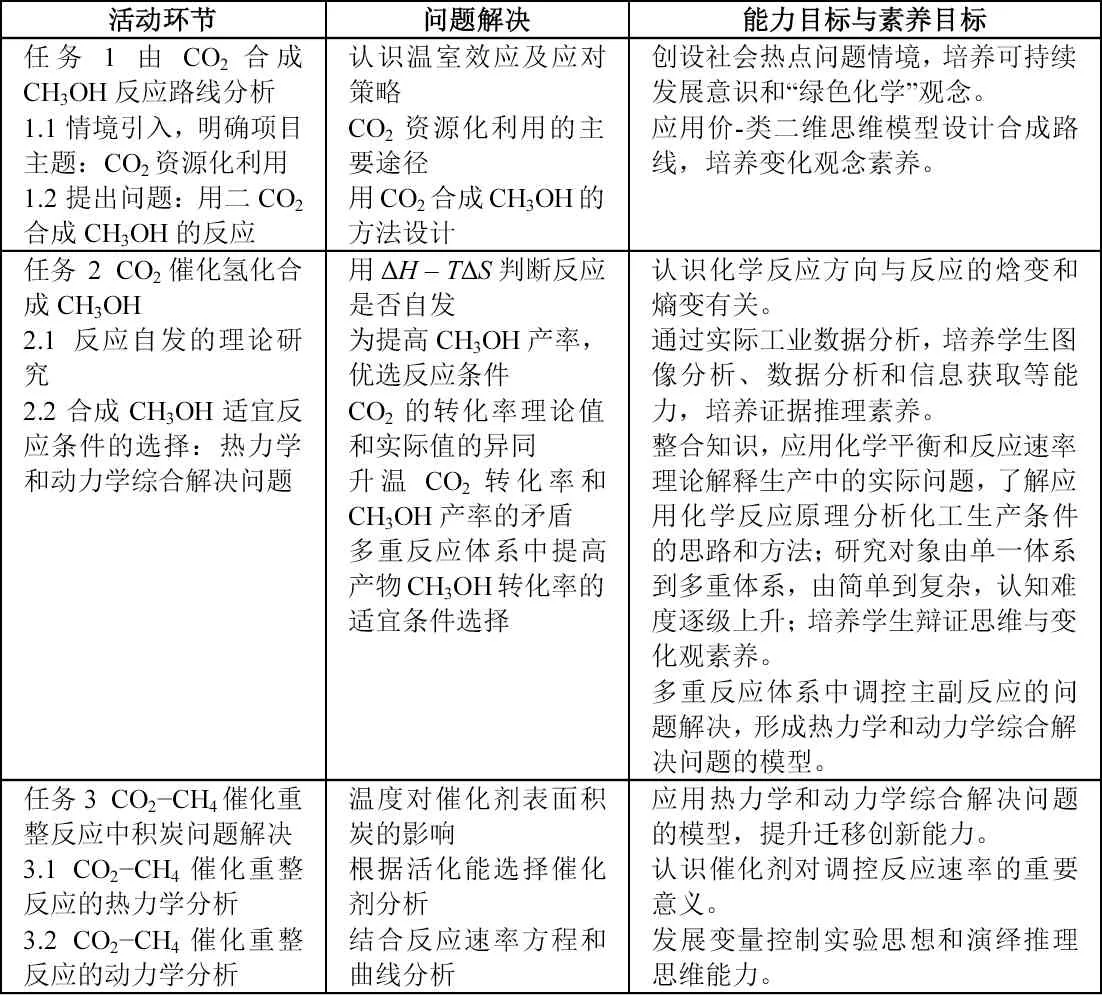
表1 教学流程图
三、项目实施过程及教学成果
项目教学实施过程实录如下:
[任务1]由CO2合成CH3OH 路线分析
【引入】多媒体展示温室效应的图片,引导学生提出应对分析全球变暖问题的途径,多角度认知CO2既是温室气体又是潜在的碳资源。介绍CO2资源化的主要转化途径。
【布置任务】任务1:如何将CO2合成CH3OH?尝试写出合理的反应方程式。
【学生观点】对比反应物CO2和生成物CH3OH 的组成,应该选择含氢元素的物质H2和CO2反应。反应方程式为CO2+3H2====CH3OH+H2O。
【教师追问】为什么不选择自然界存在更多的H2O 呢?
【学生回答】因为CO2生成CH3OH 的变化过程中碳元素化合价降低,从价态的角度来看反应还需要还原剂,H2具有还原性,H2O 不具备,应该选择H2。
【教师概括分析思路和角度】回答很准确。分析物质转化时应从类别和价态两个角度即“类价二维”的角度进行分析,找出合理的反应路径。
[任务2]CO2催化氢化合成CH3OH 的条件选择
【教师给出反应的热化学方程式,设问】设计完反应方程式之后,如何判断反应能否发生呢?请根据热化学方程式CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH=-49.01kJ·mol-1进行判断。
【学生根据反应的特点回答】根据ΔH-TΔS 是否小于0 进行判断。是放热熵减的反应,低温条件下反应可以发生。
【教师概括分析角度和思路,追问】回答得很好,该反应的特点是正向气体系数减小,ΔH<0,ΔS<0,低温条件下有利于反应的发生。根据理论计算证明反应确实可以发生。那什么条件有利于CH3OH 的合成?并说出你的判断依据。
【学生根据反应的特点回答】该反应ΔH<0,ΔS<0,降低温度、增大压强和增大H2的浓度都有利于提高CO2的转化率。
【教师追问】工业上为了获得较高的CH3OH 产率,需要控制合适的反应条件。同学们根据反应的特点提出低温高压有利于提高反应的限度,在实际工业生产中是不是如此呢?
【布置任务:提高合成CH3OH 的产率的适宜条件选择分析】请根据材料1 和材料2 完成以下任务:
材料1:CO2(C=O 的键能为799kJ·mol-1)自身很稳定,活化CO2分子所需的能量很高,需要使用催化剂加快反应速率。目前生产CH3OH 所用催化剂主要有2大类,一类是以Cu 为主要活性成分的Cu 基催化剂,另一类是以贵金属作为主要活性成分的催化剂。
材料2:一个采用Cu 基催化剂的研究实例中,CO2和H2体积比为1:3,一定气体流速(提示:反应时间一定):温度为523K,CO2的转化率和CH3OH 产率随压强变化如下图1 所示;压强为5MPa,CO2的转化率和CH3OH 的产率随压强变化如下图2 所示[3]:

图1 反应压强与CO2转化率/CH3OH 产率的关系
请分析:①根据图2 分析CO2的实际转化率和CO2理论转化率不匹配的原因:
②根据图2 分析CO2的实际转化率高于CH3OH 的实际产率的原因:
③你认为通过控制哪些条件来提高合成CH3OH的产率?
【学生以4 人小组的方式展开讨论,填写学案,并汇报交流】
【学生观点1】通过读图分析,CH3OH 的适宜条件是高压,523K,采用比较便宜的铜基催化剂。图2 分析CO2的实际转化率和CO2理论转化率不匹配的原因是温度低于523K 时反应速度比较慢,反应时间固定时,未达到平衡,所以CO2的实际转化率低于CO2理论转化率。CO2的实际转化率高于CH3OH 的实际产率的是因为存在副反应。

图2 反应温度与CO2转化率/CH3OH 产率的关系
【学生观点2】还应该考虑设备的耐压问题,应该选择适当的高压,不能无限高压。
【教师概括总结,理顺思路并追问】两组同学分析都很好,选择条件不仅考虑了反应的特点、工业数据分析还想到了造价的问题。根据图一可知CO2的转化率和CH3OH 的产率与理想状态随压强变化变化趋势一致,增大压强有利于反应,但考虑工业实际选择5~10MPa 较好[4]。图二中CO2的转化率和CH3OH 的产率与理想状态随温度变化变化趋势不一致,低温数值较小,说明低温反应速率较小,说明热力学分析得出的理论数值反映的是反应趋势,并不代表反应实际生产情况;实际工业生产不仅要考虑反应限度也需要考虑反应速率问题,速率往往是决定性因素。温度约为523K 时CH3OH 转化率最高。CO2的转化率高于CH3OH 的产率,说明副反应也会影响CH3OH 的转化率。在CO2加氢制CH3OH 的反应体系中,若不考虑生成的烯烃和较高碳醇等副反应,主要的化学反应如下:
主反应:CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)ΔH=-49.01kJ·mol-1
副反应:CO2(g)+H2(g)⇌CO(g)+H2O(g)ΔH=+41.17kJ·mol-1
请综合反应体系的主副反应特点再次分析,什么条件下有利于主反应发生?并说明理由。
【学生观点】主反应为分子数减小的反应,而副反应为分子数不变的反应,因此增大体系的压强有助于生成CH3OH 的主反应正向移动,而对生成CO 的副反应没有影响。主反应ΔH<0,副反应ΔH>0,低温有利。但是低温反应速率比较低,目前还想不到解决方法。
【教师补充,拓展,提供知识支持】对于主副反应的调控,热力学不占优势的反应,可控制动力学占优势,即使用优良的催化剂。我国科学家研制了一种双金属固溶体氧化物催化剂,实现了CO2高选择性高稳定性加氢合成CH3OH。[7]
【教师概括分析角度和思维,建立热力学和动力学综合解决问题的模型并板书】(见图3)
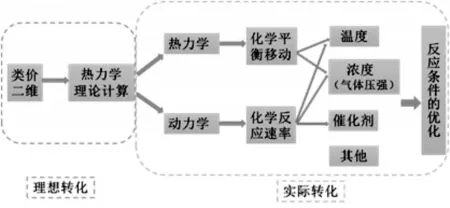
图3
[任务3]CH4-CO2催化重整反应中积炭问题解决—应用模型
【衔接,教师讲解,提出问题】CO2化学资源化利用存在争议:消耗大量的H2;消耗能量经济性不高。若将还原剂换为自然存储量大的另一典型温室气体CH4便可解决氢源困扰,同时CH4与CO2催化重整反应产生H2与CO 可直接作为深度转化的碳基合成及费托合成的理想原料。(多媒体展示我国CH4-CO2重整技术研发获重要突破新闻)工业生产中采用了相对丰富而廉价的Ni 基催化剂,催化活性较好,但是积炭严重;积炭会破坏催化剂结构,造成催化剂失活。请大家思考如何通过调整反应条件解决积炭问题呢?
【布置任务】请同学们结合CO2-CH4重整反应涉及的主要反应[7-8],思考温度如何影响催化剂表面积炭的形成?
主反应:CO2(g)+CH4(g)======2CO(g)+2H2(g)ΔH=+247kJ·mol-1
逆水蒸气变换:CO2(g)+H2(g)======H2O(g)+CO(g)ΔH=+41kJ·mol-1
CH4裂 解:CH4(g)======C(s)+2H2(g)ΔH=+75kJ·mol-1
CO 歧 化:2CO(g)======C(s)+CO2(g)ΔH=-172kJ·mol-1
【学生先独立思考,后以小组的方式展开讨论,填写学案,并汇报交流】
【学生观点,提出疑惑】CO2-CH4 重整主反应为吸热反应、气体系数和增加的反应,升温及减压有利于平衡正向进行。但是高温也有利于CH4裂解反应生成积炭;同时,有利于消炭反应的发生。
【教师梳理分析思路,追问】不仅要考虑反应限度的影响也要考虑反应速率的影响;可以采用合适的催化剂调整消炭的速度大于积炭的速度,就能解决积炭问题了。[8]请大家结合给出的材料3 选择合适催化剂并说明理由。
材料3:CO2-CH4重整反应中相关数据(见表2)

表2 CO2-CH4重整反应中在催化剂X和催化剂Y上的活化能
【学生分组讨论,填写学案,并汇报交流】
【学生观点】选择催化剂Y,积炭反应活化能比较大,同时消炭反应的活化能比较小。
【教师分析学生的思路,评价,追问】该催化剂适宜的使用温度是如何选择呢?请结合材料4 作答。
材料4:在反应进料气组成、压强及反应时间相同的情况下,催化剂表面的积炭量随温度的变化关系见图4。

图4 催化剂表面的积炭量随温度的变化关系
【学生分组讨论,填写学案,并汇报交流】
【学生观点】温度大于600℃,因为此时积炭量是减少的,消炭速度大于积炭速度。但不确定该如何选择,虽然高温有利于主反应但是高温也会耗能。
【教师概括评价,追问】回答得非常棒!通过图像分析可知,升高温度时,下列关于积碳反应、消碳反应的平衡常数K 积、K 消和反应速率v 积、v 消均增加,但是v 消增加的倍数比v 积增加的倍数大,当温度大于600℃,积炭量减少,消炭速度大于积炭速度。所以适当的高温是有利于在该条件下减少积炭的,当然也利于提高CO2-CH4重整反应合成气的产率。影响反应速率的因素不仅有温度和催化剂,还有浓度即气体分压。请根据材料反应速率方程和图像分析CO2-CH4催化重整中p(CH4)和p(CO2)相对大小的选择。
材料5:在一定温度下,测得某催化剂上沉积炭的生成速率方程为v=k·p(CH4)·[p(CO2)]-0.5(k 为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图5 所示,则将pa(CO2)、pb(CO2)、pc(CO2)按从大到小的顺序排列。

图5 p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势
【学生分组讨论,填写学案,并汇报交流】
【学生观点】根据反应速率方程可知,沉积炭生成速率随p(CO2)的升高而降低,所以pa(CO2) 【教师评价,并概括总结】非常好。反应速率方程定量描述了气体分压对反应速率的影响,我们要注意研究过程中的变量控制,即对于该催化剂,p(CH4)一定时,提高p(CO2)有利于减慢沉积炭反应的发生。 【教师概括总结,并对热力学和动力学综合解决问题的模型从定量的角度再提升并板书】(见图6) 图6 【教师提出问题,辩证看待CO2资源化利用】通过CO2-CH4重整反应解决了CO2资源化利用过程中的耗氢问题,但是反应还是在高温下进行的,耗能问题仍然没有解决。请大家大胆设想,并提出你的建议。 【学生观点】寻找还原性物质和CO2构成原电池,就能解决这一问题,还可以提供能量。 【教师评价,梳理提升】非常棒。这也是CO2资源化利用的一个很重要的方向,科学研究表明采用金属CO2电池不但可以将CO2资源化利用,减少化石燃料的消耗,还能够作为未来火星移民的潜在能源存储体系,因为火星表面大气中CO2的含量高达95%左右。近日南开大学的课题组利用廉价的NaCO3和碳纳米管制备出无Na 预填装“可呼吸”Na-CO2电池[9]。从能源的角度可以考虑该换能源的形式,比如光能、风能等绿色可持续发展的能源。(多媒体展示在化学链法制合成气方面取得新进展)最新研究成果对能源问题研究有了新的进展:以光能为能源,利用反应过程中铁基钙钛矿和FeO/氧化物间的智能切换,实现由CH4或H2O-CO2高选择性制备合成气(H2/CO=2)[10]。这就是化学的魅力,只要不懈追求就能将不可能变为可能,化腐朽为神奇。课堂到此结束,但是对CO2的资源化利用的探索并没有结束,欢迎同学们利用课余时间查阅相关文献关注CO2的最新科研进展。 学生经历了化学反应从理想转化到实际转化再到工业生产的整个过程,将学到的知识应用于解决实际问题,感到受学有所用、学有所获,充分体验学习成功的乐趣。通过对生产中真实问题解决,使学生体会到化学对于提高人类生活质量、促进社会发展的作用,激发学生学习化学的热情。教学过程中通过多篇我国科学家最新的研究成果,展示了科技创新发展的魅力,让学生感受中国的发展不仅仅是经济的进步,在一些领域科学研究水平也逐步达到了世界领先水平。在解决项目式学习过程中任务过程中,学生不断拆解问题,构建问题解决模型,实现了复习课“现知识、问题的结构化和解题思路化”的教学目标,同时多方面提升了学生分析问题解决问题的能力、创新意识、证据推理能力。
四、结语

