西方蜜蜂囊状幼虫病病毒云南毒株的多聚蛋白基因扩增及序列分析
曹兰,沈克飞,王瑞生,张邑帆,高丽娇,张祖芸,曹联飞
1.重庆市畜牧科学院,重庆402460;2.云南省农业科学院,云南红河 661101;3.浙江省农业科学院,浙江杭州310021
囊状幼虫病病毒(sacbrood virus,SBV)是危害蜜蜂健康的主要病毒之一,在各国普遍流行[1]。SBV感染能造成幼虫死亡或不能成蛹,缩短成蜂寿命,影响蜂群群势[2]。相对于西方蜜蜂(Apis mellifera),包括中华蜜蜂(Apis cerana cerana)在内的东方蜜蜂(A.cerana)对SBV 更易感,感染产生典型症状,所造成的危害更大[3]。SBV 为单股正链昆虫小RNA样病毒(picorna-like virus),现被划入传染性软化病病毒属(Iflavirus)。基因组除去Poly A 尾后约含8 830 个碱基,G / C 含量低(约占 37%),仅有 1 个大的开放阅读框架(open reading franme,ORF),约占基因组长度的97%,编码约2 860 个氨基酸残基的多聚蛋白(polyprotein)。在病毒自身编码蛋白酶的作用下,多聚蛋白氨基端剪切、加工产生成熟的结构蛋白,羧基端剪切、加工产生为非结构蛋白,包括RNA解旋酶、RNA 依赖的 RNA 聚合酶(RNA-dependent RNA polymerase,RdRp)及蛋白酶。
SBV 主要包含2 大基因型,即亚洲及欧洲基因型(或称东方及西方蜜蜂基因型),分别感染东方及西方蜜蜂[3-5]。分子进化研究发现,一些在亚洲饲养的西方蜜蜂感染的SBV(AmSBV)属亚洲基因型[6-8]。这些属亚洲基因型的AmSBV 中,或是亚洲与西方基因型毒株的重组体,或是与同亚型的东方蜜蜂的SBV(AcSBV)在基因组水平上具有高度相似性[8-10]。人工感染试验证实,AcSBV 能感染西方蜜蜂,在成蜂及幼虫中均能检出AcSBV[11-12]。
目前,GenBank 上公布来自自然感染的中国西方蜜蜂的SBV(AmSBV-Chn)序列仅有1 株全基因组序列(登录号:MG733283),其与AcSBV 有高同源性,属亚洲基因型[13]。另外,GenBank 上还公布了多株SBV 的RdRp 基因序列,建立在RdRp 基因的分子进化分析得出AmSBV-Chn 属亚洲基因型[14]。
本研究采用RT-PCR 方法从自然感染SBV 的云南西方蜜蜂幼虫样本中分段扩增SBV 多聚蛋白基因,进行序列测定及序列分析,在多聚蛋白基因水平上分析分子进化关系,以更全面地展示目的基因的分子特性和SBV 遗传多样性,为进一步研究SBV 与宿主的相互作用奠定基础。
1 材料与方法
1.1 样本、菌株及载体 3 份西方蜜蜂幼虫样本于2017 年3 月份采自云南省红河,经RT-PCR 检测为SBV 阳性[15];感受态大肠埃希菌 DH5α 购自天根生化科技(北京)有限公司;pMD18-T 载体购自宝日医生物技术(北京)有限公司。
1.2 主要试剂 rTap 酶、MineBEST Viral RNA / DNA Extraction Kit 及 PrimeScript RT-PCR Kit 试剂盒均购自宝日医生物技术(北京)有限公司;凝胶回收试剂盒购自天根生化科技(北京)有限公司。
1.3 引物设计及合成 使用文献[8]及[16]中的引物对3 份样本进行RT-PCR 扩增,将得到的片段进行序列测定及比对,经BLAST 分析所得片段区域与GenBank 登录号 AF469603、KP296800、KJ959613 及AF092924 的SBV 基因组序列有高同源性,根据这些序列设计扩增引物。引物序列见表1。引物由生工生物工程(上海)股份有限公司合成。

表1 扩增SBV 基因组的引物Tab.1 Primers for amplification of SBV genome
1.4 SBV 基因组的扩增 采用RT-PCR。将3 份冷冻样本解冻,取50 ~100 μL 样本渗出液,按Mine BEST Viral RNA / DNA Extraction Kit 试剂盒说明书提取总RNA。使用PrimeScript RT-PCR Kit 试剂盒及随机引物Random 6 mers,以提取的RNA 为模板反转录合成cDNA 第1 条链,以cDNA 为模板进行常规 PCR 扩增,反应条件:94 ℃ 2 min;94 ℃ 30 s,退火30 s(退火温度按引物的理论退火温度作适当调整),72 ℃延伸(时间按扩增片段大小作适当调整),共30 个循环;72 ℃再延伸10 min。反应结束后加入 10 μL 6 × Loading Buffer,PCR 产物进行 1%琼脂糖凝胶电泳(含5% Goldview 核酸染料)分析。
1.5 序列测定 按DNA 凝胶回收试剂盒说明书回收1.4 项的目的片段。使用扩增目的条带的引物对回收的目的条带进行双向测序。将不能顺利测序或达不到拼接要求的目的产物克隆至pMD18-T 载体中,转化大肠埃希菌DH5α 感受态细胞,培养转化子,用pMD18-T 载体上的通用引物M13+ / M13-筛选克隆有目的片段的阳性克隆,用引物M13+ / M13-对插入片段进行双向序列测定。若片段过长,则根据已测得的序列设计测序引物,对不能完全配对的部分序列重新进行测序。
1.6 序列拼接及比对、重组、分子进化分析 将已测定序列在NCBI 上用BLAST 搜索,进行同源性分析,并找出序列同源部分;使用DNAMAN 8 转换DNA 双链中的反向互补链,通过序列比对查找正反双链完全配对的2 条序列的首尾重叠部分,删除1条序列3′端的重叠部分与对应的另1 条序列的5′连接,依次将分段扩增的序列进行拼接,以得到SBV多聚蛋白基因序列。使用核苷酸序列翻译软件Translate(http:/ / web.expasy.org / translate /)翻译所得片段,用 ClustalW 2 软件(http:/ / www.ebi.ac.uk /Tools / msa / clustalo /)对该序列及其与 GenBank 公布的SBV 基因组序列或多聚蛋白基因序列进行多序列比对分析;用RDP 4 软件对该序列与GenBank公布基因组序列或多聚蛋白基因序列的SBV 进行重组分析;采用MEGA 4 软件的邻接法(neighborjoining method,NJ)基于多聚蛋白基因及RdRp 基因构建SBV 的分子进化树。
2 结 果
2.1 目的基因扩增产物的鉴定 经1%琼脂糖凝胶电泳分析,RT-PCR 扩增得到13 条与预期大小相同的目的基因片段(电泳图略)。
2.2 序列拼接 序列测定及BLAST 分析显示所有目的片段仅与SBV 有同源性,表明扩增到可覆盖SBV 完整多聚蛋白基因的目的片段。经序列拼接,得到3 条长8 736 nt 的SBV 序列(标记为AmSBVYN),占SBV 基因组长度的97%,包含整个多聚蛋白基因,编码区为155 ~8 734 位碱基,编码2 859个氨基酸残基。
2.3 序列分析 经序列比对,3 条AmSBV-YN 序列的同源性大于99%,与GenBank 公布的SBV 基因组序列的同源性为91% ~93%,与RdRp 序列的同源性大于91%,与AmSBV-Chn 的RdRp 序列同源性大于97%。与中国南方中华蜜蜂的SBV(AcSBV-S.Chn)_AF469603 比较,AmSBV-YN 在非结构蛋白基因的6 520 与6 521 位碱基间缺失 1 个碱基,在6 571 与 6 572 位碱基间缺失 2 个碱基,见图 1;致使6 521 ~6 571 位核苷酸发生移码突变,在该区域缺失1 个氨基酸残基,见图2。多聚蛋白N-端部分为结构蛋白,在 227 ~ 402、522 ~ 695 和 805 ~ 997位氨基酸残基区域有3 个独立的小RNA 病毒样结构蛋白的药物结合口袋保守结构域,C-端部分为非结构蛋白,在1 391 ~1 500 位氨基酸残基区域有RNA解旋酶保守结构域,在2 517 ~2 777 位氨基酸残基区域为RdRp 保守结构域。序列已提交GenBank,登录号为 KX819276、KY774627 和 KY774628。

图1 SBV 非结构蛋白基因核苷酸插入/ 缺失区域Fig.1 Nucleotide insection / deletion region in non-structural protein gene of SBV

图2 SBV 非结构蛋白氨基酸残基插入/ 缺失区域Fig.2 Amino acid residue insection /deletion region in nonstructural protein of SBV
2.4 重组分析 经RDP 4 软件分析,AmSBV-YN 除与韩国西方蜜蜂的SBV(AmSBV-Kor)_KP296800 在5′端可能发生重组外,未发现与其他SBV 毒株发生重组,见图3。
2.6 进化树分析 多聚蛋白基因进化树分析显示,AmSBV-YN 单独构成云南基因型,AcSBV 及与其有高同源性的越南西方蜜蜂的SBV(AmSBV-Vie)和AmSBV-Kor 构成亚洲基因型,其他AmSBV 构成西方基因型,见图4;该结果与RdRp 基因进化树分析类似,AmSBV-YN 与其他AmSBV-Chn 聚集一起构成云南基因型,见图5。
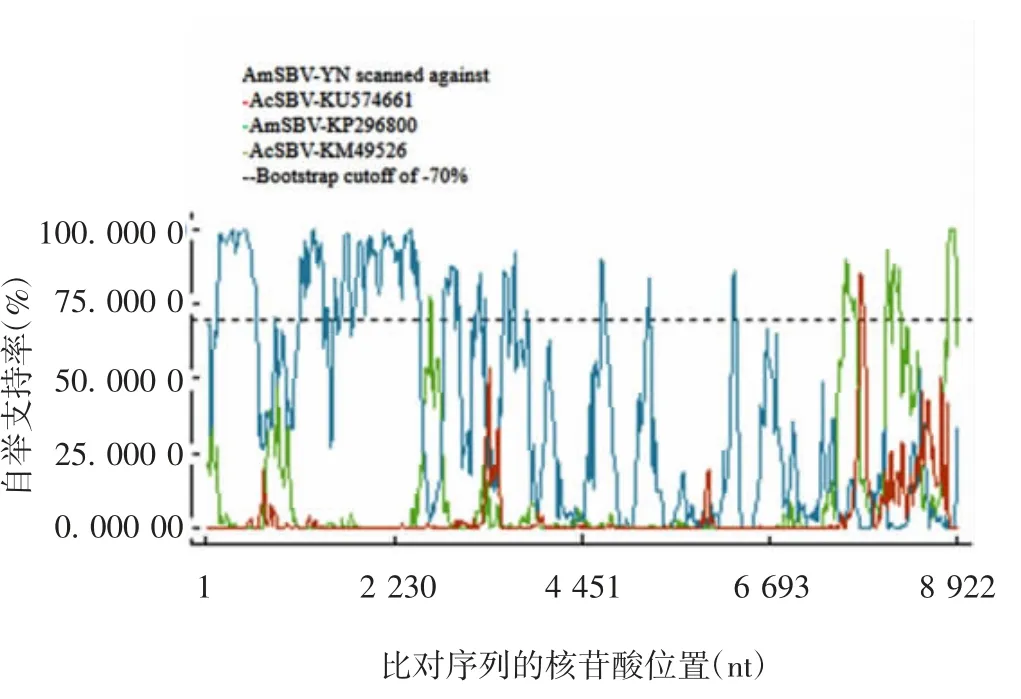
图 3 AmSBV-YN 与 AmSBV-Kor_KP296800 的重组分析Fig.3 Analysis of recombination of AmSBV-YN and AmSBV Kor_KP296800
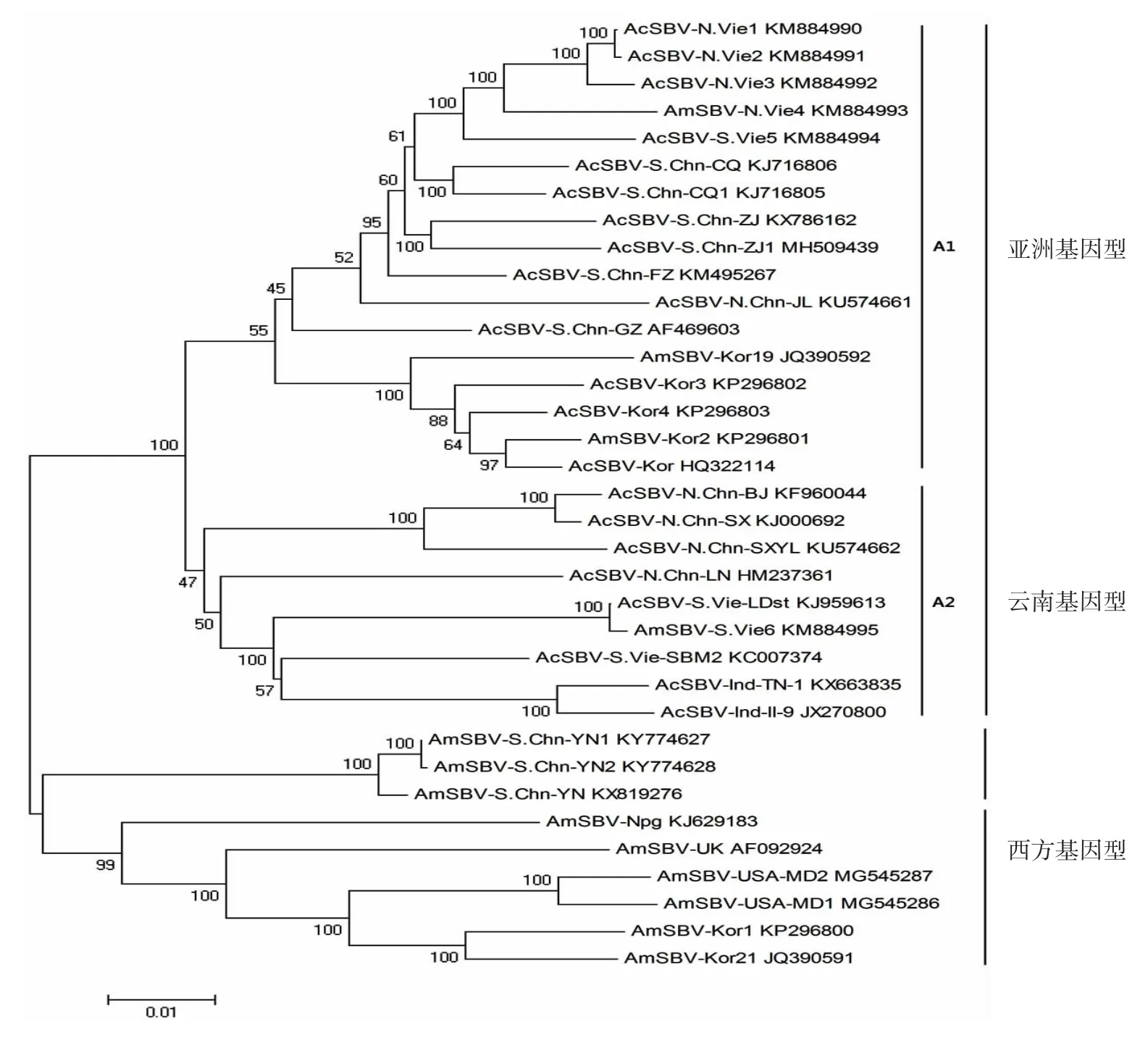
图4 SBV 多聚蛋白基因的NJ 进化树Fig.4 Phylogenetic tree of SBV based on polyprotein gene by neighbor-joining method
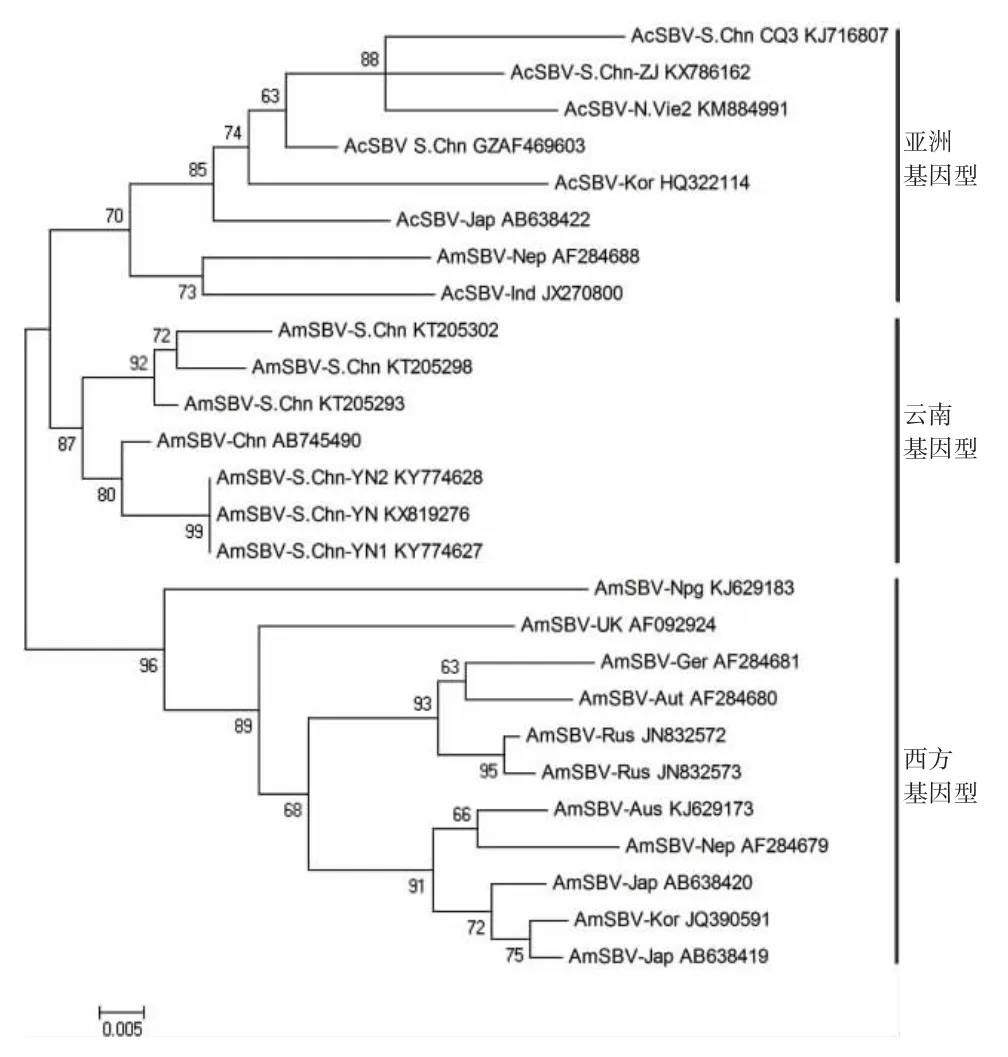
图5 SBV RdRp 基因的NJ 进化树Fig.5 Phylogenetic tree of SBV based on RdRp gene by neighbor-joining method
3 讨 论
尽管生态或适应性差异可能导致物种多样性[17],但通常认为分子水平上的基因组进化是物种形成的初始起点及物种多样性的主要驱动力[18]。宿主或气候等因素导致SBV 呈现出遗传多样性[3,10],体现在分子水平上的是有地域特征的基因组点突变模式、多聚蛋白基因特定位点的核苷酸插入 / 缺失及基因重组等[3,6,8,10]。在多聚蛋白基因核苷酸插入 /缺失中,第1 段是位于结构蛋白编码基因上的连续核苷酸插入 / 缺失,第2 段位于非结构蛋白编码基因上的是3 个不连续的核苷酸插入 / 缺失[8],在3株AmSBV-YN 中,仅发现在非结构蛋白编码基因中存在3 个不连续的核苷酸插入 / 缺失。2014 年,ROBERTS 等[10]报道了 AmSBV-Npg_KJ629183 全基因组序列,与已公布基因组的SBV 序列的同源性为91% ~93%,未发现与其他毒株发生重组,在基因组水平的进化树上与其他西方基因型毒株进化距离较远,认为是不同于以往研究的SBV,称其为新几内亚血清型。本研究采用RT-PCR 方法从自然感染的云南西方蜜蜂幼虫样本中扩增到占基因组97%的AmSBV-Chn 序列——AmSBV-YN,该序列包含完整的多聚蛋白基因,与已知SBV 序列的同源性为91%~93%,经 RDP4 分析,除与 AmSBV-Kor_KP296800 在5′端可能发生重组外,未发现与其他SBV 毒株发生重组。利用超基因组97%的多聚蛋白基因对SBV 进行分子进化分析,显示3 株AmSBV-YN 单独构成新基因型。因此,AmSBV-YN 为新发现的SBV 毒株。
由于RdRp 的易错性,SBV 等蜜蜂RNA 病毒是高突变性病毒[10],这导致通过RT-PCR 方法从感染样本中扩增SBV 基因组会很困难,数据库中可利用的SBV 基因组不多,对SBV 的分子进化分析主要依赖于基因组片段[3,19-20]。由于 RdRp 基因相对保守[3],研究SBV 的分子进化关系更多是利用该基因。在前期研究中,一般不控制不同基因型内SBV 的毒株数量,这会增加进化树中的节点数,影响进化树上反映的进化关系[17]。为更准确地确定AmSBV-YN 与其他AmSBV-Chn 的进化关系,本研究以节点bootstrap值大于50%为基准选择序列[18],减少了亚洲基因型的毒株数量,使亚洲基因型、西方基因型及包括AmSBV-YN 在内的AmSBV-Chn 的毒株数量基本相当,基于RdRp 基因构建了SBV 进化树。经分析,AmSBV 主要分为西方及亚洲基因型,其中AmSBVYN 与已报道的AmSBV-Chn 聚集在一起构成1 个新基因型。由此推测AmSBV-YN 可能是AmSBVChn 的代表株。
本研究全面展示了AmSBV-YN 的分子特性及SBV 遗传多样性,为进一步研究SBV 与宿主的相互作用奠定了基础。

