结直肠癌患者肿瘤出芽情况与临床病理特征、程序性死亡受体1及程序性死亡配体1表达相关性研究
赵英旋,白玉勤
(1.锦州医科大学,辽宁 锦州 121001;2.赤峰学院附属医院普外科,内蒙古 赤峰 024000;3.赤峰市肿瘤医院病理科,内蒙古 赤峰 024000)
结直肠癌(Carcinoma of colon and rectum,CRC)是消化道常见的恶性肿瘤,表现为便血及腹痛等症状[1]。近年来,CRC发病率和死亡率逐渐呈上升趋势。据统计,CRC在全世界男性发病率中居第3位,病死率第4位;女性发病率居第2位,病死率居第3位;大多数患者处于中晚期,占所有CRC的50%[2]。欧洲医学肿瘤学会(ESMO)提出,肿瘤出芽是早期CRC的潜在预后因素,其是由一个未分化的肿瘤细胞或4个细胞组成的小的局灶性肿瘤细胞群,存在于肿瘤浸润的前缘,CRC中肿瘤出芽与微卫星不稳定性、细胞凋亡、肿瘤间质、缺氧和血管扩张、炎症浸润、微小RNAs(miRNAs) 、Ki-ras及KRAS/BRAF基因突变密切相关[3]。研究[4]发现,程序性死亡受体1(Programmed cell death-1,PD-1)是一种参与T细胞凋亡的跨膜受体,其与程序性死亡配体1(Programmed cell death-ligand 1,PD-L1)和PD-L2的相互作用会抑制T细胞的增殖。当正常机体感染病毒时,细胞内PD-L1和PD-L2蛋白的表达增加,与T细胞表面的 PD-1 受体相互作用,从而抑制T细胞的活化和增殖,降低杀伤肿瘤能力[5]。基于此,本研究选取180例手术切除的CRC石蜡标本,探讨CRC患者肿瘤出芽与临床病理特征及PD-1/PD-L1的关系,以期为CRC诊治提供实验依据。
1 资料与方法
1.1 一般资料 回顾性分析2014年1月至2015年12月行根治术治疗的180例CRC患者的临床资料。其中,男性65例,女性115例;年龄30~75岁,平均(57.26±7.18)岁;肿瘤直径1.5~10 cm,平均(4.51±0.30)cm。病例纳入标准:①均符合CRC诊断,并经病理学确诊[6];②年龄30~75岁;③临床资料及影像学资料完整;④术前未接受化学药物治疗、局部放射治疗或其他抗肿瘤治疗;⑤无恶性肿瘤病史。排除标准:①肝肾功能不全;②合并自其他恶性肿瘤;③术前发生全身转移;④临床资料不完整;⑤有家族遗传史。
1.2 研究方法
1.2.1 肿瘤出芽计数:根据国际肿瘤出芽共识会议(ITBCC)上提出的肿瘤出芽标准化方法[7]进行判定,即在肿瘤浸润前沿的间质中发现孤立的单个肿瘤细胞或2~4个小簇状肿瘤细胞群为肿瘤出芽。低倍显微镜下观察苏木精-伊红(HE)染色的肿瘤组织浸润前沿,寻找肿瘤出芽最多的区域。如果不清楚哪个区域出芽最多,或者如果第一个区域的肿瘤芽数<15个,则应从多个区域评价肿瘤出芽,选择出芽最多的区域进行分析。在总放大倍数为200倍的条件下,对面积为0.398 mm2的单个视野内的肿瘤芽数进行计数,然后将肿瘤芽数乘以1.97,得到的数为每0.785 mm2的肿瘤芽数,在光镜下观察到CRC中没有出芽、低度出芽(<10个/高倍视野)和高度出芽(≥10个/高倍视野)(×20视野,0.785 mm2区域)。
1.2.2 标本制备和石蜡切片HE染色:离体的黏膜薄切和根治CRC组织标本快速在10%中性甲醛溶液中进行浸泡固定,采取组织梯度酒精脱水、透明、浸蜡,然后石蜡包埋。石蜡切片厚度为3 μm,于65 ℃温度下烘烤2~5 h后浸泡于二甲苯溶液中脱蜡,室温下梯度酒精脱苯及水化,酒精浓度依次为100%、95%、90%、80%和70%。接着采用流水冲洗3~5 min;苏木素溶液染色2 min,流水冲洗 3 min;用1%盐酸酒精溶液再浸泡1 min 后同样采用流水冲洗3 min;再用伊红溶液染色3~5 min,流水冲洗3 min;梯度酒精再脱水,酒精浓度依次为70%、80%、90%、95%和100%。3次二甲苯透明后采用中性树胶封片,于放大倍数下观察切片并记录[8-9]。
1.2.3 免疫组织化学染色:采用罗氏机器自动化方法。连续石蜡切片厚度为3 μm。取CRC组织石蜡切片,经烤片、脱蜡、水化、抗原修复等过程,加入体积分数为3%过氧化氢灭活内源性过氧化物酶后,加入一抗 anti-PD-L1和PD-1(克隆号为MX033),4 ℃冰箱过夜(12 h),PBS清洗,先后加入羊抗鼠或兔IgG(二抗)室温孵育1 h,DAB染色,苏木素复染,二甲苯透明,中性树胶封片[10-11]。
1.2.4 判定标准[12]:PD-L1和PD-1以细胞质或胞膜出现黄至棕褐色颗粒为阳性。PD-L1以阳性肿瘤细胞数≥1%为阳性,<1%为阴性。PD-1表达于肿瘤间质浸润的淋巴细胞,以≥5%为阳性,<5%为阴性。
1.3 统计学方法 采用SPSS 20.0统计学软件处理数据。计数资料用[例(%)]表示,组间比较采用χ2检验。等级资料采用秩和检验。采用多因素Logistic回归模型分析肿瘤出芽情况与临床病理特征的相关性。P<0.05为差异有统计学意义。
2 结 果
2.1 CRC患者肿瘤不出芽时PD-1和PD-L1蛋白表达情况 见图1。CRC不出芽石蜡标本连续切片行HE染色及免疫组化PD-1、PD-L1蛋白染色,60例CRC患者显微镜下未见肿瘤出芽,且PD-1、PD-L1蛋白呈阴性表达。
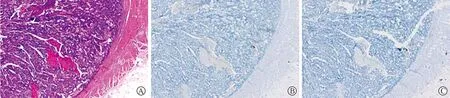
注:A图为HE染色(×40);B、C图为PD-1蛋白免疫组化染色(×40)
2.2 CRC患者肿瘤出芽时PD-1和PD-L1蛋白表达情况 见图2。显微镜下,在肿瘤浸润的前缘间质内可见多个芽孢,且由孤立单个细胞或2~4个癌细胞成团组成,其中50例低出芽(图2A-D),70例高出芽(图2E-G)。芽孢内细胞质融合,呈嗜酸性,形状不规则,染色较间质细胞深,部分可见核分裂像。肿瘤细胞PD-1、PD-L1蛋白不着色或着色<1%。PD-1表达于肿瘤间质及淋巴细胞,局灶区阳性细胞数<5%。因此,PD-1、PD-L1蛋白亦呈阴性表达。

注:A、E 图为HE染色(×40);B、F图为HE染色(×400;); C、G图为PD-1蛋白免疫组化染色(×40);D、H图为PD-L1蛋白免疫组化染色(×40)
2.3 CRC患者肿瘤出芽与临床病理特征单因素分析 见表1。CRC肿瘤低出芽和高出芽患者性别、年龄、肿瘤部位、肿瘤大小、肿瘤组织学、肿瘤分化程度及肠壁环绕情况比较无统计学差异(均P>0.05),但病理分期、肿瘤形态、肠壁浸润深度及转移情况比较差异具有统计学意义(均P<0.05)。

表1 CRC患者肿瘤出芽与临床病理特征单因素分析[例(%)]

续 表
2.4 影响CRC肿瘤出芽临床病理特征多因素分析 见表2。将表1中有统计学差异的因素设为自变量(病理分期Ⅲ期=1,Ⅱ期=0;肿瘤形态呈侵袭型=1,呈肿块型和溃疡型=0;肠壁肌层和浆膜层浸润=1,黏膜层和浆膜外浸润=0;有淋巴结转移=1,无淋巴结转移和远处转移=0)进行Logistic多因素回归分析,结果显示病理分期、肿瘤形态、肠壁浸润深度及转移情况为影响CRC肿瘤出芽的独立危险因素(均P<0.05)。

表2 影响CRC肿瘤出芽临床病理特征多因素分析
2.5 CRC肿瘤出芽与预后的关系 对低出芽和高出芽患者进行5年随访。至2021年1月,随访时间平均(30.28±4.05)个月。随访期间无失访,低出芽CRC患者7例死亡,总生存率为86.00%(43/50);高出芽CRC患者32例死亡,总生存率为54.29%(38/70)。高出芽CRC患者5年总生存率低于低出芽CRC患者(P<0.05)。
3 讨 论
CRC患者恶性肿瘤特征为肿瘤细胞侵袭性生长和转移。肿瘤侵袭性生长是肿瘤细胞进入周围间质,而肿瘤出芽是肿瘤侵袭性生长的形态表达,其除与CRC淋巴结转移、预后等相关外,还与微卫星不稳定性(MSI)、细胞凋亡、缺氧、炎细胞浸润等密切相关[13-14]。UICC已经正式承认肿瘤出芽是CRC的独立预后因素[15]。Pan等[16]发现,有淋巴结转移和淋巴管浸润的直肠癌患者,其肿瘤出芽的发生高于无淋巴结转移的直肠腺癌患者。杨天宁等[17]发现,肿瘤出芽在CRC淋巴结转移和淋巴管浸润方面的发生率具有相关性。
PD-1及其配体PD-L1是免疫治疗的重点。其中,PD-1正常表达在胸腺细胞上,诱导性表达于活化的T细胞、B细胞及自然杀伤细胞等,当抗原清除、免疫应答完成后T细胞PD-1表达减少。PD-1表达在T细胞上会诱导T细胞衰竭,因此PD-1属于免疫抑制受体。PD-L1是PD-1主要配体,是负性免疫调节蛋白,表达于肿瘤细胞、巨噬细胞和T细胞等,可抑制T细胞活化,促进细胞凋亡,减弱免疫系统对肿瘤细胞的监视作用,从而使肿瘤细胞发生免疫逃逸。肿瘤发生时肿瘤微环境会诱导浸润性T细胞高表达PD-1分子,进而激活肿瘤微环境中PD-1通路,且与PD-L1联接后会抑制T细胞功能[18-19]。本研究结果显示,肿瘤出芽率为66.67%(120/180);CRC肿瘤不出芽区域和出芽区域肿瘤细胞PD-1和PD-L1蛋白不着色或<1%着色,PD-1表达于肿瘤间质浸润的淋巴细胞及间质细胞,局灶阳性细胞数<5%,结果为阴性,证明了CRC肿瘤不出芽和肿瘤出芽与PD-1和PD-L1蛋白表达无显著关系。另外,本研究发现低出芽和高出芽CRC患者病理分期、肿瘤形态、肠壁浸润深度及转移情况比较差异具有统计学意义,与陈艳昕等[20]报道一致,说明肿瘤出芽与病理分期、肿瘤形态、肠壁浸润深度及转移情况密切相关;同时Logistic多因素回归分析结果显示,病理分期、肿瘤形态、肠壁浸润深度及转移情况为影响CRC肿瘤出芽的独立危险因素,进一步证实了肿瘤出芽与病理分期、肿瘤形态、肠壁浸润深度及转移情况的相关性,病理分期高、肿瘤呈侵袭型、肠壁肌层和浆膜层浸润以及存在远处转移的CRC患者肿瘤出芽发生率更高。与其他研究不同的是,本研究进行5年随访后研究发现,高出芽CRC患者5年总生存率低于低出芽患者,由此可见高出芽CRC患者预后较差,进一步证实了肿瘤高出芽对CRC具有一定的预测价值。
综上所述,肿瘤不出芽和出芽与PD-1、PD-L1蛋白表达无相关性。病理分期、肿瘤形态、肠壁浸润深度及转移情况等病理特征是影响CRC患者肿瘤出芽的危险因素,可为制定术后辅助治疗方案和判断预后提供指导。但本研究纳入病例数较少,可能对结论有一定影响,后续将扩大样本量进一步论证。

