红景天苷通过抑制线粒体自噬通路减轻1-甲基-4-苯基吡啶离子诱导的PC12细胞凋亡实验研究
王松海,康 超,谢燕华,陈 捷,刘 楠
(陕西省中医医院肿瘤科,陕西 西安 710003)
帕金森病(Parkinson’s disease,PD)是一种发生于中老年人的常见神经退行性运动功能障碍疾病。其病理改变为中脑黑质致密部多巴胺(DA)能神经元退行性变性丢失,纹状体区DA含量减少,以及残存的DA能神经元内形成以α-突触核蛋白为主要成分的嗜酸性包涵体——路易小体[1-2]。在北京大于 65 岁的人群中,男性患病率为1.7%,女性为1.6%[3],基本与发达国家相同。目前临床治疗中主要是对症治疗,而减轻或抑制发病过程的药物尚未被发现。虽然流行病学对于PD的具体发病机制尚未清楚,但是线粒体功能障碍以及DA能神经元内氧化应激刺激被认为是引起该病的主要原因。近年来,中医药在神经退行性变中的应用,尤其是植物药对PD的神经保护作用,受到人们的广泛关注。红景天作为一个有价值的药用植物,我国自古就有将红景天用于煎汤或泡酒,作为补品或治疗疾病的药物使用的记录,以消除疲劳或抵御寒冷。红景天苷(Salidroside,Sal)主要是从红景天的根、块茎中提取出来的,具有较强的神经保护作用[4-8]。我们前期研究表明Sal具有抑制1-甲基-4-苯基吡啶离子(MPP+)诱导PC12细胞凋亡的作用,而其主要机制与减少细胞内氧化应激有关[9-10]。同时,我们还发现Sal对神经细胞的保护作用可能与抑制线粒体的破坏有关。因此,本研究将进一步探讨Sal对PD体外模型的神经保护作用机制,为研究Sal的治疗作用提供一些依据。
1 材料与方法
1.1 实验材料 PC12细胞系由第四军医大学基础教学实验中心提供;Sal(HPLC 法检测纯度>98%,CAS:82373-94-2)购自四川维克奇生物科技有限公司;DMEM培养基、胎牛血清和马血清购自Gibco公司。MPP+(CAS:D048-100MG)、4-甲基偶氮唑蓝(MTT,CAS:298-93-1)、Annexin V-binding/PI-uptake(CAS:APOAF-20TST)、罗丹明123(CAS:62669-70-9)购自Sigma公司;兔抗大鼠PINK1、Parkin、LC-3、Beclin1抗体(一抗,ab216144、ab15494、ab48394、ab207612)以及β-actin抗体(一抗,ab8227)购自Abcam公司;辣根过氧化物酶标记的山羊抗兔IgG的抗体(二抗,ZB-20301)购自北京中杉公司。
1.2 实验方法
1.2.1 细胞培养:PC12细胞系培养于DMEM培养基(含10%马血清、5%胎牛血清、2 mmol/L L-谷氨酰胺、100 kU/L青霉素、100 g/L链霉素)中,置于含5% CO2的37 ℃孵育箱中培养。隔天换液,待单层细胞融合约80%时,用0.25%胰蛋白酶消化并传代培养。当传代细胞进入对数生长期时进行实验处理。
1.2.2 实验分组:根据实验需求分为四组。对照组:不加任何实验受试物。单纯药物组:在对照组的基础上加入100 μmol/L Sal。MPP+模型组:MPP+用培养液稀释(终浓度为500 μmol/L),加入到培养孔中。不同剂量 Sal组:先分别加入终浓度为10、100 μmol/L的Sal,孵育24 h后加入MPP+,每组样本量为6~8个。
1.2.3 细胞活性检测:基于MTT在活细胞线粒体脱氢酶作用下可转变为蓝紫色甲瓒结晶进行检测。PC12细胞接种于96孔板,接种密度为1×105个/孔,每孔100 μl培养液。按实验要求进行药物干预后,吸尽培养液,PBS冲洗3遍,每孔加入5 mg/L MTT溶液20 μl,37 ℃下继续孵育3~4 h。小心去除培养液后,加入150 μl DMSO,震荡10 min,使蓝色结晶充分溶解,上酶标仪,以波长490 nm检测每孔吸光度值。细胞活性以与对照组相比的百分数表示。实验均重复3次。
1.2.4 凋亡细胞检测:用流式细胞仪Annexin V-binding和PI-uptake进行定量检测。用MPP+和(或)Sal处理后,将细胞通过离心收集,PBS冲洗,再以1×106个/ml的浓度悬浮于结合缓冲液中。加入5 μl 20 μg/ml Annexin V-FITC和10 μl 50 μg/ml PI,在室温下孵育15 min,避光。然后使用流式细胞仪进行细胞凋亡水平的定量分析。凋亡细胞以占总细胞数的百分比表示。实验均重复3次。
1.2.5 线粒体膜电位检测:按常规方法提取线粒体,用适量1×Assays Buffer重悬。常规方法进行蛋白含量测定后,用1×Assays Buffer调配成3 mg/ml的线粒体溶液。取2 ml 1×Assays Buffer和1 ml线粒体溶液,加入适量待测化合物(同时设空白对照组),25 ℃保温5 min。加入罗丹明123染液10 μl,进行荧光光度计检测,测得的荧光值以与对照组细胞荧光度的百分比表示。实验均重复3次。
1.2.6 蛋白表达情况检测:采用Western blot检测LC-3β、Beclin1、PINK1、Parkin、β-Actin蛋白表达情况。提取的蛋白质先经BCA法测定蛋白浓度,再取20 μg蛋白样本进行Western blot检测,后进行ECL化学发光显影。结果采用凝胶图像分析仪进行灰度分析。实验均重复3次。

2 结 果
2.1 Sal与MPP+对PC12细胞活性的影响 见图1。通过MTT检测发现,单纯Sal对PC12细胞活性未见明显影响。MPP+具有剂量依赖性减少PC12细胞活力的作用,500 μmol/L MPP+处理24 h后,细胞活力显著下降至(52.4±2.2)%,与对照组比较有统计学差异(P<0.01)。因此,将500 μmol/L MPP+处理24 h作为模型组。不同浓度Sal(10、100 μmol/L)预处理24 h后,细胞活力分别恢复至(63.1±2.1)%和(84.1±1.3)%,与MPP+模型组比较均有统计学差异(均P<0.05)。

注:与对照组比较,*P<0.05,**P<0.01;与MPP+模型组比较,#P<0.05,##P<0.01
2.2 Sal与MPP+对PC12细胞凋亡的影响 见图2。MPP+预处理后,凋亡细胞百分比从(2.26±0.13)%增加至(58.54±2.23)%,与对照组比较有统计学差异(P<0.01)。而在10、100 μmol/L Sal预处理后,细胞凋亡比例分别降至(39.13±1.45)%和(20.32±2.21)%,与MPP+模型组比较有统计学差异(均P<0.01)。

注:与对照组比较,*P<0.05,**P<0.01;
2.3 Sal与MPP+对PC12细胞线粒体膜电位(MMP)的影响 见图3。500 μmol/L MPP+处理PC12细胞后,罗丹明123信号降低至(48.64±2.34)%,与对照组比较有统计学差异(P<0.01)。而在10、100 μmol/L Sal处理后,MMP峰值分别升至(62.14±2.32)%和(86.31±2.35)%,与MPP+模型组比较有统计学差异(均P<0.01)。

注:与对照组比较,*P<0.05,**P<0.01;与
2.4 Sal与MPP+对PC12细胞中相关蛋白表达的影响 见图4。 与对照组相比,MPP+处理后细胞内LC-3β、Beclin1表达增多,PINK1、Parkin表达减少(均P<0.01)。Sal预处理后,与MPP+模型组比较,细胞内LC-3β、Beclin1蛋白表达水平明显下降,而PINK1、Parkin蛋白表达水平明显上升(均P<0.05)。
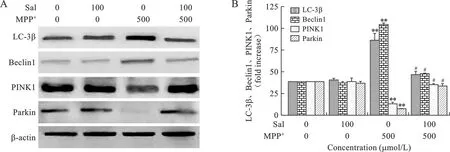
注:与对照组比较,**P<0.01;与MPP+模型组比较,#P<0.05
3 讨 论
帕金森病1817年由Parkinson首次发现,目前是临床上老年人常见的神经退行性疾病。我国PD患病率高达1.7%,目前已严重影响国民生活质量。虽然PD治疗取得了一系列的成就,但其发病机制迄今仍不清楚,因为没有一种学说可以解释PD患者所有的临床症状。一般随着病程延长,PD临床症状经历由少至多、由轻至重的复杂变化。PD临床症状主要分为以静止性震颤、运动迟缓、肌强直、言语不利、平衡障碍为主的运动症状,和以认知功能障碍、感觉异常、自主神经功能障碍、睡眠障碍为主的非运动症状[11-12]。PD通常在临床症状明显及确诊之前,可能都伴有神经退行性病变,但目前主要的DA治疗并不能完全逆转神经元的凋亡,也不能彻底抑制PD病理改变,只能缓解其部分运动症状,而对一些非运动症状如焦虑、抑郁等无影响,甚至会加重便秘、低血压、幻视等症状。因此,对于PD的机制研究越来越多受到关注,希望能从源头寻找到彻底解决问题的方案[13-14]。有研究发现,PD的发病原因不能仅仅依靠基因学说完全解释,因为PD病例中大多数(≥95%)是散发的。总体来看,PD发病机制目前主要有运动神经元异常凋亡学说、线粒体功能障碍学说、氧化应激学说、内质网应激学说、免疫炎症反应学说、微生物-肠-脑轴调控机制学说、铁死亡调控机制学说等[15-19]。每一个学说都只能解释部分PD的发病现象,但PD发病中仍然有一些共同的生化病理特征,如残存神经元细胞内以α-突触核蛋白的大量聚集等。
研究表明Sal具有明显抑制细胞内氧化应激激活的作用,我们前期体外研究结果也表明Sal具有激活细胞内异常蛋白聚集清除系统(泛素蛋白酶系统)的作用,但进一步提高抗氧化物浓度并不能完全阻止多巴胺能神经元的损伤。有研究[20]在这些损伤的神经元细胞中发现存在线粒体功能障碍,其中有Caspase通路、泛素蛋白酶系统、自噬系统的激活。线粒体的功能障碍与活性氧生成以及能量增加密切相关,而PD患者黑质中线粒体复合物Ⅰ活性降低32%~38%,导致细胞有氧呼吸功能减弱,发生酸中毒及氧化应激。而氧化应激又将导致线粒体膜受损,引起膜电位去极化,使得细胞膜上PINK1蛋白被激活,激活后的PINK1蛋白转位到线粒体外膜,诱导下游Parkin在线粒体外膜聚集[21-22]。Parkin在线粒体外膜的聚集可以加强线粒体的分裂,从而有利于受损伤的线粒体被清除。同时,Parkin移位到线粒体后E3泛素连接酶的活性增加,引起多种线粒体底物泛素化,从而导致受损的线粒体被清除。Parkin介导线粒体泛素化后,泛素结合接头蛋白P62既可与线粒体底物结合,又可与LC-3、Beclin1结合介导泛素化线粒体进入自噬体,然后通过自噬体与溶酶体融合清除受损线粒体[23-24]。因此,对于Sal是否参与损伤细胞器的自动降解途径(自噬系统),PD中多巴胺能神经元内线粒体损伤是否与自噬相关,仍需我们进一步研究。
本研究采用MPP+诱导的PC12细胞模拟PD体外模型,经 Sal预处理后细胞活性明显好转,凋亡情况明显改善。进一步研究发现模型组细胞内MMP水平明显降低,LC-3β、Beclin1表达增多,PINK1、Parkin表达减少,而经Sal预处理后上述损伤均可以明显改善。
综上所述,Sal对PD模型中DA能神经元的保护机制可能与激活线粒体自噬通路有关,这与我们前期PD体内动物实验的研究结果一致。本研究结果虽然对PD临床治疗具有一定的指导价值,但也有一定不足:首先,目前临床已有红景天苷的注射制剂,但临床目前主要应用于冠心病心肌供血不足,以活血化瘀为主要目的。对于红景天的抗氧化活性、改善神经元细胞功能活性的研究目前还处于实验研究节段。其次,PD发病机制复杂,虽然氧化应激反应是其主要发病机制,但是一般药物的抗氧化活性呈浓度依赖性,因此在保持临床效果的基础上如何确定Sal的临床最适浓度是我们下一步的主要研究方向。
——题《圣山系-金巅》

