筛选自泡菜的发酵乳杆菌细菌素纯化及抑菌特性分析
高兆建,张艳秋,宋玉林,赵宜峰
(1.徐州工程学院食品与生物工程学院,江苏徐州 221018; 2.长江桂柳食品睢宁有限公司,江苏徐州 221000)
细菌素是革兰氏阳性菌产生、由核糖体合成的小分子抗菌肽[1],具有抑制某些微生物生长的作用,细菌素产生菌株通过抑制其它微生物生长而使其自身竞争中处于有利地位。产生细菌素菌株主要来源于乳酸菌并主要分布于乳球菌属(Lactococcus)、片球菌属(Pediococcus)、乳杆菌属(Lactobacillus)、明串珠菌属(Leuconostoc)、肉食杆菌属(Carnobacterium)、肠球菌属(Enterococcus)和链球菌属(Streptococcus)[2]。乳酸菌在发酵中利用原料中的糖发酵生成乳酸、过氧化氢、双乙酰、细菌素和其他有机酸等产物,这些物质特别是细菌素可有效防止腐败细菌的生长、延长食品的货架期、增加食品的风味[3]。从安全性考虑,乳球菌属和乳杆菌属的乳酸菌被认为是安全性菌株(GRAS)[4],来源于以上种属的乳酸菌细菌素比来源于其他微生物的受到更多关注[5]。
目前已经从中国传统发酵食品中分离到大量产细菌素乳酸菌株,其中深受广大消费者喜欢的传统发酵食品泡菜是产细菌素乳酸菌的重要来源,如Gao等[6]从发酵卷心菜中分离到的清酒乳杆菌所产细菌素有广谱抑菌活性,Lv等[7]从中国西北地区传统浆水菜中分离到的棒状乳杆菌产细菌素有良好的pH稳定性,另外还有从发酵萝卜[8]、发酵黄瓜等泡菜中分离产细菌素菌株的报道。并且所报道细菌素在某些方面表现出较好的应用特性,如耐酸细菌素[9]、耐高温细菌素[5]、广谱抗性细菌素[10]、抗真菌细菌素等。但细菌素作为一种有潜力的生物防腐剂,若在食品中广泛使用,必须经受住食品加工过程或者食品贮藏过程的环境因素的考验,如高温、氧化、高盐、蛋白酶解、疏水、高酸高碱等极端环境。但目前报道的细菌素单独应用时其在抗菌谱、抗菌效价、稳定性等方面仍然存在缺陷,因此进一步深入开发新型细菌素对食品行业的发展具有重要意义。
本研究从徐州多处采集的泡菜样品中分离到一株产细菌素菌株发酵乳杆菌(L.fermentum),尽管前期已经有多篇文献报道了从发酵乳杆菌分离的细菌素[11-14],但其菌株筛选来源与本研究不同,并且与本研究的发酵乳杆菌所产细菌素在抑菌特性方面有差异性。本研究旨在从多样品中分离具有潜在应用价值的产细菌素的乳酸菌菌株,通过乳酸菌发酵,在分离纯化得到单一组分细菌素基础上,进一步研究细菌素分子特性及抑菌相关性能,为细菌素在食品中开发应用提供理论支持。
1 材料与方法
1.1 材料与仪器
样品 从徐州当地多处农贸市场购买泡菜用于分离产生细菌素的乳酸菌株;指示菌株 部分购自中国普通微生物菌种保藏管理中心,部分由徐州工程学院江苏省重点建设实验室保存,具体见表2;乳酸菌筛选培养基 MRS培养基基础上添加0.5%(w/v)的碳酸钙;细菌素发酵 使用MRS培养基;培养各细菌指示菌 使用LB培养基;柱层析填充材料Sephadex G-15 美国Pharmacia公司;超小分子量标准蛋白 TaKaRa公司;胰化蛋白胨、酵母粉 英国Oxoid公司;细菌基因组DNA提取试剂盒、胶回收试剂盒、PCR试剂盒 宝生物工程(大连)有限公司;蛋白酶K(30 U/mg)、胃蛋白酶(250 U/mg)、胰蛋白酶(2500 U/mg)、木瓜蛋白酶(30 U/mg)、α-淀粉酶(30 U/mg) 上海源叶生物科技有限公司;三氟乙酸、乙腈 色谱纯,美国TEDIA公司;其他试剂 均为国产分析纯。
GeneAmp 9700 PCR仪 美国应用生物系统公司;JS-680D凝胶成像系统 上海培清科技有限公司;Sigma3k15冷冻离心机 德国SIGMA公司;UV-2450紫外可见光分光光度计 日本岛津公司;DYY-6B凝胶水平电泳仪 北京市六一仪器厂;AKTA蛋白纯化系统 美国GE Healthcare公司;高效液相色谱半制备柱:Zorbax SB-C18(9.4 mm×250 mm,5 μm) 美国安捷伦公司产品;CascadaTM AN超纯水系统 美国PALL公司。
1.2 实验方法
1.2.1 产细菌素乳酸菌菌株筛选
1.2.1.1 乳酸菌筛选 参照Martinez等[15]的方法并稍微修改。泡菜水按照10-1浓度依次进行梯度稀释,选取10-1、10-2、10-3三个稀释度涂布到MRS固体培养基上,34 ℃培养2~4 d。挑取具有溶钙圈的单个菌落革兰氏染色,并对菌落滴加3%双氧水后检测是否有气泡形成,有气泡形成表明细胞中存在过氧化氢酶。过氧化氢酶阴性且革兰氏阳性的菌株初始判断为乳酸菌。将初筛的菌株MRS固体培养基上划线纯化,挑取单菌落进行液体培养,在-20 ℃下30%甘油保存待用。
1.2.1.2 乳酸菌的抑菌活性测定 将分离纯化的乳酸菌株接种于装有5 mL MRS液体培养基离心管中并在34 ℃条件下发酵48 h,10000 r/min,4 ℃离心10 min,上清液pH调至7.0并100 ℃加热5 min,使内源性蛋白酶失活。用0.22 μm孔径的醋酸纤维素过滤器过滤,滤液(命名为CFS)-20 ℃保存直到使用。
采用琼脂孔扩散法[1]测定CFS的抑菌活力。于LB培养基平板上涂布指示菌S.aureus菌液,晾干后用打孔器打孔,将150 μL CFS注入于培养基孔中,37 ℃下培养过夜,检测是否有抑菌圈并测量抑制圈直径。产生抑菌圈的对应CFS中分别加入蛋白酶K、木瓜蛋白酶、胰蛋白酶,酶的终浓度2 mg/mL,在各酶最适pH下,37 ℃保温2 h,再将pH调回至7.0,测定蛋白酶和非蛋白酶处理后对S.aureus的抑菌直径。
抑菌活力单位的定义为:以S.aureus为指示菌,样品经最大稀释后,打孔检测仍产生清晰抑菌圈的最大稀释倍数的倒数作为一个抑菌活力单位。
1.2.2 产细菌素菌株鉴定 筛选到的菌株接种于MRS固体培养基上,34 ℃恒温培养48 h,对菌落形态及菌体形态镜检观察。进一步通过一系列生理生化试验进行分析。各生理生化指标测定参照《乳酸细菌分类鉴定及实验方法》及《伯杰氏细菌鉴定手册》进行。
通过16S rDNA分析进一步鉴定菌株。以目标菌株的基因组DNA为模板,选取通用引物(16S-F:5′-AGTTTGATCCT-GGCTCAG-3′;16S-R:5′-CTTGTTACGACTT-CACCC-3′)进行16S rDNA的PCR扩增。PCR扩增条件:94 ℃预变性5 min;94 ℃变性45 s,53 ℃退火45 s,72 ℃延伸1.5 min,共30个循环;最后72 ℃延伸7 min。扩增产物连接克隆载体后测序。所得序列BLAST比对,用ClustalX 1.83与MEGA 5.1软件,采用NJ法(Neighbor-Joining method)构建系统发育树。
1.2.3 乳酸菌细菌素发酵 菌株划线活化两次后,接种于20 mL MRS液体培养基中,培养12~16 h按照1%(v/v)接种量接种于250 mL三角瓶装有80 mL MRS的培养基中,34 ℃发酵36 h,间隔一定时间取样,测定其吸光度(600 nm),并以S.aureus为指示菌株,琼脂孔扩散法测定细菌素的抑菌活力。
1.2.4 细菌素的纯化
1.2.4.1 硫酸铵盐析 将硫酸铵粉末以85%的饱和度加入CFS中,4 ℃静置过夜,再以10000 r/min、4 ℃下离心15 min。弃上清,沉淀回收,少量去离子水溶解,转入透析袋内4 ℃去离子水透析脱盐,并超滤浓缩后进一步层析纯化。
1.2.4.2 分子筛凝胶过滤层析 采用Sephadex G-15葡聚糖凝胶柱(1.5 cm×80 cm)层析,用20 mmol/L、pH6.5的磷酸缓冲液充分平衡后,将超滤浓缩后的样品(1.5 mL)上样层析柱,相同缓冲液洗脱,流速1 mL/min。检测每管收集液抑菌活性,合并有活性的收集管超滤浓缩后进一步纯化。
1.2.4.3 高效液相色谱制备 采用半制备高效液相色谱(HPLC)梯度洗脱分离细菌素。洗脱体系流动相A为含0.1%三氟乙酸和5%乙腈的水溶液,流动相B为含0.1%三氟乙酸的90%乙腈溶液。检测波长为215 nm,流速为1 mL/min。线性梯度洗脱过程为80 min内流动相A由80%到20%,柱温25 ℃维持在一个恒定水平。
1.2.4.4 细菌素的Tricine-SDS-PAGE分子量测定与凝胶原位检测 经系列纯化后的活性组分通过Tricine-SDS-PAGE电泳测定细菌素分子量。电泳完成后将凝胶切成2份,1份用于考马斯亮蓝染色,另外1份先浸泡于含有25%异丙醇和10%乙酸的溶液中,洗涤6~8 h以洗去凝胶中的SDS,再浸泡于1% Triton X100溶液中30 min,再无菌水洗6 h,最后转移至无菌培养皿中,覆盖上一层20 mL的LB固体培养基,涂布S.aureus37 ℃培养12 h,观察抑菌条带位置,分析细菌素分子量大小。
1.2.5 细菌素稳定性的测定 酶对细菌素的影响:部分纯化的细菌素中分别加入终浓度为2 mg/mL的木瓜蛋白酶、胰蛋白酶、胃蛋白酶、蛋白酶K和α-淀粉酶,调节体系pH至各酶最适作用pH,37 ℃孵育2 h,再80 ℃加热15 min以酶活酶。测定细菌素对S.aureus的抑菌活性。
温度对细菌素的影响:部分纯化的细菌素分别于40、60、80、100 ℃水浴中处理30 min,121 ℃高压灭菌锅15 min,冷却后,以S.aureus为指示菌检测抑菌活性。
pH对细菌素的影响:部分纯化的细菌素用1 mol/L HCl和1 mol/L NaOH调节其pH分别至2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0,20 ℃保持2 h后,再将不同样品的pH调回至7.0,以S.aureus为指示菌检测抑菌活性。
以上实验均以不经酶处理、pH6.0、20 ℃保存的细菌素抑菌活性为空白对照。以最高细菌素活性为100%,相对活性(%)=(各条件下测得的活性/最高活性)×100。
1.2.6 细菌素抗菌谱 指示菌株充分活化后液体培养至对数期,菌液稀释至1.0×106CFU/mL,吸取150 μL涂布于各指示菌对应的固体培养基,再按照1.2.1.2的琼脂孔扩散法测定抑菌活性,所用指示菌见表2。

表2 细菌素BLF52抑菌谱Table 2 Antibacterial spectrum of bacteriocin BLF52 against bacterial strains
1.2.7 细菌素对S.aureus的抑菌情况 参考文献[16]报道的方法并稍作修改,S.aureusLB液体培养基中37 ℃培养2 h分别按照10%和20%(v/v)的量分别添加发酵培养30 h的CFS,然后继续培养至26 h。培养过程每2 h取样测定OD600吸光值,分别绘制生长曲线,以不添加CFS 的S.aureus培养液为空白对照。
1.3 数据处理
所有检测实验均设置3个平行实验,实验数据表示为平均值±标准差。实验数据用Excel 2010整理,SPSS 20.0统计学软件对试验结果差异显著性分析,比较试验中不同处理间差异。P<0.05认为有统计学意义。
2 结果与分析
2.1 产细菌素菌株筛选鉴定
总共从不同泡菜水中分离得到180株乳酸菌,其中进一步筛选获得16株菌有抑菌圈,排除乳酸及过氧化氢作用得到11株菌,进一步蛋白酶敏感性检测,8株菌所产抑菌物质对蛋白酶敏感,再次检测以上菌株对常见食源性致病菌的抑菌性能,筛选得到一株抑菌性能较好的菌株深入研究,该菌株命名为CH-16。菌株菌落形态(图1)及生理生化试验(表1)显示:菌落较小、表面湿润、乳白色、表面光滑、边缘整齐;接触酶阴性、硝酸盐还原阴性、明胶液化阴性、吲哚试验阴性、V-P试验阴性、淀粉水解阴性、运动性试验阴性;可利用葡萄糖、乳糖、麦芽糖,不能利用阿拉伯糖、木糖、棉子糖,参照《乳酸菌分类鉴定及实验方法》及《伯杰氏细菌鉴定手册》初步判断菌株CH-16为发酵乳杆菌。
图1 发酵乳杆菌菌体形态(1000×)Fig.1 Thallus appearance of strain CH-16(1000×)
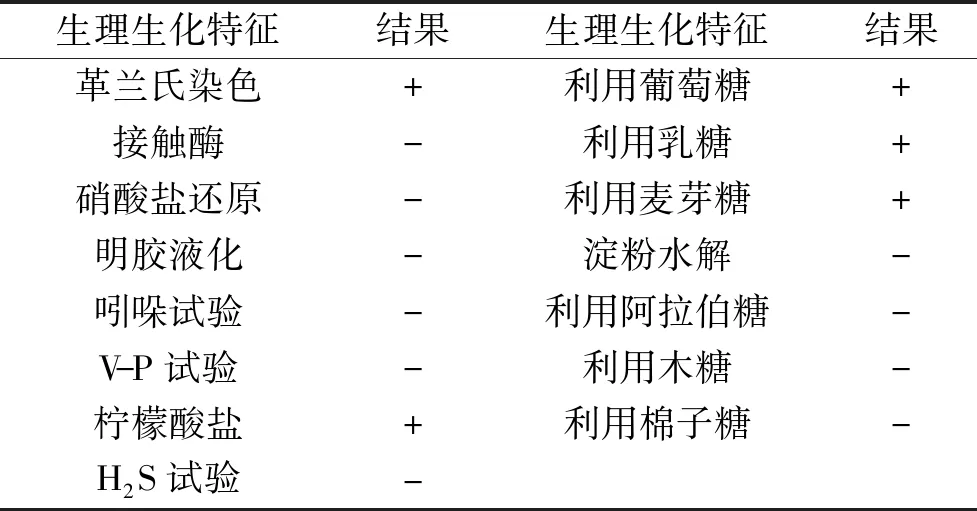
表1 菌株CH-16的生理生化特性Table 1 Physiological and biochemical characters of strain CH-16
注意:“+”表示呈现阳性,“-”表示呈阴性。
菌株CH-16克隆获得的16S rDNA序列在NCBI中用BLAST搜索比对,得到与其同源的基因序列,并用MEGA软件对这些序列进行分析,构建系统进化树。由图2可知,该菌株与发酵乳杆菌处于同一进化分支,菌株CH-16 16S rDNA序列同L.fermentum有99%的同源性。综合生理生化鉴定与菌体形态进一步确定菌株为发酵乳杆菌(Lactobacillusfermentum)。目前,国内外已报道了从泡菜、发酵肉、发酵鱼、奶酪、动物肠道等材料中分离到产细菌素乳酸菌,如Gao等[6]从发酵黄瓜中分离出一种产细菌素LactococcusgarvieaeLG34菌株;Hu等从发酵肉[1]类中分离产细菌素LactobacillusalimentariusFM-MM4;Pei等[17]从康普茶中分离出细菌素产生菌株Lactobacillusplantarum。乳酸菌属早已被证实是安全无毒的菌种,发酵乳杆菌也已经被确认为GRAS(Generally Recognized as Safe)物质[11]。目前虽然从泡菜中分离出多种产细菌素的乳酸菌菌株,但发酵乳杆菌鲜有报道。

图2 基于发酵乳杆菌CH-16 16S rDNA序列系统发育树Fig.2 Phylogenetic tree drived from the 16S rDNA sequence of L. fermentum CH-16 strain
2.2 乳酸菌生长动力学及细菌素合成
结果如图3所示。菌株接种后3 h进入指数生长期,快速生长至12 h后菌株生长减缓,从24 h左右进入稳定期,OD600在2.2左右维持稳定。抗菌物质BLF52在发酵9 h即指数中后期开始合成,从抑菌活力曲线来看随着菌体量增长,BLF52的产量也在不断增加,BLF52活力和菌体密度呈现密切正相关。当发酵时间达到21~30 h时,即菌株对数期的后期、稳定期的前期,发酵液中BLF52活力达到最大875 AU/mL。在30~36 h这段时间里BLF52抑菌活性有所下降,推测菌体释放的蛋白酶降解了部分细菌素。从菌体生长曲线和细菌素合成量判断,BLF52为初级代谢产物。细菌素产量高低是评价其是否具有开发应用价值的重要指标。以S.aureus为指示菌株BLF52最大活力为875 AU/mL,相比来源于LeuconostocmesenteroidesE131[18](1280 AU/mL)、Lactobacillusparacasei[19](1800 AU/mL)、StaphylococcushaemolyticusMSM[20](2500 AU/mL)等微生物的细菌素产量略低,但考虑到本研究的菌株为初步筛选获得的野生菌株,还未经过诱变筛选,也未经发酵培养基及发酵条件优化,故抗菌物质BLF52发酵活力还有较高的提升空间。
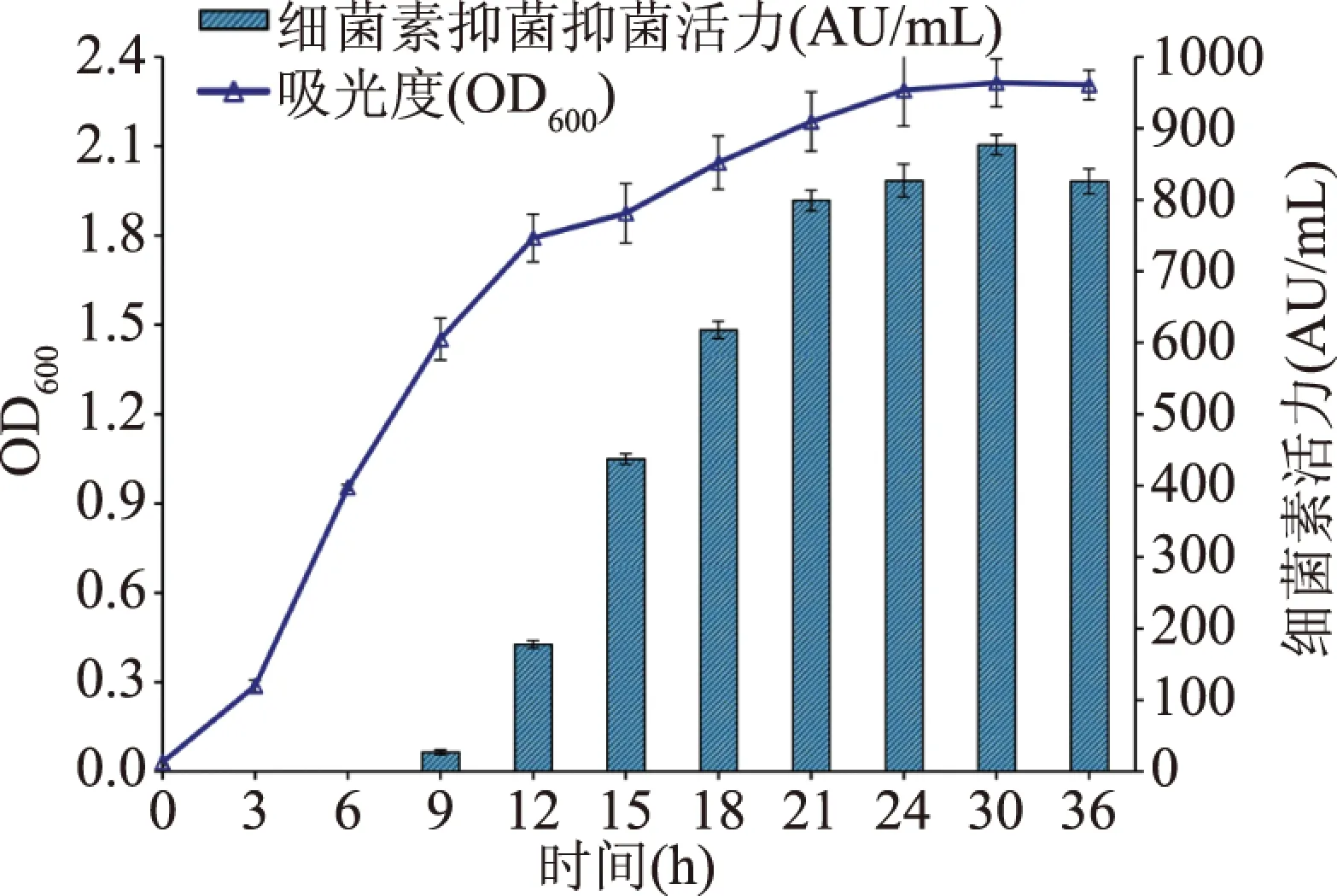
图3 发酵乳杆菌CH-16生长动力学及细菌素BLF52合成Fig.3 Growth kinetics of L. fermentum CH-16 and bacteriocin BLF52 production
2.3 细菌素分离纯化
发酵上清液CFS经硫酸铵盐析、透析和超滤后上样Sephadex G-15层析柱进一步纯化,经洗脱得到68管收集洗脱液,每管收集4 mL,所有洗脱管分为7组样品分别以S.aureus检测抑菌活性,结果显示第5组样品含有抑菌活性,其它无活性显示。硫酸铵盐析、透析及超滤去除了部分色素及杂蛋白,并有效浓缩样品为后续高效柱层析提供基础。凝胶过滤层析去除了大量残余色素,并将细菌素同大分子蛋白高效分离。经过前期纯化后的细菌素样品合并浓缩后进一步通过半制备液相色谱纯化,液相色谱图如图4所示,在80 min的洗脱时间中共洗脱出9个峰,且第9峰以后无洗脱峰出现,表明洗脱完全,分别对这九个峰值洗脱液通过滤纸片法检测抑菌活性,如图4中所示,第6峰可以观察到明显的抑菌圈,其他八个峰没有抑菌圈出现。由此表明,前期的分离纯化虽然去除了大量蛋白、多糖及色素等杂质,但不能得到单一组分,半制备液相分离出很多杂质峰,将细菌素和杂质实现了较好的分离。目前,国内外文献报道了细菌素多种纯化方法,如阴离子交换层析、凝胶过滤层析[21]、硫酸铵沉淀[21]、阳离子交换层析及RP-HPLC等。同文献报道的纯化方法相比,本研究纯化步骤相对简单,特别是半制备高效液相色谱法纯化效率高,可以借鉴使用。

图4 细菌素BLF52的高效液相色谱纯化Fig.4 Purification of bacteriocin BLF52 by HPLC
2.4 Tricine-SDS-PAGE分子量测定
将经过85%硫酸铵饱和度沉淀、透析、超滤浓缩、Sephadex G-15凝胶分子筛层析及HPLC等各纯化步骤后收集的抑菌活性组分进行Tricine-SDS-PAGE检测,结果如图5所示,1号泳道显示清晰的单一蛋白条带,基本无杂质蛋白。2号为凝胶原位抑菌实验结果,显示明显的抑菌带,其位置同1号泳道蛋白条带位置一致,表明纯化得到的条带为细菌素样品。根据标准分子量蛋白相对迁移率计算得到细菌素分子量5.6 kDa,处于大部分报道的细菌素分子量范围内。不同来源的细菌素分子量往往不同,源自LactobacillusacidophilusMS1细菌素为6.5 kDa[21];PediococcusacidilacticiHW01的细菌素为6 kDa[22];Lysinibacillussp.的细菌素为51 kDa[23],均高于本研究细菌素分子量。而源自LactobacillusalimentariusFM-MM4的细菌素为1.104 kDa[1],Lactobacillusplantarum细菌素3.4 kDa[24],均小于本实验的细菌素。而且本研究的细菌素分子量同最近报道的源于LactobacillusfermentumBZ532(1.105 kDa)细菌素分子量差异显著,故BLF52可能是一种新型的细菌素。

图5 纯化的细菌素BLF52 Tricine-SDS-PAGE分析Fig.5 Tricine-SDS-PAGE of purified bacteriocin BLF52注:M:超小标准分子量蛋白Marker; 1:HPLC活性峰样品;2:凝胶原位抑菌实验。
2.5 细菌素BLF52稳定性
2.5.1 细菌素的蛋白酶敏感性 热稳定性和酸碱稳定性是细菌素能否作为食品防腐剂应用的重要指标之一。部分纯化的BLF52经蛋白酶K、胃蛋白酶、胰蛋白酶和木瓜蛋白酶处理后,细菌素活性完全丧失,表明纯化的抑菌物质是具有蛋白质特性结构,而α-淀粉酶处理后,抑菌活性基本无变化,由此表明抑菌物质结构中不存在与其活性重要相关的淀粉链。文献报道的LactobacillusplantarumMBSa4[25]、LactobacillussakeiGM3[26]等乳酸菌细菌素在蛋白酶作用后失去全部活性,但Perumal等[27]报道的EnterococusfaecalisCV7细菌素活性几乎不受多种蛋白酶的影响,表明不同细菌素其氨基酸组成和结构不同,则对不同蛋白酶的敏感性有差别。
2.5.2 细菌素的热稳定性 BLF52在温度40~80 ℃之间稳定性较好(图6),相对活性均保持在90%以上,80 ℃以后抑菌活性开始出现明显下降,但在100 ℃抑菌活性仍保持86.2%,在121 ℃处理15 min后,抑菌活性在43.5%,这与EnterococcusfaecalisKT2W2G[15]细菌素相似,其在100 ℃附近较为稳定,在121 ℃加热30 min后,其活性降低至50%。不同来源的细菌素的温度稳定性不同[5,28],说明不同微生物菌株所合成的细菌素结构不同,氨基酸的构成存在差异。
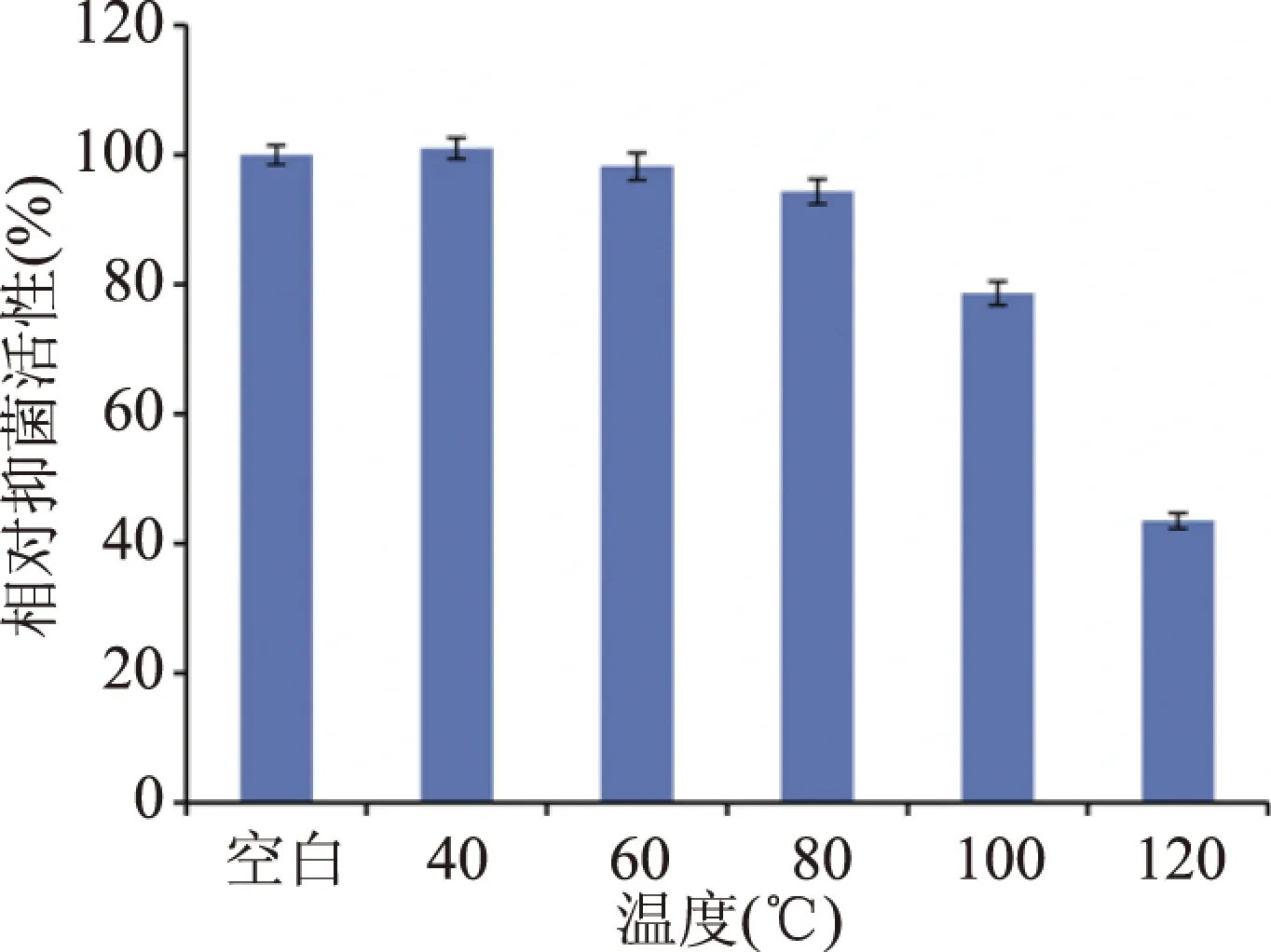
图6 细菌素BLF52热稳定性Fig.6 Thermostability of bacteriocin BLF52
2.5.3 细菌素的酸碱稳定性 细菌素BLF52在pH2.0~7.0之间,相对活性都保持在90%以上(图7);pH8.0~10.0稳定性逐渐降低,pH10时活性保持在43.6%。由此看出BLF52更适合弱酸性或中性环境下使用,这与其他文献报道的细菌素稳定性相类似但又不完全相同,Wen等[29]从LactobacillusplantarumK25中分离的细菌素pH稳定性在2.0~8.0之间;Lv等[5]研究的细菌素pH稳定性在2.5~5.5之间。细菌素BLF52在使用环境pH7.0以下的酸性范围效果更佳。

图7 细菌素BLF52 pH稳定性Fig. 7 pH stability of bacteriocin BLF52
2.6 细菌素BLF52抑菌谱
细菌素BLF52抑菌情况如表2所示,对革兰氏阳性菌如单增李斯特菌、金黄色葡萄球菌、藤黄微球菌、枯草芽孢杆菌及蜡样芽胞杆菌有非常强的抑菌活性,对粪肠球菌稍弱,对乳酸乳球菌、保加利亚乳杆菌和植物乳杆菌无抑菌活性;对革兰氏阴性细菌大肠杆菌、铜绿假单胞菌、伤寒沙门氏菌、副溶血性弧菌有较弱的抑菌活性,对志贺氏菌无抑菌活性。整体看,指示菌对BLF52的敏感性存在差异,革兰氏阳性菌相比革兰氏阴性菌对BLF52更敏感,BLF52对所试的全部乳酸菌无作用,这与目前国内外所研究的乳酸菌素对乳酸菌类基本无抑制作用的特性相一致[30]。但BLF52对常见的食源性致病菌表现出广谱抑菌特性,如对单增李斯特菌、金黄色葡萄球菌、蜡样芽孢杆菌、伤寒沙门氏菌、铜绿假单胞菌、大肠杆菌、副溶血性弧菌菌有抑菌活性,这对其在食品中作为防腐剂使用对食品安全性具有重要意义。根据以往的文献报道,乳酸菌抑菌物质的抑菌谱较窄[31],对革兰氏阴性菌没有明显的抑制作用,而且不同菌种产生的细菌素抑制谱不同[1,5],同报道的文献相比,BLF52在抑制食源性致病菌方面更有优势,其有潜力开发为天然食品防腐剂。
2.7 细菌素对S. aureus的抑制作用
细菌素BLF52对S.aureus生长抑制情况如图8所示,从不加BLF52的曲线来看,0~2 h菌体处于延迟期,生长缓慢;在2~8 h内,菌体生物量增长迅猛,曲线较陡,吸光度值从0.045升至1.797,而在8 h之后,菌体生物量增长速率逐渐缓慢。在菌体生长2 h后添加不同量的细菌素,2~4 h,菌体生长依然均呈现延迟期的特征,生长缓慢,但4 h后,两者菌体量都开始逐渐增加,但同空白对照相比,菌体繁殖速度显著缓慢;指示菌培养12 h后,添加10% CFS的指示菌培养液吸光值达到0.602,且12~24 h吸光值无明显变化,24 h后开始增加;添加20% CFS的培养液菌体生长情况较10%的抑制作用更为强烈,14 h后菌体量逐渐减少,26 h吸光值达到最低0.125。整体表明细菌素对生长中的S.aureus有显著的抑制作用,并通过杀菌模式达到抑菌作用。本研究细菌素对指示菌的抑制情况同文献报道的EnterococcusfaeciumAQ71[16]细菌素相似。

图8 发酵乳杆菌CH-16发酵液CFS 对S. aureus的抑制作用Fig.8 Effect of cell-free supernatant(CFS)of strain L. fermentum CH-16 on the growth of S. aureus
3 结论
本研究从传统泡菜中分离到一株产细菌素菌株L.fermentumCH-16。通过分子筛凝胶层析和HPLC纯化到单一组分细菌素,其分子量同已报道发酵乳杆菌细菌素有显著区别,推测BLF52为一种新型细菌素。BLF52对G+菌及G-菌均有抑菌活性,但对G+菌抑制活性更强,对常见的食源性致病菌如单增李斯特菌、金黄色葡萄球菌、蜡样芽孢杆菌、伤寒沙门氏菌、铜绿假单胞菌、大肠杆菌、副溶血性弧菌菌有抑菌活性,但对所试乳酸菌无抑菌活性。BLF52热稳定性好,100 ℃加热30 min,活性扔接近80%;且具有良好的酸碱耐受性,pH2.0~7.0环境下2 h活性保持80%以上。细菌素BLF52有潜力在食品特别是酸性食品中作为生物防腐剂使用。

