凝结芽孢杆菌XZQ-16抗菌脂肽分离鉴定及抗菌特性
高兆建,王秋芬,胡鑫强,宋玉林,赵宜峰,陈 腾,*
(1.徐州工程学院食品与生物工程学院,江苏徐州 221018; 2.河北省秦皇岛市海滨林场,河北秦皇岛 066100; 3.长江桂柳食品睢宁有限公司,江苏徐州 221000)
随着社会经济发展,人们生活质量不断提高,对食品的外观、质地、风味等的期望值也越来越高。食品工业发展迅速,据统计,截至2018年已有超过2500种各种各样的添加剂用于食品工业[1]。其中化学合成食品防腐剂,如硝酸盐、苯甲酸钠、山梨酸钾、山梨酸、苯甲酸、丙酸和对羟基苯甲酸等,可有效防止食品腐败变质、延长食品保质期,但对人体健康有潜在危害[2]。所以天然、安全、高效、广谱天然防腐剂成为研究热点和发展趋势。微生物是天然防腐剂的重要来源,以枯草芽孢杆菌(Bacillussubtilis)、地衣芽孢杆菌(Bacilluslicheniformis)和解淀粉芽孢杆菌(Bacillusamyloliquefaciens)为代表的芽孢杆菌属微生物可产生超过20多种抗菌化合物[3],如枯草芽孢杆菌产生的subtilin和subtilosin A抗菌肽对多种细菌有抑制作用[4]。这些抗菌化合物中有潜力应用于食品防腐的主要有两类,一类为细菌素,但目前已经商业化生产的仅有乳酸乳球菌(Lactococcuslactis)产生的乳酸链球菌素和多粘类芽孢杆菌(Paenibacilluspolymyxa)产生的片球菌素(pediocin PA-1)[5];另一类是抗菌脂肽,是芽孢杆菌属细菌经非核糖体途径合成的由亲水肽键和亲油脂肪烃链组成的化合物[6],与细菌素相比,抗菌脂肽具有更强的耐热性和抗蛋白酶降解能力[7]。此外,脂肽还表现出抗细菌、抗真菌、抗肿瘤、抗病毒、抗支原体等能强大的生物活性[8],因此抗菌脂肽有希望成为替代传统化学防腐剂的新的抗菌剂。另外,也因其具有广谱、高效、安全无毒、不易产生耐药性、易被生物降解等特点使得其在农业、食品、医药、化妆品、环保、畜牧业等领域备受关注,成为应用研究的热点。
芽胞杆菌是自然界分布广泛的一类细菌,具有极强的抗逆能力和抗菌活性。研究表明芽胞杆菌能分泌多种抗菌物质,包括大分子抗菌蛋白、小分子抗菌脂肽、磷脂类、类噬菌体颗粒、细菌素和挥发性抑菌物质等。其中抗菌脂肽更具有开发应用潜力。芽孢杆菌中的脂肽主要包括表面活性素(Surfactin)、伊枯草菌素(Iturins)和芬芥素(Fengycin)3大类[9]。其中Surfactin对G+和G-细菌有显著的抑制作用[10],同时也具有抑制炎症因子的表达、抗病毒、抑制肿瘤细胞的生长等功能[11];伊枯草菌素具有溶血性和强大的体外抗真菌功能,对多种植物病原菌都有较强的防治作用,但抑制细菌的能力较弱;芬芥素有强的抗真菌活性,无抗细菌活性[12]。不同种类脂肽抗菌特异性不同,Balan等[13]从库尔勒海洋杆菌SBK-47(Pontibacterkorlensis)菌种中分离的脂肽对滕黄微球菌(Micrococcusluteus)和伤寒沙门氏菌(Salmonellatyphi)等有强烈的抑制作用,但未见其对真菌的抑菌报道;Rodríguez-Chávez等[14]从枯草芽孢杆菌Q11(Bacillussubtilis)分离的脂肽对索氏根霉菌(Rhizoctoniasolani)及膨胀性青霉菌(Penicilliumexpansum)等病原真菌有抑制作用,但对铜绿假单胞菌(Pseudomonasaeruginosa)等细菌没有抑制效果。虽然国内外对脂肽的研究较多,但主要围绕脂肽用作表面活性剂或植物病虫害防治方面;近年来脂肽在食品防腐领域也有一些报道,但存在抗菌谱窄、稳定性差、产量低等各种缺陷,限制了脂肽在食品防腐领域的应用。脂肽在芽孢杆菌属细菌中广泛存在,不同的芽孢杆菌所产生的脂肽其结构和抑菌特性往往不同,故深入挖掘产脂肽菌种资源,寻找新的脂肽并研究其特性对开发天然安全健康的食品防腐剂具有重要意义。
课题组前期从山东传统发酵大豆食品豆豉中分离出一株芽孢杆菌XZ15,对多种常见食品腐败菌有明显抑制作用,经过生理生化及分子鉴定确定菌株XZ15为凝结芽孢杆菌。为提高菌株所产抑菌物质产量,经紫外与化学诱变选育得到B.coagulans诱变菌株XZQ-16,该菌株抗菌活性较野生菌株提高1.2倍且抗菌谱广。本研究以诱变菌株XZQ-16为出发菌株,分离纯化菌株发酵液中抗菌物质、分析鉴定抗菌物质组成、研究抗菌特性,为利用芽孢杆菌及其脂肽类抑菌物质、进一步开发新型天然食品防腐剂提供依据。
1 材料与方法
1.1 材料与仪器
实验菌株 为经诱变的凝结芽孢杆菌(Bacilluscoagulans)XZQ-16;供试指示菌见表1;LB培养基、PDA培养基 参考向亚萍等[15]方法配制;TSA-YE 按照蒲月华等[16]的方法配制;NA培养基 按照李全胜等[17]的方法配制;发酵培养基(w/v) 蔗糖2%,蛋白胨1%,酵母粉0.5%,NH4NO30.2%,KH2PO40.3%,MgSO40.02%,CaCl20.02%,MnSO40.02%,pH7.0~7.2;Sephadex LH-20葡聚糖凝胶 美国GE公司;脂肽色谱纯标准品iturin、Surfactin 美国Sigma公司;高效液相色谱分析柱Zorbax SB-C18(4.6 mm×150 mm,5 μm) 美国安捷伦公司;柱层析硅胶 青岛海洋化工厂;蛋白酶K(30 U/mg)、胃蛋白酶(3000 U/mg)、胰蛋白酶(2500 U/mg)、胰凝乳蛋白酶(1500 U/mg)、脂肪酶(500 U/mg) 上海源叶生物科技有限公司。
3K30型台式冷冻离心机 德国Sigma公司;1100series高效液相色谱仪 美国Agilent公司;冷冻干燥机 美国GOLD-SIM公司;AKTA蛋白纯化系统 美国GE Healthcare公司;Nicolet 380型傅里叶变换红外光谱仪 美国Thermo Fisher Scientific公司;SHB-Ⅲ型旋转蒸发仪 郑州长城科工贸有限公司。
1.2 实验方法
1.2.1 脂肽粗提物制备 将B.coagulansXZQ-16菌株接种到LB培养基中,250 mL三角瓶装培养基50 mL,37 ℃于180 r/min振荡摇床中培养18~24 h;按照8%接种量接种到装有100 mL发酵培养基的250 mL三角瓶中,37 ℃,180 r/min振荡发酵60 h;发酵液8000 r/min,离心15 min,收集上清;用6 mol/L盐酸调节pH至2.0,4 ℃冰箱静置过夜;8000 r/min,离心20 min,倒掉上清液保留沉淀,用pH2.0的盐酸洗涤沉淀两次后,少量甲醇多次萃取,萃取液合并再于旋转蒸发仪中35 ℃减压浓缩,得到的糊状粗提物冷冻干燥,即为脂肽粗提物。
1.2.2 脂肽纯化
1.2.2.1 快速硅胶柱色谱层析 参考文献[18-19]报道的方法,并结合前期研究基础采用快速硅胶柱色谱法对活性粗脂肽分段层析。色谱柱规格:77 mm×93 mm。柱料:硅胶。洗脱液:二氯甲烷和甲醇按如下体积比配制8种洗脱液各300 mL。二氯甲烷/甲醇(v/v)=100∶0、50∶1、25∶1、10∶1、5∶1、2∶1、1∶1和0∶100。采用琼脂孔扩散法测定各流分的抑菌活性[20]。
1.2.2.2 Sephadex LH-20柱层析 参照文献[21]报道的方法,并稍作改动。快速硅胶柱得到的活性组分进一步用Sephadex LH-20(60 cm×2.9 cm)层析柱分离,以50%甲醇为流动相,洗脱速度为1.5 mL/min,按照3 mL/管收集。蛋白纯化系统自动检测280 nm处的吸光值。洗脱结束后对洗脱峰收集管检测抑菌活性。多次循环洗脱后,将有活性的组分合并,并用吹氮器50 ℃吹干。
抑菌活性测定采用琼脂孔扩散法。吸取培养至对数期的蜡状芽孢杆菌菌液200 μL涂布于LB固体培养基,晾干后打孔,取洗脱峰样品150 μL注入孔中,37 ℃培养24 h,观察抑菌活性。
1.2.3 反相高效液相色谱 采用分析型高效液相色谱检测活性组分化学组成。液相色谱条件:Zorbax SB-C18分析柱(4.6 mm×150 mm,5 μm),进样量:20 μL,柱温25 ℃,检测波长:220 nm,梯度洗脱:流动相A:甲醇;B:含0.01%三氟乙酸(Trifluoroacetic acid,TFA)水溶液,30 min内A由80%升至100%,流速:0.3 mL/min。
1.2.4 傅立叶红外变换光谱分析 采用KBr压片法。将200 mg在玛瑙研钵研细至2 μm左右的KBr粉末在110~150 ℃烘箱中充分烘干(约需48 h),并与2 mg样品充分研磨均匀。在真空下加压成直径为5或13 mm的半透明薄片。以空白KBr片为对照,采用傅里叶变换红外光谱仪在500~4000 cm-1区域对样品进行红外吸收光谱扫描分析。
1.2.5 脂肽抗菌谱测定 吸取150 μL稀释至1×106CFU/mL的指示菌孢子或菌体悬液涂布于对应培养基上;表面晾干后用6 mm的打孔器打孔;注入经Sephadex LH-20层析分离的脂肽100 μL(300 μg/mL),以无菌水为阴性对照,28 ℃培养2~3 d(细菌37 ℃培养18~24 h),测抑菌圈直径。
1.2.6 脂肽抗菌特性 温度对脂肽抑菌活性的影响:将溶于100 mmol/L的磷酸缓冲溶液(pH7.5)抗菌脂肽分别置于50、60、70、80、100、110、120 ℃温度下保温30 min(110和120 ℃均以高压灭菌锅保温处理)后抑菌活性。
pH对脂肽抑菌活性的影响:使用50 mmol/L不同pH的缓冲液将脂肽调节其pH为2.0~12.0,在25 ℃下作用2 h后将pH调回7.5,测定抑菌活性。
脂肽酶降解酶稳定性:在脂肽溶液中分别加入终浓度为2 mg/mL的胃蛋白酶、胰蛋白酶、胰凝乳蛋白酶、蛋白酶K和脂肪酶,并调节至其最适pH,在各自适宜温度下孵育2 h,再在80 ℃下处理5 min灭活酶,将pH调回到pH7.5,测定抑菌活性。
以上脂肽抑菌特性实验均以培养至对数期的蜡状芽孢杆菌和金黄色葡萄球菌为指示菌,琼脂孔扩散法检测抑菌活性,抑菌圈直径表示活性大小。以室温保存并未经任何处理的脂肽为空白对照。
1.3 数据处理
所有检测实验均重复3次,结果以平均值±标准差表示。原始数据用Excel 2010整理后,采用统计学软件SPSS 19.0进行试验结果进行差异显著性分析,比较试验中不同处理间差异。P小于0.05认为有统计学意义。
2 结果与分析
2.1 脂肽的分离纯化
菌株XZQ-16发酵液经离心去菌体、发酵液上清酸沉淀、甲醇萃取、低压旋转蒸发浓缩、冷冻干燥得到黄褐色的粗脂肽,得率为589.85 mg/L。粗脂肽进一步硅胶柱分离,得到14个流分,分别收集每个流分并以蜡样芽孢杆菌为指示菌检测其抑菌活性,如图1A所示,具有明显抑菌活性的有:流分G8(二氯甲烷∶甲醇=5∶1,洗脱)、流分G9和流分G10(二氯甲烷∶甲醇=2∶1,洗脱)。活性流分合并后Sephadex LH-20凝胶层析纯化,得到Ⅰ、Ⅱ、Ⅲ、Ⅳ四个洗脱峰(图2),分别检测抑菌活性,如图1B所示,洗脱峰III有较强抑菌活性,但与蛋白洗脱峰不完全对应,初步估计发酵液中可能存在两种不同类型的抗菌物质。将活性收集管合并进一步高效液相色谱分析。
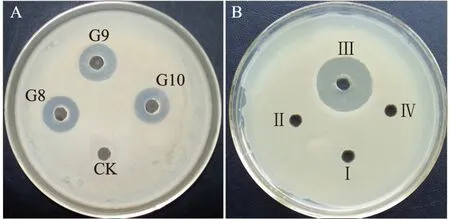
图1 B. coagulans XZQ-16脂肽分离组分的抑菌活性Fig.1 Antibacterial activity of the isolated components of lipopeptide from B. coagulans XZQ-16注:A:硅胶柱层析;B:Sephadex LH-20凝胶层析。

图2 B. coagulans XZQ-16脂肽Sephadex LH-20凝胶层析Fig.2 Sephadex LH-20 gel chromatography of lipopeptide from B. coagulans XZQ-16
2.2 高效液相色谱分析
将经过硅胶柱层析和Sephadex LH-20层析分离的抗菌物质HPLC分析。图3C可见抗菌物质经HPLC分离后得到3个主要峰簇,并且每个峰簇是由多个峰构成,说明每个组分都不是单一物质,这与报道的脂肽类化合物通常是由多种同系物构成的观点相一致[22]。标准品iturin经HPLC分离后出现了3个主要的峰,保留时间分别为6.675、7.927和8.334 min(图3A),这3个峰为iturin同系物。样品的峰簇I出现了多个峰,保留时间分别为6.512、7.742、8.241 min,其保留时间与标准品iturin三个峰的保留时间基本一致,根据文献报道ituin类脂肽通常最先出峰[23],故初步认定样品中峰簇I为iturin。标准品surfactin出现四个峰,对应保留时间分别是19.127、19.751、20.678和21.273 min,样品的峰簇III主峰周围有多个小峰,其中四个峰保留时间为19.137、19.763、20.261和21.273 min,同标准品非常接近,初步认为第三个峰簇为surfactin。峰簇II和标准品对比区别较大,可能是其他化合物。

图3 B. coagulans XZQ-16脂肽高效液相色谱Fig.3 HPLC for lipopeptides produced by B. coagulans XZQ-16注:A:脂肽标准品iturin;B:脂肽标准品surfactin; C:B. coagulans XZQ-16样品。
2.3 脂肽傅里叶红外光谱分析
取经过Sephadex LH-20柱层析纯化的样品FT-IR分析,结果如图4所示。在FT-IR图谱上,3315.2 cm-1是由分子链间氢键引起的NH收缩振动谱带,1647.3和1558.3 cm-1处是酰胺谱带Ⅰ和Ⅱ,以上特征说明抗菌物质分子中具有肽链结构。2925.6~2853.7、1413.5~1332.2 cm-1的两处吸收为脂肪酸碳链上的C-H键伸缩振动峰,1712.4 cm-1为内酯链的特征吸收峰。根据以上特征,推测菌株XZQ-16产生的抗菌分子是一类环脂肽类物质,与文献报道的脂肽类抗菌剂结构特性相一致[24-26]。
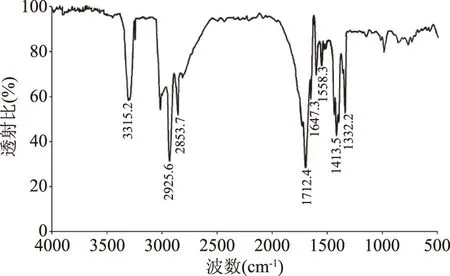
图4 B. coagulans XZQ-16脂肽红外光谱Fig.4 FT-IR of lipopeptide produced by B. coagulans XZQ-16
2.4 脂肽抗菌特性分析
2.4.1 脂肽抗菌谱 对经过Sephadex LH-20层析分离得到的活性峰Ⅲ样品做抗菌谱实验,结果显示B.coagulansXZQ-16脂肽对供试的食品腐败菌和食源性致病菌均有抑制作用(表1),其中革兰氏阴性菌4株,革兰氏阳性菌5株,这些食源性致病菌、腐败菌广泛存在于土壤中,容易污染不同类型的食物,尤其是畜产品食物,从而引起呕吐或腹泻型疾病[27]。抑菌情况整体看,Ⅲ样品对革兰氏阳性菌比对革兰氏阴性菌抑菌效果强,对真菌也有抑制作用,相比细菌较弱。脂肽对易导致食品及水源污染、对公共卫生构成巨大威胁的沙门氏菌、大肠杆菌及金黄色葡萄球菌有较好的抑制作用[27]。因此B.coagulansXZQ-16脂肽有潜力作为化学防腐剂的替代品在食品工业中应用。目前已经在食品防腐中使用的天然防腐剂有乳酸链球菌素(nisin)[28]、片球菌素(pediocin PA-1)[29]和植物乳杆菌素(plantaricin UG1)[30]。目前脂肽还没有作为食品防腐剂商业化开发使用,B.coagulansXZQ-16脂肽对其他食源性致病菌的作用还有待进一步研究。
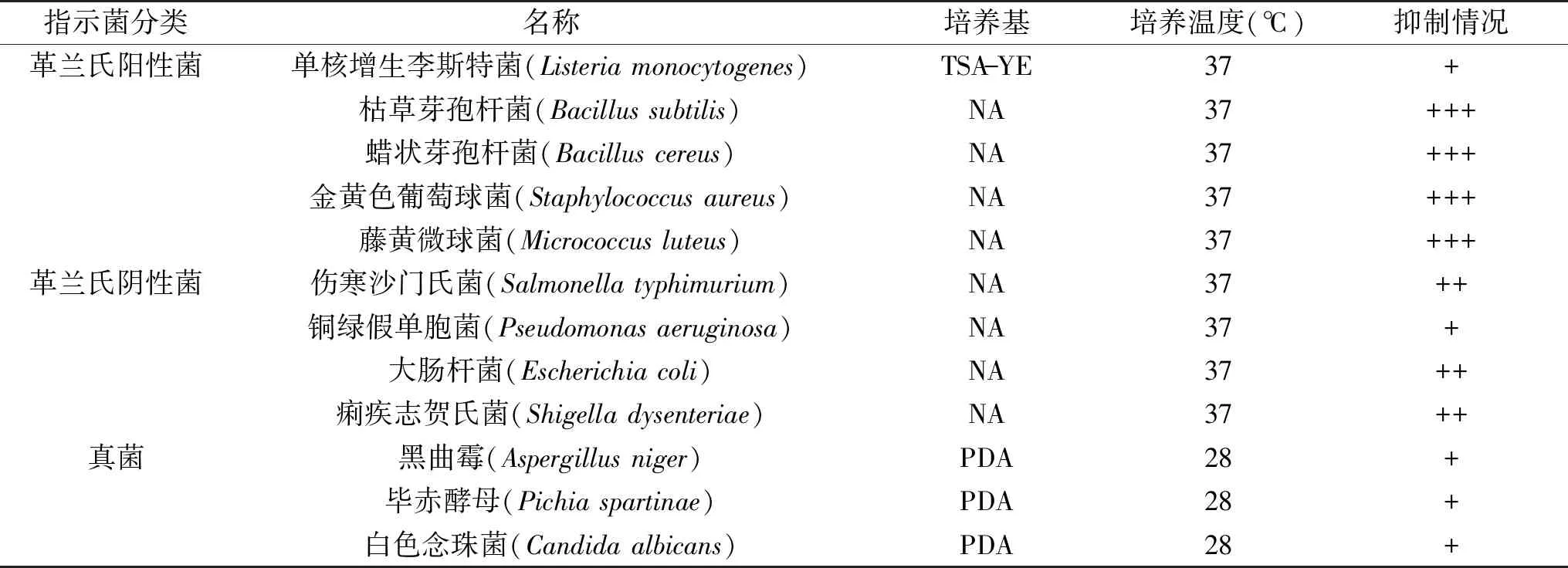
表1 脂肽对不同指示菌的抑菌作用Table 1 Inhibitory activity of lipopeptide against different indicator bacteria
2.4.2 温度对脂肽抑菌活性的影响 在苛刻的条件下,脂肽的高稳定性是评价其是否有应用价值的重要标准之一。因此,有必要研究不同温度对脂肽稳定性的影响。如图5所示,在50~100 ℃下保存30 min脂肽抑菌活性基本无变化,在110 ℃时,抑菌活性仍保持85%以上,在120 ℃下,抑菌活性仅仅下降了18%。B.coagulansXZQ-16脂肽对热的稳定性同其他报道的脂肽相似[31],可以耐受食品加工中如巴氏杀菌等高温工艺过程。
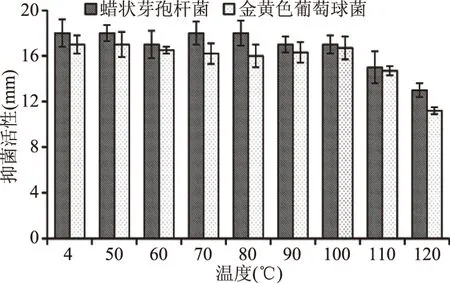
图5 温度对B. coagulans XZQ-16脂肽抑菌活性影响Fig.5 Effects of temperature on antimicrobial activity of B. coagulans XZQ-16 lipopeptide
2.4.3 pH对脂肽稳定性的影响 脂肽在多个领域的适用性还取决于其在不同pH下的稳定性。在较宽的pH范围内脂肽稳定性实验结果如图6所示,在pH4~12之间,脂肽对两种指示菌的抑菌效果有略微差异,但抑菌活性均在80%以上,当pH2.0时,脂肽溶液有絮状析出,且抑菌活性略有下降,说明B.coagulansXZQ-16脂肽在极端酸性环境下稳定性弱,但在pH4~12范围非常稳定。通常极端酸性环境可以抑制食品源性腐败及致病菌的生长繁殖,所以B.coagulansXZQ-16脂肽可以在需要添加食品防腐剂的食品中广泛使用。
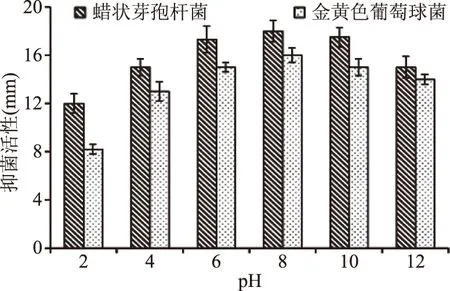
图6 pH对脂肽抑菌活性的影响Fig.6 Effects of pH on antimicrobial activity of lipopeptide
2.4.4 水解酶对脂肽稳定性的影响 脂肽水解酶敏感性研究如图7显示,脂肽经胃蛋白酶和胰蛋白酶处理后抑菌活性无明显变化,说明脂肽对两蛋白酶不敏感;而经胰凝乳蛋白酶处理后,抑菌活性有略微下降,但抑菌率扔保持在80%以上。脂肪酶处理后,抑菌活性下降不明显,脂肽几乎不受脂肪酶的影响。
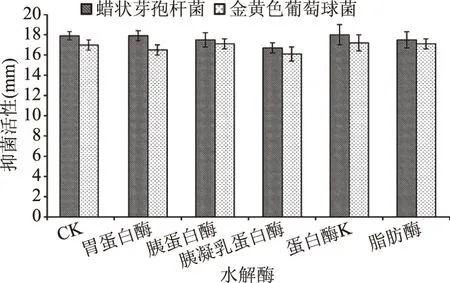
图7 水解酶对脂肽的抗菌活性影响Fig.7 Effects of hydrolytic enzyme on antimicrobial activity of lipopeptide
3 讨论与结论
目前,关于芽孢杆菌属菌株分泌的抗菌脂肽理论和应用研究主要集中在植物病害的防治方面[32],而在食品防腐应用方面研究较少。本研究的B.coagulansXZQ-16脂肽在食品防腐方面具有显著优势。不同类型的脂肽抗菌范围不同[7],本研究在NA和PDA平板上分别测定了抗菌脂肽对常见食品腐败细菌和部分真菌的抗菌活性,在所测细菌中,B.coagulansXZQ-16脂肽对常见的食品腐败菌包括革兰氏阳性和革兰氏阴性菌均具有良好的抑菌效果,同时对真菌也有不同程度的抑制作用。因此,B.coagulansXZQ-16脂肽在食品防腐方面具有潜在的应用价值。
B.coagulansXZQ-16脂肽经酸沉淀、有机溶剂萃取、硅胶柱层析后进一步采用SephadexLH-20凝胶柱层析,明显减少了液相色谱检测时大量杂质的干扰,结果更精确、操作简便、纯化效率高、成本低,最后得到抗菌脂肽样品直接进行高效液相色谱检测确定其组分。目前对脂肽类抗菌化合物的鉴定主要采用液相色谱分析结合质谱鉴定,根据化合物的保留时间和分子量判断抗菌物质类别。本研究从菌株XZQ-16发酵液中分离纯化出一种对食源性致病菌有广谱抗菌活性的抑菌物质,高效液相色谱分析发现,该物质与标样iturin和surfactin对应的特征峰具有相同的保留时间,据此推断该活性物质为iturin和surfactin类脂肽化合物。为进一步证明抗菌物质为脂肽,进行了傅里叶红外光谱扫描,分析发现样品分子中含有酰胺键、脂肪碳链等环脂肽类化合物所具有的结构,据此进一步确认抗菌物质为脂肽类化合物。据研究报道,芽孢杆菌属菌株可同时产生多种不同类型的脂肽化合物,Jemil等[33]报道了甲基营养型芽孢杆(Bacillusmethylotrophicus)DCS1可同时产生iturin A、Fengycin和surfacetin A三种类型的脂肽,每种类型还有多种同系物。
脂肽要应用于食品、畜牧、化妆品及农业生防等行业中,除了需要有良好的抗菌性能外,还需要能够耐受较为苛刻的环境。稳定性是衡量脂肽优良的重要指标,陆雅琴等[34]报道可产生脂肽类抗菌剂的芽孢杆菌P6无菌发酵滤液在pH3~9范围内较稳定,在碱性范围内稳定性差,对温度也具有较好的稳定性,100 ℃处理30 min仍保持84.76%的抗菌活性,121 ℃处理15 min后抗菌物质失活;张宝俊等[35]从解淀粉芽胞杆菌发酵液中分离到的抗菌物质在较广的范围内(pH3~11)稳定性好,但121 ℃处理0.5 h即丧失活性;葛平华等[36]报道的海洋解淀粉芽胞杆菌抗菌物质对蛋白酶、光照、紫外线及高温均表现出良好稳定性,但酸碱稳定性差,pH<4或pH>10时几乎抑菌活性完全丧失。B.coagulansXZQ-16脂肽对热和酸碱的稳定性与之相比更为突出,在50~110 ℃下处理30 min,抑菌活性保持在85%以上,在pH4.0~12.0的环境下处理2 h,抑菌活性保持80%以上。多种蛋白酶和脂肪酶处理后,脂肽抑菌活性几乎不发生变化。因此,B.coagulansXZQ-16脂肽具有优良的热稳定性、酸碱耐受性和抗消化酶的水解能力。在食品加热灭菌及饲料造粒等受热加工过程中,都可以保持较好的稳定性。
本研究通过酸沉淀、有机溶剂萃取、硅胶柱层析以及Sephadex LH-20柱层析从B.coagulansXZQ-16发酵液中分离纯化到了抗菌脂肽,通过傅里叶红外光谱分析确定抗菌物质为脂肽类化合物,反向高效液相色谱分析确定抗菌脂肽为iturin和surfactin类脂肽同系物。抗菌谱分析显示脂肽同目前商业化应用的乳酸链球菌素(nisin)和片球菌素(polymyxin B)在抑菌谱方面更具优势,B.coagulansXZQ-16脂肽对常见的食源性致病菌包括革兰氏阳性菌和革兰氏阴性菌都具有明显的抑菌活性,并对真菌生长也有一定的抑制作用。热稳定性、酸碱稳定性以及水解酶敏感性实验表明,该B.coagulansXZQ-16脂肽是一种相当稳定的抗菌化合物。基于以上较好的生物及理化特性,B.coagulansXZQ-16脂肽有望在食品防腐、化妆品行业、医药行业、农业等相关行业应用。该研究为寻找新的安全性的食品防腐剂提供了新的思路。下一步将在探明B.coagulansXZQ-16菌株来源抗菌脂肽的抑菌作用机理、基因工程技术提高脂肽表达量、发酵优化提高脂肽产量等方面开展工作,为后续开发相关产品提供研究基础。

