细胞生长和非生长相结合的拟干酪乳杆菌高效生产L-乳酸研究
张 悦,田锡炜,庄英萍,3
(1.华东理工大学生物工程学院,上海 200237; 2.华东理工大学发酵工程实验教学示范中心,上海 200237; 3.华东理工大学生物反应器工程国家重点实验室,上海 200237)
乳酸是一种天然存在的有机酸,其广泛应用于食品、医药、化工、化妆品、材料等众多行业[1-2]。由于乳酸的分子结构中有一个手性的碳原子,因此乳酸有两种光学结构,其中L-乳酸被认为是安全无害的[3-4]。目前,有80%以上的乳酸作为风味剂、pH调节剂、酸化剂以及防腐剂等被用于食品工业中,这也大大增加了食品市场对L-乳酸的需求,因此,如何实现L-乳酸发酵过程的高效生产一直是研究的热点。
虽然已有报道多种微生物能够生产乳酸[5-8],但是商业乳酸生产主要通过乳酸菌发酵来实现[9]。拟干酪乳杆菌是一种潜在的工业乳酸生产菌,其具有良好的乳酸生产能力,能够在高初始葡萄糖浓度的条件下高效生产L-乳酸[10-12]。通过Luedeking-Piret模型对乳酸发酵过程进行模拟后发现,其产物合成与生长相关系数要大于非生长相关系数,因此乳酸菌代谢葡萄糖生产乳酸的过程被认为是一个与细胞生长非常相关的过程[13-15]。批发酵模式是最常用的乳酸生产方式,但是在实际乳酸发酵过程中往往会出现发酵结束时菌体代谢活力仍很高的情况,因此这也就为后续较高密度细胞再发酵提供了可行性。高密度发酵能够有效增加细胞对底物的转化,同时在消耗少量营养物质的情况下,提高底物转化率,并减少发酵罐清洗、种子制备、细胞生长等一系列辅助时间,从而提升发酵罐的体积产率和生产效率[16-20]。因此,在乳酸发酵过程中,可以利用批发酵结束时细胞高活性的特点,形成静息细胞的高密度发酵策略,从而实现乳酸生产效率的提高。
本研究通过考察拟干酪乳杆菌非生长状态下细胞代谢葡萄糖生产乳酸的能力,以及利用高细胞密度开发偶联细胞生长和细胞非生长相关的乳酸组合生产新模式,从而提高产物生成速率以及底物利用速率、转化率,实现乳酸高效生产。
1 材料与方法
1.1 材料与仪器
拟干酪乳杆菌(LactobacillusparacaseiNCBIO-01) 国家生化工程技术研究中心(上海)保藏菌株;葡萄糖 上海泰坦科技股份有限公司;蛋白胨(Peptone)、酵母提取物(Yeast Extract) Oxoid;牛肉提取物(Beef Extract) 生工生物工程(上海)股份有限公司;其他试剂 来源于国药集团化学试剂有限公司。
5 L搅拌式生物反应器 上海国强生化工程装备有限公司;pH和溶氧(DO)电极 美国梅特勒-托利多公司;752紫外可见分光光度计 上海菁华科技仪器有限公司;SBA-40D生化分析仪 山东省科学院;FM-8P全自动冰点渗透压计 上海医大仪器厂;高效液相色谱柱(Metacarb H柱)、安捷伦1100高效液相色谱仪 美国安捷伦公司。
1.2 实验方法
1.2.1 培养基成分 种子培养基(g/L):蛋白胨10,牛肉提取物10,酵母提取物10,柠檬酸氢二铵2,磷酸氢二钠2,无水乙酸钠4,硫酸镁0.2,硫酸锰0.2,氯化钠0.03,硫酸铁0.01,碳酸钙25,吐温-80 1 mL/L,氢氧化钠调节初始培养基pH为6.0,115 ℃灭菌20 min,葡萄糖溶液(40 g/L)与其他成分分开配制,115 ℃灭菌20 min。发酵培养基(g/L):蛋白胨 13.33,酵母提取物 13.33,无水乙酸钠 0.67,硫酸镁 0.0133,硫酸锰 0.0133,氯化钠 0.0133,硫酸铁 0.0133,115 ℃灭菌20 min。葡萄糖溶液与其他成分分开配制,115 ℃灭菌20 min。
1.2.2 培养条件 种子培养:用50 mL无菌水将新鲜茄子瓶斜面中的菌体悬浮,取15 mL悬浮液接种于85 mL种子培养基中,在37 ℃,110 r/min培养箱中培养12 h;摇瓶发酵培养:将20 mL种子培养液接种于80 mL发酵培养基中,接种量为20%,250 mL三角摇瓶置于37 ℃,110 r/min培养箱中培养24 h,发酵初始加入25 g/L碳酸钙调节过程pH;5 L罐发酵培养:发酵过程中工作体积为4 L,接种量为20%,温度和转速分别为37 ℃和150 r/min,通气量为0.125 vvm。发酵过程通过自动反馈不断补入25%(w/w)氨水溶液作为中和剂维持过程pH为6.0。
1.2.3 不同初糖浓度下L-乳酸生产 在5 L发酵罐中配制不同浓度初始葡萄糖(100、120、140、160、180 g/L),进行拟干酪乳杆菌L-乳酸生产发酵,考察细胞生长、葡萄糖消耗和L-乳酸生产情况。
1.2.4 不同静息细胞浓度下L-乳酸生产 将拟干酪乳杆菌细胞在5 L发酵罐中培养14 h后,离心(0 ℃,10000 r/min)3 min,获得稳定期静息细胞菌体。菌体用葡萄糖溶液进行重悬,使得溶液中细胞浓度分别为2.35、4.69、7.43、9.36、11.94、14.12、16.47、18.55 g/L。在100 mL摇瓶考察中,配制初始葡萄糖浓度为60 g/L;在5 L发酵罐考察中,初始葡萄糖浓度分别配制为80、100、120、140 g/L。摇瓶中添加10 g/L碳酸钙作为中和剂,发酵罐中通过不断补入25%(w/w)氨水溶液维持pH在6.0。
1.2.5 高渗条件下静息细胞生产L-乳酸 在5 L发酵罐中(60 g/L初始葡萄糖),以1 mol/L NaCl作为高渗条件,考察稳定期(发酵14 h后)静息细胞(4.36 g/L)在添加高渗条件和未添加高渗条件下,细胞葡萄糖消耗和L-乳酸生产的情况。培养过程中,通过自动反馈不断补入25%(w/w)氢氧化钙溶液维持pH在6.0。
1.2.6 细胞生长和非生长相关组合的L-乳酸高效生产 同时在两个5 L发酵罐中(140 g/L初始葡萄糖)进行拟干酪乳杆菌生产L-乳酸批发酵(第一阶段)。待批发酵结束后,通过离心(0 ℃,10000 r/min,3 min),用100 g/L葡萄糖溶液将菌体重悬并合并在一起,继续进行静息细胞的L-乳酸生产(第二阶段),直至葡萄糖降零后结束。
1.2.7 细胞生物量测定 用稀盐酸稀释发酵液至一定浓度,以稀盐酸作为对照,在紫外可见分光光度计下测定620 nm 波长时的吸光值,使得测定的光密度值(OD)处于0.2~0.8之间。细胞生物量通过细胞干重(DCW)来表示,两者关系为:1 OD相当于0.41 g/L DCW。
1.2.8 发酵液L-乳酸和葡萄糖测定 取一定量发酵液在5000 r/min条件下离心10 min,弃去菌体,稀释上清液使得葡萄糖和L-乳酸浓度分别处于1和0.5 g/L以下。L-乳酸和葡萄糖浓度通过SBA-40C生物传感分析仪进行测定。
1.2.9 发酵液渗透压测定 将发酵液稀释一定倍数,使得测定样品的渗透压处于300~800 mOsm/kg之间,再通过FM-8P全自动冰点渗透压计进行发酵液渗透压的测定。
1.2.10 葡萄糖消耗速率计算方法 根据一定时间内发酵液中葡萄糖浓度的变化量计算得到此时间内葡萄糖消耗速率,具体公式如下:
rs=(S1-S2)/(t2-t1)
式中:rs表示葡萄糖消耗速率,g/L/h;S1和S2分别表示t1和t2时刻发酵液中葡萄糖浓度,g/L。
1.2.11 L-乳酸生产速率计算方法 根据一定时间内发酵液中L-乳酸的含量计算得到此时间内L-乳酸生产速率,具体公式如下:
rp=(P2-P1)/(t2-t1)
式中:rp表示L-乳酸生产速率,g/L/h;P1和P2分别表示t1和t2时刻发酵液中L-乳酸浓度,g/L。
1.2.12 L-乳酸比生产速率计算方法 根据一定时间内细胞生产L-乳酸的量以及菌体的浓度计算得到此时间内L-乳酸比生产速率,具体公式如下:
Qp=(P2-P1)/(t2-t1)/X
式中:Qp表示比生产速率,g/g/h;P1和P2分别表示t1和t2时刻发酵液中L-乳酸浓度,g/L;X表示菌体浓度,g/L。
1.2.13 L-乳酸转化率计算方法 根据一定时间内发酵液中葡萄糖浓度和L-乳酸浓度的变化计算得到此时间内L-乳酸转化率,具体公式如下:
Yp=(P2-P1)/(S1-S2)
式中:Yp表示L-乳酸转化率,g/g;P1、P2、S1和S2分别表示t1和t2时刻发酵液中L-乳酸浓度和葡萄糖浓度,g/L。
2 结果与分析
2.1 不同初始葡萄糖浓度下拟干酪乳杆菌生产L-乳酸
葡萄糖作为拟干酪乳杆菌生产L-乳酸的底物,其浓度的高低决定着最终L-乳酸的产量以及整体发酵过程的生产效率[21-22]。从图1A可以看出,虽然初始葡萄糖浓度从100 g/L增加到180 g/L,但是细胞的生长并未受到葡萄糖浓度的影响,生长期均为12 h左右,而且最大生物量也相差不大。从L-乳酸合成以及葡萄糖的消耗变化图来看(图1B和C),发现只有当初始葡萄糖浓度在140 g/L以下时,菌体能够在较短时间内完全耗尽葡萄糖,并生成L-乳酸,且整体生产效率相差不大。当初始葡萄糖浓度为160 g/L时,虽然菌体在发酵前中期表现出近似低初始葡萄糖浓度下的生产能力,但是在发酵后期无法完全耗尽葡萄糖(图1B和C),这是因为氨水作为中和剂时,高初始葡萄糖浓度条件下发酵后期菌体会受到严重的高渗应激,因此影响葡萄糖代谢和L-乳酸生产;此外,180 g/L初始葡萄糖浓度条件下,菌体不但在发酵后期受到强烈的高渗应激,其中前期发酵可能也受限于高底物浓度抑制,呈现出相对缓慢的生产能力(图1B和C)。另一方面,虽然乳酸菌生产乳酸过程被认为是一个与生长非常相关的过程,但是从生产速率来看,初始葡萄糖浓度低于140 g/L条件下,发酵结束时,菌体仍表现出非常强的代谢活性,因此,在接下来的实验中,考察了不同稳定期静息细胞浓度生产L-乳酸的能力,为后续进一步开发偶联细胞生长和细胞非生长相关的乳酸组合生产新模式提供理论和数据支撑。
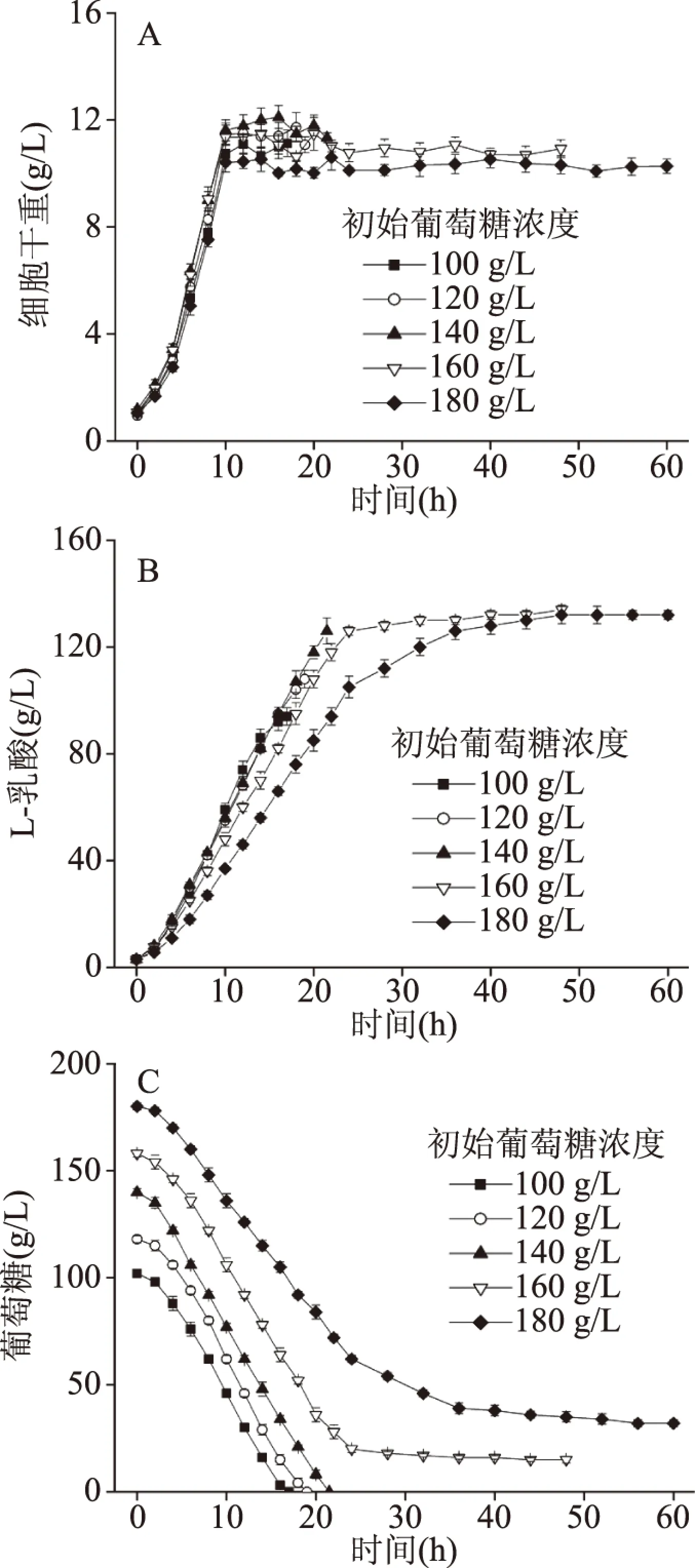
图1 初始葡萄糖浓度对拟干酪乳杆菌生长(A)、 L-乳酸生产(B)和葡萄糖消耗(C)的影响Fig.1 Effects of different initial glucose concentrations on cell growth(A),L-lactic acid production(B) and glucose consumption(C)of L. paracasei
2.2 不同稳定期静息细胞浓度生产L-乳酸能力
通过在5 L发酵罐(140 g/L初始葡萄糖浓度)中培养细胞至稳定期(14 h),冷冻离心获取菌体后,在摇瓶(60 g/L初始葡萄糖浓度)中配制成不同细胞浓度(2.35、4.69、7.43、9.36、11.94、14.12、16.47、18.55 g/L)进行L-乳酸生产能力考察。从图2A和C可以看出,在起始的2 h内,L-乳酸产量与细胞浓度呈线性关系,这也说明此阶段内菌体比生产速率基本维持不变,但是随着时间的增加,较低细胞浓度仍能维持与初始阶段一致的比生产速率,而高细胞浓度的比生产速率则明显下降,这更有可能是由于高细胞浓度在前期会产生高浓度的乳酸[23],因此发酵液中高浓度产物会明显抑制菌体的代谢,而不是随着时间的增加,细胞代谢活性下降[24-25]。在接下来的实验中,将在5 L发酵罐中对高细胞浓度(18.55 g/L)进行L-乳酸生产能力考察,确定影响菌体代谢能力的时间范围。
在图2B中,初始葡萄糖浓度为80和100 g/L时,菌体能够非常快速地消耗完所有的葡萄糖(5和6.4 h),并生成L-乳酸,其葡萄糖消耗速率和L-乳酸生成速率分别为16.0、15.8 g/(L·h)和15.6、15.3 g/(L·h)。虽然初始葡萄糖浓度120和140 g/L条件下菌体也能完全耗尽所有葡萄糖(9和15 h),但是其葡萄糖消耗速率和L-乳酸生成速率分别较100 g/L条件时下降15.8%、41.8%和17.0%、43.3%。这些实验结果表明稳定期静息细胞能够在6 h左右内仍维持很高的代谢活性,而且完全耗尽100 g/L的初始葡萄糖,生成98 g/L的L-乳酸。

图2 不同浓度静息细胞在摇瓶(A)和5 L发酵罐(B)中 代谢能力的考察以及摇瓶中比生产速率的比较(C)Fig.2 Study of metabolic capacity of resting cells in shake flask(A)and 5 L bioreactor(B),and comparison of specific L-lactic acid productivity in shake flask(C)
2.3 高渗条件对稳定期静息细胞生产L-乳酸的影响
为了进一步探索6 h以后细胞代谢活性下降的原因,在摇瓶中考察了高渗环境对稳定期静息细胞生产L-乳酸的能力(图3)。从图3B中可以看出,高渗条件下环境渗透压为2200 mOsm/kg左右,与上述100 g/L初始葡萄糖浓度条件下发酵结束时环境渗透压相当,而图3A则表明高渗条件并不会对稳定期静息细胞量以及初期细胞代谢产生影响,但是随着发酵的进行(6 h以后),细胞的代谢能力明显下降。因此,在后续开发偶联细胞生长和细胞非生长相关的乳酸组合生产新模式过程中,将在第一阶段采用140 g/L初始葡萄糖浓度进行两个平行罐的发酵,当其发酵结束后,将两个罐细胞通过离心收集后继续进行第二阶段发酵(100 g/L初始葡萄糖浓度),从而减少一系列发酵辅助时间,提高生产效率和生产能力。
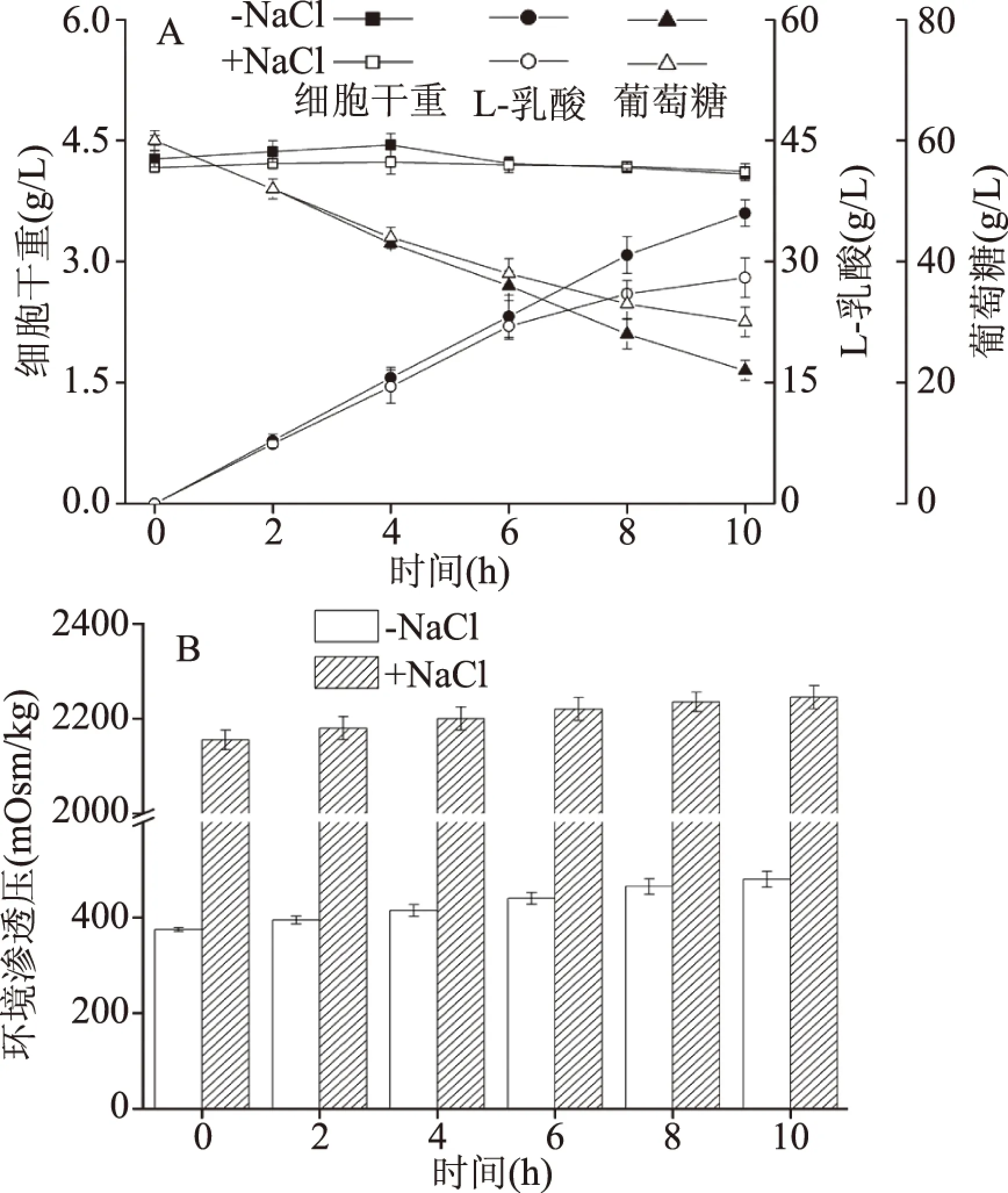
图3 高渗环境对静息细胞代谢能力的影响Fig.3 Effect of high osmolality on metabolic capacity of resting cells
2.4 细胞生长和非生长相关组合的L-乳酸高效生产
在拟干酪乳杆菌发酵生产L-乳酸过程中,只要调节初始葡萄糖浓度在140 g/L范围内,细胞就能快速地耗完所有葡萄糖,并且发酵结束时细胞在一定时间范围内(6~7 h)仍有很强的代谢活性,因此可用于稳定期静息细胞的发酵,从而提高发酵过程整体生产效率。从图4中可以看出,在第一阶段,两批平行发酵能够很快地耗尽140 g/L左右初始葡萄糖,产生近126 g/L的L-乳酸,其葡萄糖消耗速率和L-乳酸生产速率分别为6.3 g/(L·h)和5.9 g/(L·h),L-乳酸转化率为0.940 g/g。当第一阶段结束后,将两批平行发酵罐菌体通过离心合并继续进行静息细胞发酵,此时初始葡萄糖浓度为102 g/L。由于此时细胞浓度为第一阶段单个发酵罐生物量的1.7倍左右,菌体能够在7 h内耗尽所有的葡萄糖,生成98 g/L的L-乳酸,其葡萄糖消耗速率、L-乳酸生产速率和L-乳酸转化率分别达到了14.6、14.4 g/(L·h)和0.985 g/g。由此可知,虽然处理稳定期静息细胞的时间可能需要1 h左右,但是在第二阶段的生产速率要远远大于第一阶段,而且需要指出的是,第二阶段由于不存在细胞生长的原因,其L-乳酸转化率也要明显高于第一阶段,从而能够进一步提高生产效率。

图4 拟干酪乳杆菌细胞生长 和非生长相关组合的L-乳酸高效生产Fig.4 Efficient L-lactic acid production based on the combination of cell growth related and unrelated modes by L. paracasei注:空心图标表示常规批发酵条件下细胞生长、 L-乳酸生产和葡萄糖消耗的变化;实心图标 表示细胞生长和非生长相关组合下细胞生长、 L-乳酸生产和葡萄糖消耗的变化; 相同形状的空、实心图标所代表的测定指标相同。
3 结论
拟干酪乳杆菌在140 g/L初始葡萄糖浓度条件下,能够快速生长并代谢葡萄糖生成L-乳酸,同时在发酵结束后,其稳定期静息细胞能够在一定时间范围内(6~7 h)仍保持非常高的细胞代谢活性。因此,通过开发基于细胞生长和非生长相关组合的高细胞密度L-乳酸生产策略,能够使得拟干酪乳杆菌细胞在常规发酵结束后继续高密度高效生产L-乳酸,其生产速率是常规发酵阶段的2.4倍,而且L-乳酸转化率也表现出明显的提升,达到0.985 g/g,非常接近理论值(1.0 g/g)。本研究开发的发酵过程策略最终实现了生产效率提升的目的,同时也能为工业乳酸生产过程提供借鉴。

